名校
1 . 活性氧化锌(ZnO)常用于医药、涂料、陶瓷等。某科研小组以锌废料(主要成分是ZnSO4和ZnO,含少量的Fe、Cu、Pb、As等元素以及油污)为原料制备活性氧化锌及回收其他金属元素,流程如图。
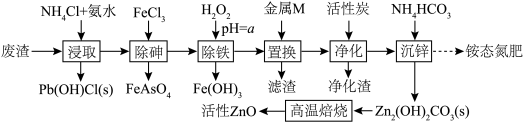
已知几种金属离子生成氢氧化物的pH如下表:
回答下列问题:
(1)As的原子结构示意图为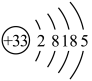 。FeAsO4中铁的化合价为
。FeAsO4中铁的化合价为______ 价。
(2)“浸取”中,适当加热能提高浸取速率,但是温度过高,浸取速率反而降低,其主要原因是______ 。
(3)a的范围为______ 。“除铁”时发生氧化还原反应的离子方程式为______ 。
(4)金属M的化学式为______ 。
(5)“沉锌”的滤液采用______ 、______ ,过滤、洗涤、干燥等一系列操作,得到铵态氮肥。
(6)“高温焙烧”过程中发生反应的化学方程式为______ 。

已知几种金属离子生成氢氧化物的pH如下表:
| 金属离子 | 开始沉淀的pH | 完全沉淀的pH |
| Fe3+ | 1.5 | 3.7 |
| Zn2+ | 7.9 | 10.0 |
| Fe2+ | 6.3 | 9.7 |
| Cu2+ | 7.4 | 9.4 |
(1)As的原子结构示意图为
 。FeAsO4中铁的化合价为
。FeAsO4中铁的化合价为(2)“浸取”中,适当加热能提高浸取速率,但是温度过高,浸取速率反而降低,其主要原因是
(3)a的范围为
(4)金属M的化学式为
(5)“沉锌”的滤液采用
(6)“高温焙烧”过程中发生反应的化学方程式为
您最近一年使用:0次
2024-03-29更新
|
131次组卷
|
2卷引用:2024届西藏自治区拉萨市高三上学期第一次模拟考试理综试题
名校
解题方法
2 . 我国科学家利用锰族催化剂(Mn4CaOx,x代表氧原子数)解密光合作用。锰簇在S3Yz·态的可逆结构异构化如图。
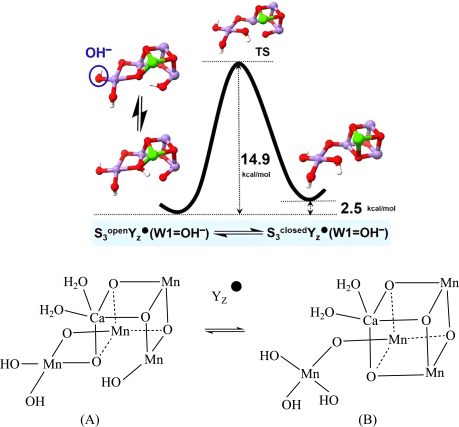
请回答下列问题:
(1)基态锰原子电子排布式为______ 。
(2)锰族催化剂Mn4CaOx中所含元素电负性由大到小的顺序为______ (用元素符号表示),Mn元素位于元素周期表第______ 周期第______ 族。
(3)根据上图可知,稳定性:A______ B(填“>”“<”或“=”)。
(4)1molA含______ molH-Oσ键。
(5)CaO晶胞与NaCl晶胞属于同种类型,如图所示。

①前者的熔点明显高于后者,其主要原因是______ 。
②该晶胞中含有Ca2+的数目为______ ,距离O2-最近的Ca2+的数目有______ 个。
③已知:Ca2+和O2-的核间距为apm,NA为阿伏加德罗常数的值。则CaO晶体密度为______ g/cm3.

请回答下列问题:
(1)基态锰原子电子排布式为
(2)锰族催化剂Mn4CaOx中所含元素电负性由大到小的顺序为
(3)根据上图可知,稳定性:A
(4)1molA含
(5)CaO晶胞与NaCl晶胞属于同种类型,如图所示。

①前者的熔点明显高于后者,其主要原因是
②该晶胞中含有Ca2+的数目为
③已知:Ca2+和O2-的核间距为apm,NA为阿伏加德罗常数的值。则CaO晶体密度为
您最近一年使用:0次
2024-03-29更新
|
264次组卷
|
2卷引用:2024届西藏自治区拉萨市高三上学期第一次模拟考试理综试题
名校
3 . 爱美之心人皆有之,近年来美容行业盛行。3-异丙基苯甲酸甲酯(Ⅶ)和2-异丙基苯甲酸甲酯(Ⅷ)是美肤美甲必不可少的成分。3-异丙基苯甲酸甲酯的合成路线如下:
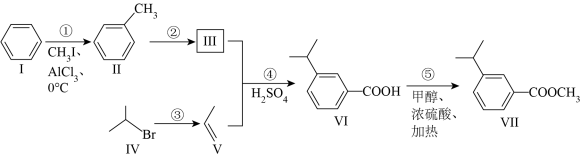
已知:苯环上甲基邻位的C-H更容易断裂,羧基间位的C-H更容易断裂。
(1)反应①中,AlCl3是催化剂,除Ⅱ外,另一生成物是______ 。
(2)化合物Ⅲ和化合物Ⅴ通过反应④生成化合物Ⅵ是该合成路线的核心反应,回答下列问题:
①化合物Ⅲ可命名为______ 。
②根据化合物Ⅵ的结构特征,分析预测其可能的化学性质,完成下表:
(3)化合物Ⅶ有许多同分异构体,满足下列条件的同分异构体有______ 种。
a)苯环上只有两条侧链;b)侧链之一为-COOCH3
写出其中峰而积之比为6:3:2:2:1的结构简式:______ 。
(4)采用以上相似的合成路线,以苯和2-溴丙烷为原料,合成化合物Ⅷ(2-异丙基苯甲酸甲酯,结构如图),先将2-溴丙烷通过反应③得到丙烯、苯通过反应①得到甲苯。回答下列问题:
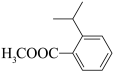
①写出下一步的化学方程式:______ 。
②甲苯不立即进行反应②的原因是______ 。

已知:苯环上甲基邻位的C-H更容易断裂,羧基间位的C-H更容易断裂。
(1)反应①中,AlCl3是催化剂,除Ⅱ外,另一生成物是
(2)化合物Ⅲ和化合物Ⅴ通过反应④生成化合物Ⅵ是该合成路线的核心反应,回答下列问题:
①化合物Ⅲ可命名为
②根据化合物Ⅵ的结构特征,分析预测其可能的化学性质,完成下表:
| 反应试剂、条件 | 反应形成的新结构 | 反应类型 |
| 加成反应 |
(3)化合物Ⅶ有许多同分异构体,满足下列条件的同分异构体有
a)苯环上只有两条侧链;b)侧链之一为-COOCH3
写出其中峰而积之比为6:3:2:2:1的结构简式:
(4)采用以上相似的合成路线,以苯和2-溴丙烷为原料,合成化合物Ⅷ(2-异丙基苯甲酸甲酯,结构如图),先将2-溴丙烷通过反应③得到丙烯、苯通过反应①得到甲苯。回答下列问题:

①写出下一步的化学方程式:
②甲苯不立即进行反应②的原因是
您最近一年使用:0次
2024-03-29更新
|
93次组卷
|
2卷引用:2024届西藏自治区拉萨市高三上学期第一次模拟考试理综试题
名校
解题方法
4 . 维生素C,又称L-抗坏血酸,用于治疗坏血病,也可用于各种急慢性传染性疾病及紫癜等辅助治疗等。维生素C的结构简式如图所示。下列关于维生素C的说法错误的是
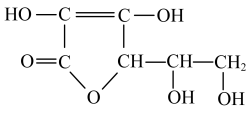

| A.维生素C中含有C、H、O三种元素 |
| B.分子中含有羰基 |
| C.能发生水解、氧化、消去反应 |
| D.能使酸性KMnO4溶液褪色 |
您最近一年使用:0次
2024-03-29更新
|
139次组卷
|
2卷引用:2024届西藏自治区拉萨市高三上学期第一次模拟考试理综试题
名校
5 . 设NA代表阿伏德罗常数的值。下列说法正确的是
| A.18gH2O中含有中子的数目为10NA |
| B.标准状况下,22.4LH2O含氧原子总数为3NA |
| C.在锌铜原电池中,负极减少65g时理论上转移电子数为2NA |
| D.在4Na+O2=2Na2O中,46gNa参与反应时需要氧化剂分子数为NA |
您最近一年使用:0次
2024-03-29更新
|
176次组卷
|
2卷引用:2024届西藏自治区拉萨市高三上学期第一次模拟考试理综试题
名校
6 . 硅锰电池是一种新型电池,其工作原理如图所示。下列说法错误的是
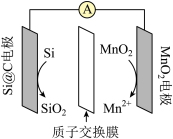

| A.Si@C电极为电池的负极 |
| B.电池工作时,H+向MnO2电极区移动 |
| C.电池放电时,MnO2发生还原反应 |
| D.放电时,当导线上每通过0.2mol电子,则会生成0.1molSiO2 |
您最近一年使用:0次
2024-03-29更新
|
259次组卷
|
2卷引用:2024届西藏自治区拉萨市高三上学期第一次模拟考试理综试题
名校
解题方法
7 . 短周期主族元素X、Y、Z、R、W的原子序数依次增大,R为地壳中含量最高的元素,乙在元素周期表中与R相邻,Y、Z原子序数之和为12。X、Y、W组成一种有机合成中常见的还原剂M,结构式如图所示。下列推断正确的是
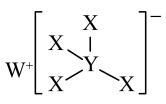

| A.原子半径:W>R>Z | B.W2R2是离子化合物 |
| C.熔点:W2R>ZX3>X2R | D.WZR3能破坏水的电离平衡 |
您最近一年使用:0次
2024-03-29更新
|
170次组卷
|
2卷引用:2024届西藏自治区拉萨市高三上学期第一次模拟考试理综试题
解题方法
8 . I.氮及其化合物与人类生产、生活息息相关。回答下列问题:
(1)固氮酶有铁蛋白和钒铁蛋白两种,它们不仅能够催化N2还原成NH3,还能将环境底物乙炔催化还原成乙烯。
①V2+基态时核外电子排布式为_______ 。
②C、N、O三种元素第一电离能从大到小的顺序是_______ 。
③下列说法正确的有_______ 。
A.C2H2、C2H4都是非极性分子 B.碳负离子 呈三角锥形
呈三角锥形
C.NO+电子式为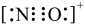 D.NH3沸点比N2高,主要是因为前者是极性分子
D.NH3沸点比N2高,主要是因为前者是极性分子
(2)NaN3可用于汽车安全气囊。写出两种与 互为等电子体的分子或离子
互为等电子体的分子或离子_______ 。
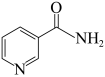
(3)烟酰胺是一种含氮有机物,结构简式如图所示,烟酰胺分子中氮原子的杂化轨道类型有_______ ,1mol该分子中含σ键的数目为_______ 。
Ⅱ.氯化钠是生活中的常用调味品,也是结构化学中研究离子晶体时常用的代表物,其晶胞结构如图所示。

(4)已知在氯化钠晶体中Na+的半径为a pm,Cl-的半径为b pm,它们在晶体中是紧密接触的,则在氯化钠晶体中的空间利用率为_______ (用含a、b的式子表示)。
(5)纳米材料的表面原子占总原子数的比例很大,这是它有许多特殊性质的原因。假设某氯化钠颗粒形状为立方体,边长为氯化钠晶胞的10倍,则该氯化钠颗粒中表面原子占总原子数的百分比为_______ 。
(1)固氮酶有铁蛋白和钒铁蛋白两种,它们不仅能够催化N2还原成NH3,还能将环境底物乙炔催化还原成乙烯。
①V2+基态时核外电子排布式为
②C、N、O三种元素第一电离能从大到小的顺序是
③下列说法正确的有
A.C2H2、C2H4都是非极性分子 B.碳负离子
 呈三角锥形
呈三角锥形C.NO+电子式为
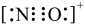 D.NH3沸点比N2高,主要是因为前者是极性分子
D.NH3沸点比N2高,主要是因为前者是极性分子(2)NaN3可用于汽车安全气囊。写出两种与
 互为等电子体的分子或离子
互为等电子体的分子或离子(3)烟酰胺是一种含氮有机物,结构简式如图所示,烟酰胺分子中氮原子的杂化轨道类型有

Ⅱ.氯化钠是生活中的常用调味品,也是结构化学中研究离子晶体时常用的代表物,其晶胞结构如图所示。

(4)已知在氯化钠晶体中Na+的半径为a pm,Cl-的半径为b pm,它们在晶体中是紧密接触的,则在氯化钠晶体中的空间利用率为
(5)纳米材料的表面原子占总原子数的比例很大,这是它有许多特殊性质的原因。假设某氯化钠颗粒形状为立方体,边长为氯化钠晶胞的10倍,则该氯化钠颗粒中表面原子占总原子数的百分比为
您最近一年使用:0次
9 . 二氧化碳催化加氢制甲醇,有利于减少温室气体二氧化碳。回答下列问题:
(1)二氧化碳加氢制甲醇的总反应可表示为:CO2(g)+3H2(g)=CH3OH(g)+H2O(g)
该反应一般认为通过如下步骤来实现:
①CO2(g)+H2(g)=CO(g)+H2O(g) ΔH1=+41kJ/mol
②CO(g)+2H2(g)=CH3OH(g) ΔH2=-90kJ/mol
总反应的△H=_______ kJ/mol;若反应①为慢反应,下列示意图中能体现上述反应能量变化的是_______ (填标号),判断的理由是_______ 。
A.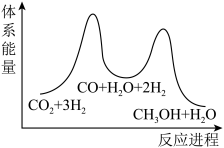 B.
B.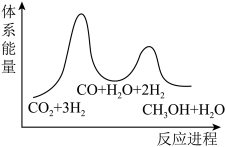
C.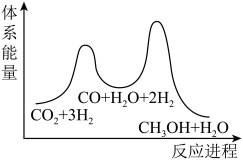 D.
D.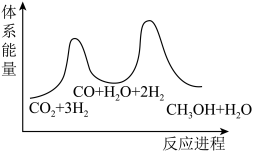
(2)以葡萄糖为燃料的微生物燃料电池结构示意图如图所示。
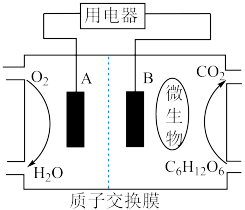
①B为生物燃料电池的_______ (填“正”或“负”)极。
②正极反应式为_______ 。
③电池工作过程中,H+将移向_______ (填“正”或“负”)极。
④在电池反应中,每消耗1mol氧气,理论上生成标准状况下二氧化碳的体积是_______ 。
(1)二氧化碳加氢制甲醇的总反应可表示为:CO2(g)+3H2(g)=CH3OH(g)+H2O(g)
该反应一般认为通过如下步骤来实现:
①CO2(g)+H2(g)=CO(g)+H2O(g) ΔH1=+41kJ/mol
②CO(g)+2H2(g)=CH3OH(g) ΔH2=-90kJ/mol
总反应的△H=
A.
 B.
B.
C.
 D.
D.
(2)以葡萄糖为燃料的微生物燃料电池结构示意图如图所示。

①B为生物燃料电池的
②正极反应式为
③电池工作过程中,H+将移向
④在电池反应中,每消耗1mol氧气,理论上生成标准状况下二氧化碳的体积是
您最近一年使用:0次
名校
解题方法
10 .  是一种半导体材料,基于绿色化学理念设计的制取
是一种半导体材料,基于绿色化学理念设计的制取 的电解池示意图如下,电解总反应:
的电解池示意图如下,电解总反应: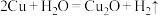 。下列说法正确的是
。下列说法正确的是
 是一种半导体材料,基于绿色化学理念设计的制取
是一种半导体材料,基于绿色化学理念设计的制取 的电解池示意图如下,电解总反应:
的电解池示意图如下,电解总反应: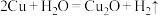 。下列说法正确的是
。下列说法正确的是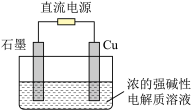
| A.石墨电极发生氧化反应 | B.铜电极接直流电源的负极 |
| C.石墨电极上产生氢气 | D.当有 电子转移时,有 电子转移时,有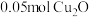 生成 生成 |
您最近一年使用:0次
2024-03-18更新
|
81次组卷
|
2卷引用:西藏拉萨市部分学校2023-2024学年高二上学期12月期末联考化学试题



