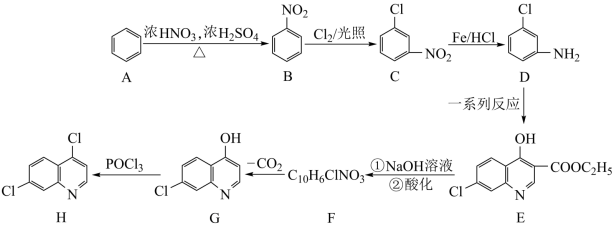
1 . 磷酸氯喹是一种抗疟疾的药物,已在临床上使用多年。同时临床上还发现它对新冠肺炎有一定疗效,且未发现和药物有关的严重不良反应。 是合成磷酸氯喹的中间体,可由苯在一定条件下合成,其合成路线如下:
是合成磷酸氯喹的中间体,可由苯在一定条件下合成,其合成路线如下:
已知:①CH3CH2OH CH3CH2Cl
CH3CH2Cl
②RNH2+R'X RNHR'+HX(X为卤素原子)
RNHR'+HX(X为卤素原子)
③ +NaOH
+NaOH
 +H2O
+H2O
回答下列问题:
(1)E中含氧官能团的名称为___________ 。
(2)A→B,C→D的反应类型分别为___________ ,___________ 。
(3)E→F反应分两步进行,先与氢氧化钠反应,再酸化。请写出E与氢氧化钠反应的化学方程式:___________ 。
(4)由D转化成E的过程中需要使用丙二酸二乙酯,其分子式为C7H12O4,M与丙二酸二乙酯互为同分异构体,写出符合下列条件的M的结构简式:___________ 。
①分子中含有甲基
②1 mol M能与足量的碳酸氢钠溶液反应生成标准状况下的气体44.8 L
③核磁共振氢谱显示只有3组峰,且峰面积之比为9:2:1
(5)参照上述合成路线,请设计以1,4—丁二醇和苯为原料合成 的合成路线(无机试剂任选)
的合成路线(无机试剂任选)____________ 。
 是合成磷酸氯喹的中间体,可由苯在一定条件下合成,其合成路线如下:
是合成磷酸氯喹的中间体,可由苯在一定条件下合成,其合成路线如下:
已知:①CH3CH2OH
 CH3CH2Cl
CH3CH2Cl②RNH2+R'X
 RNHR'+HX(X为卤素原子)
RNHR'+HX(X为卤素原子)③
 +NaOH
+NaOH
 +H2O
+H2O回答下列问题:
(1)E中含氧官能团的名称为
(2)A→B,C→D的反应类型分别为
(3)E→F反应分两步进行,先与氢氧化钠反应,再酸化。请写出E与氢氧化钠反应的化学方程式:
(4)由D转化成E的过程中需要使用丙二酸二乙酯,其分子式为C7H12O4,M与丙二酸二乙酯互为同分异构体,写出符合下列条件的M的结构简式:
①分子中含有甲基
②1 mol M能与足量的碳酸氢钠溶液反应生成标准状况下的气体44.8 L
③核磁共振氢谱显示只有3组峰,且峰面积之比为9:2:1
(5)参照上述合成路线,请设计以1,4—丁二醇和苯为原料合成
 的合成路线(无机试剂任选)
的合成路线(无机试剂任选)
您最近一年使用:0次
2021-03-04更新
|
171次组卷
|
2卷引用:新疆和田地区皮山县2022-2023学年高三上学期11月期中考试化学试题
2014·江苏南京·二模
名校
2 . 碘海醇是一种非离子型X-CT造影剂。下面是以化合物A(分子式为C8H10的苯的同系物)为原料合成碘海醇的合成路线[R为-CH2CH(OH)CH2OH]:
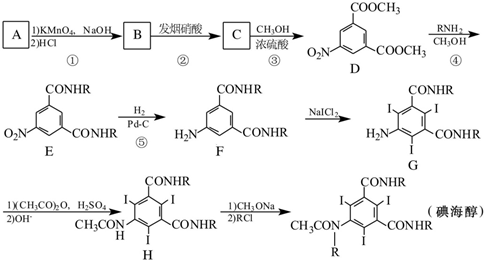
(1)写出A的结构简式:____________ 。
(2)反应①-⑤中,属于取代反应的是____________ (填序号).
(3)写出C中含氧官能团的名称:硝基、____________ 。
(4)写出同时满足下列条件的D的两种同分异构体的结构简式:____________ 。
Ⅰ.含1个手性碳原子的α-氨基酸
Ⅱ.苯环上有3个取代基,分子中有6种不同化学环境的氢
Ⅲ.能发生银镜反应,水解产物之一能与FeCl3溶液发生显色反应
(5)已知:①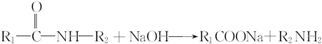
②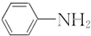 呈弱碱性,易被氧化
呈弱碱性,易被氧化
请写出以 和(CH3CO)2O为原料制备染料中间体
和(CH3CO)2O为原料制备染料中间体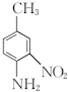 的合成路线流程图(无机试剂任用)
的合成路线流程图(无机试剂任用)____________________ 。合成路线流程图示例如下: 。
。

(1)写出A的结构简式:
(2)反应①-⑤中,属于取代反应的是
(3)写出C中含氧官能团的名称:硝基、
(4)写出同时满足下列条件的D的两种同分异构体的结构简式:
Ⅰ.含1个手性碳原子的α-氨基酸
Ⅱ.苯环上有3个取代基,分子中有6种不同化学环境的氢
Ⅲ.能发生银镜反应,水解产物之一能与FeCl3溶液发生显色反应
(5)已知:①
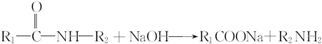
②
 呈弱碱性,易被氧化
呈弱碱性,易被氧化请写出以
 和(CH3CO)2O为原料制备染料中间体
和(CH3CO)2O为原料制备染料中间体 的合成路线流程图(无机试剂任用)
的合成路线流程图(无机试剂任用)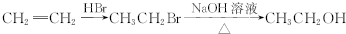 。
。
您最近一年使用:0次
2016-12-09更新
|
277次组卷
|
4卷引用:新疆和田地区和田县克热木依明中学2019届高三第三次模拟考试理科综合化学试题
新疆和田地区和田县克热木依明中学2019届高三第三次模拟考试理科综合化学试题(已下线)2014届江苏省南京市、淮安市高三第二次模拟考试化学试卷2016届江苏省清江中学高三下冲刺模拟四化学试卷江苏省海安高级中学2018-2019学年高二6月月考化学试题
2014·北京东城·零模
解题方法
3 . 2010年美、日三位科学家因钯(Pd)催化的交叉偶联反应获诺贝尔化学奖。一种钯催化的交叉偶联反应如下:
 (R、R’为烃基或其他基团),应用上述反应原理合成防晒霜主要成分K的路线如下图所示(部分反应试剂和条件未注明):
(R、R’为烃基或其他基团),应用上述反应原理合成防晒霜主要成分K的路线如下图所示(部分反应试剂和条件未注明):

已知:① B能发生银镜反应,1 mol B 最多与2 mol H2反应。
② C8H17OH分子中只有一个支链,且为乙基,其连续氧化的产物能与NaHCO3反应生成CO2,其消去产物的分子中只有一个碳原子上没有氢。
③ G不能与NaOH溶液反应。
④核磁共振图谱显示J分子有3种不同的氢原子。
请回答:
(1)B中含有的官能团的名称是______________________________
(2)B→D的反应类型是___________
(3)D→E的化学方程式是_________________________________________
(4)有机物的结构简式:G_______________________ ; K__________________________
(5)符合下列条件的X的同分异构体有(包括顺反异构)_____ 种,其中一种的结构简式是__________ 。
a.相对分子质量是86 b.与D互为同系物
(6)分离提纯中间产物E的操作:先用碱除去D和H2SO4,再用水洗涤,弃去水层,最终通过________ 操作除去C8H17OH,精制得E。
 (R、R’为烃基或其他基团),应用上述反应原理合成防晒霜主要成分K的路线如下图所示(部分反应试剂和条件未注明):
(R、R’为烃基或其他基团),应用上述反应原理合成防晒霜主要成分K的路线如下图所示(部分反应试剂和条件未注明):
已知:① B能发生银镜反应,1 mol B 最多与2 mol H2反应。
② C8H17OH分子中只有一个支链,且为乙基,其连续氧化的产物能与NaHCO3反应生成CO2,其消去产物的分子中只有一个碳原子上没有氢。
③ G不能与NaOH溶液反应。
④核磁共振图谱显示J分子有3种不同的氢原子。
请回答:
(1)B中含有的官能团的名称是
(2)B→D的反应类型是
(3)D→E的化学方程式是
(4)有机物的结构简式:G
(5)符合下列条件的X的同分异构体有(包括顺反异构)
a.相对分子质量是86 b.与D互为同系物
(6)分离提纯中间产物E的操作:先用碱除去D和H2SO4,再用水洗涤,弃去水层,最终通过
您最近一年使用:0次
4 . 二甲醚(CH3OCH3)是无色气体,是柴油的理想替代燃料。清华大学王志良等研究了,由合成气(组成为H2、CO和少量的CO2)一步法制备二甲醚的问题,其中的主要过程包括以下三个反应:
(i)CO(g)+2H2(g) CH3OH(g) △H1=-90.1 kJ/mol
CH3OH(g) △H1=-90.1 kJ/mol
(ii)CO(g)+H2O(g) CO2(g)+H2(g) △H2=-41.1 kJ/mol
CO2(g)+H2(g) △H2=-41.1 kJ/mol
(iii)2CH3OH(g) CH3OCH3(g)+H2O(g) △H3=-24.5 kJ/mol
CH3OCH3(g)+H2O(g) △H3=-24.5 kJ/mol
(1)由H2和CO制备二甲醚(另一产物为CO2)的热化学方程式为________ 。
(2)合成气初始组成为n(H2):n(CO):n(CO2)=0.67:0.32:0.01的反应体系。在250℃和5.0 MPa条件下,在1 L密闭容器中经10 min达到化学平衡时,各组分的物质的量如下表:
则反应(iii)在该条件下的平衡常数是_______ ;在反应进行的10 min内,用CH3OH表示的反应(i)的平均速率是_______ 。
(3)课题组探究了外界条件,对合成气单独合成甲醇反应体系和直接合成二甲醚反应体系的影响。
①图1和图2显示了温度250 ℃和5.0 MPa条件下,合成气组成不同时,反应达到平衡时的情况。(图中M代表甲醇、D代表二甲醚、D+M代表甲醇和二甲醚。下同)

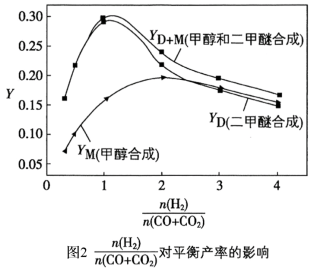
由图可知,随着合成气中H2所占比例的提高,合成甲醇的反应体系中,CO转化率的变化趋势是______ 。对于由合成气直接合成二甲醚的反应体系,为了提高原料转化率和产品产率,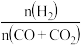 的值应控制在
的值应控制在_____ 附近。
②在压强为5.0MPa、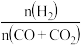 =2.0及
=2.0及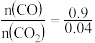 的条件下,反应温度对平衡转化率和产率的影响如图3和图4所示。
的条件下,反应温度对平衡转化率和产率的影响如图3和图4所示。
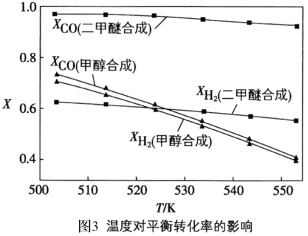
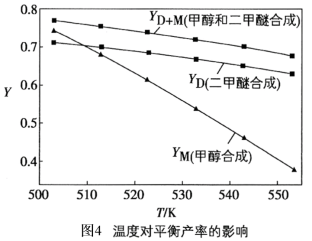
课题组认为图3所示的各反应物的转化率变化趋势符合反应特点,其理由是______ 。图中显示合成气直接合成二甲醚体系中,CO的转化率明显高于H2的转化率,原因是_______ 。图4显示随着温度增大,合成气单独合成甲醇时的产率,要比合成气直接合成二甲醚时的产率减小的快,原因是_______ 。
(i)CO(g)+2H2(g)
 CH3OH(g) △H1=-90.1 kJ/mol
CH3OH(g) △H1=-90.1 kJ/mol(ii)CO(g)+H2O(g)
 CO2(g)+H2(g) △H2=-41.1 kJ/mol
CO2(g)+H2(g) △H2=-41.1 kJ/mol (iii)2CH3OH(g)
 CH3OCH3(g)+H2O(g) △H3=-24.5 kJ/mol
CH3OCH3(g)+H2O(g) △H3=-24.5 kJ/mol(1)由H2和CO制备二甲醚(另一产物为CO2)的热化学方程式为
(2)合成气初始组成为n(H2):n(CO):n(CO2)=0.67:0.32:0.01的反应体系。在250℃和5.0 MPa条件下,在1 L密闭容器中经10 min达到化学平衡时,各组分的物质的量如下表:
| 成分 | H2 | CO | H2O | CH3OH | CH3OCH3 |
| 物质的量(mol) | 0.26 | 0.01 | 0.04 | 0.02 | 0.11 |
(3)课题组探究了外界条件,对合成气单独合成甲醇反应体系和直接合成二甲醚反应体系的影响。
①图1和图2显示了温度250 ℃和5.0 MPa条件下,合成气组成不同时,反应达到平衡时的情况。(图中M代表甲醇、D代表二甲醚、D+M代表甲醇和二甲醚。下同)


由图可知,随着合成气中H2所占比例的提高,合成甲醇的反应体系中,CO转化率的变化趋势是
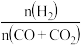 的值应控制在
的值应控制在②在压强为5.0MPa、
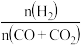 =2.0及
=2.0及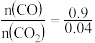 的条件下,反应温度对平衡转化率和产率的影响如图3和图4所示。
的条件下,反应温度对平衡转化率和产率的影响如图3和图4所示。

课题组认为图3所示的各反应物的转化率变化趋势符合反应特点,其理由是
您最近一年使用:0次
2020-06-11更新
|
103次组卷
|
2卷引用:新疆和田地区民丰县2022-2023学年高二上学期11月期中考试化学试题
5 . 合成气用途非常广泛,可以煤、天然气等为原料生产。回答下列问题:
(1)用H2O(g)和O2重整CH4制合成气的热化学方程式如下:
(水蒸气重整)CH4(g)+ H2O(g)=CO(g)+3H2(g) ∆H=+ 206 kJ·mol-1
(氧气重整)CH4(g)+0.5O2(g)=CO(g)+2H2(g) ∆H=-36 kJ·mol-1
①2H2(g)+O2(g)=2H2O(g)的∆H=_______ kJ·mol-1。
②为了保持热平衡,同时用两种方式重整,不考虑热量损失,理论上得到的合成气中n(CO): n(H2)=1 :____ (保留两位小数)。
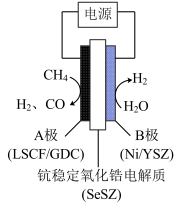
③用水蒸气电催化重整甲烷的装置如图。装置工作时,O2-向_____ (填“A”或“B’)极迁移;阳极发生的电极反应为___________ 。_____ (填“大于”“等于”或“小于”)0。
②气体的总压强:a点_____ (填“大于”“等于”或“小于”)b点,理由是_________ 。
③c点时,反应C(s) +CO2(g) 2CO(g)的Kp=
2CO(g)的Kp=_____ (填数值)。
④在恒容密闭容器中充入0. 5 mol CO、2 mol H2O(g)只发生反应(II),图中d点处达到平衡时,CO的转化率为_______ ;达到平衡时,向容器中再充入0.5 mol CO、2 mol H2O(g),重新达到平衡时,CO的平衡转化率_______ (填“增大”“减小”或“不变”)。
(1)用H2O(g)和O2重整CH4制合成气的热化学方程式如下:
(水蒸气重整)CH4(g)+ H2O(g)=CO(g)+3H2(g) ∆H=+ 206 kJ·mol-1
(氧气重整)CH4(g)+0.5O2(g)=CO(g)+2H2(g) ∆H=-36 kJ·mol-1
①2H2(g)+O2(g)=2H2O(g)的∆H=
②为了保持热平衡,同时用两种方式重整,不考虑热量损失,理论上得到的合成气中n(CO): n(H2)=1 :
③用水蒸气电催化重整甲烷的装置如图。装置工作时,O2-向

②气体的总压强:a点
③c点时,反应C(s) +CO2(g)
 2CO(g)的Kp=
2CO(g)的Kp=④在恒容密闭容器中充入0. 5 mol CO、2 mol H2O(g)只发生反应(II),图中d点处达到平衡时,CO的转化率为
您最近一年使用:0次
2020-03-27更新
|
100次组卷
|
2卷引用:新疆和田地区皮山县2022-2023学年高二上学期11月期中考试化学试题
解题方法
6 . 近年来由于温室效应和资源短缺等问题,关于CO2和碳酸盐应用的研究受到人们的重视。
(1)以CO2与NH3为原料可合成化肥尿素[CO(NH2)2]。已知:
①2NH3(g)+ CO2(g) = NH2CO2NH4(s) △H = -159.47 kJ·mol-1
②NH2CO2NH4(s) = CO(NH2)2(s)+ H2O(g) △H = +116.49 kJ·mol-1
③H2O(l) = H2O(g) △H = +88.0 kJ·mol-1
试写出NH3和CO2合成尿素和液态水的热化学方程式___________ 。
(2)已知:CO(g) + H2O(g) H2(g) + CO2(g) △H = -41.2kJ/mol,850℃时在一体积为10 L的恒容密闭容器中,通入一定量的CO和H2O,CO和H2O浓度变化如图所示:
H2(g) + CO2(g) △H = -41.2kJ/mol,850℃时在一体积为10 L的恒容密闭容器中,通入一定量的CO和H2O,CO和H2O浓度变化如图所示:
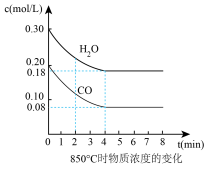
下列说法正确的是___________(填序号)
(3)850 ℃时,若在容积为2 L的密闭容器中同时充入1.0 mol CO,3.0 mol H2O,amol CO2和bmol H2.若达平衡时各组分体积分数都与(2)中平衡时相同,则a=___________ mol,b=___________ mol。
(4)华盛顿大学的研究人员研究出一种方法,可实现水泥生产时CO2零排放,其基本原理如图所示:
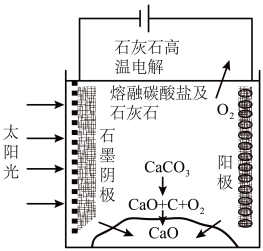
①上述生产过程的能量转化方式是___________ 。
②上述电解反应在温度小于900℃时进行碳酸钙先分解为CaO和CO2,电解质为熔融碳酸钠,阳极的电极反应式为2CO _4e-=2CO2↑+O2↑,则阴极的电极反应式为
_4e-=2CO2↑+O2↑,则阴极的电极反应式为___________ 。
(1)以CO2与NH3为原料可合成化肥尿素[CO(NH2)2]。已知:
①2NH3(g)+ CO2(g) = NH2CO2NH4(s) △H = -159.47 kJ·mol-1
②NH2CO2NH4(s) = CO(NH2)2(s)+ H2O(g) △H = +116.49 kJ·mol-1
③H2O(l) = H2O(g) △H = +88.0 kJ·mol-1
试写出NH3和CO2合成尿素和液态水的热化学方程式
(2)已知:CO(g) + H2O(g)
 H2(g) + CO2(g) △H = -41.2kJ/mol,850℃时在一体积为10 L的恒容密闭容器中,通入一定量的CO和H2O,CO和H2O浓度变化如图所示:
H2(g) + CO2(g) △H = -41.2kJ/mol,850℃时在一体积为10 L的恒容密闭容器中,通入一定量的CO和H2O,CO和H2O浓度变化如图所示:
下列说法正确的是___________(填序号)
| A.达到平衡时,氢气的物质的量是0.12mol |
| B.达到平衡时,反应体系最终会放出49.44kJ热量 |
| C.4min内CO2的反应速率为0.003 mol/(L·min) |
| D.第8min时,若充入氦气,不会导致v正(CO) < v逆(H2O) |
(4)华盛顿大学的研究人员研究出一种方法,可实现水泥生产时CO2零排放,其基本原理如图所示:

①上述生产过程的能量转化方式是
②上述电解反应在温度小于900℃时进行碳酸钙先分解为CaO和CO2,电解质为熔融碳酸钠,阳极的电极反应式为2CO
 _4e-=2CO2↑+O2↑,则阴极的电极反应式为
_4e-=2CO2↑+O2↑,则阴极的电极反应式为
您最近一年使用:0次
2017-08-31更新
|
94次组卷
|
2卷引用:新疆和田地区墨玉县2022-2023学年高二上学期11月期中化学试题
7 . 减少工业和生活废弃物的排放并合理开发利用,近年来受到了人们的普遍关注。
Ⅰ.利用工业废水中的CO2制取甲醇,反应为CO2+3H2 CH3OH+H2O。
CH3OH+H2O。
(1)已知下列反应的能量变化如图所示:
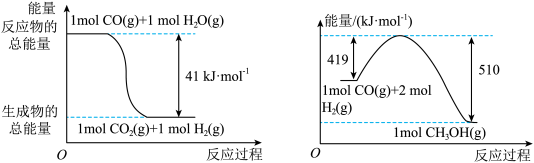
由二氧化碳和氢气制备甲醇的热化学方程式为____________________________ 。
Ⅱ.利用工业废气CO合成甲醇,反应为CO(g)+2H2(g) CH3OH(g)。
CH3OH(g)。
(2)一定条件下,在1 L密闭容器中充入0.6 mol CO和1.4 mol H2,8 min后达到平衡,CO的转化率为50%,则8 min内H2的平均反应速率为__________________ 。
(3)若反应原料是来自煤的气化,已知该反应的平衡常数表达式为K=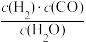 ,每生成1 mol H2需要吸收131.3 kJ的热量。写出该反应的热化学方程式
,每生成1 mol H2需要吸收131.3 kJ的热量。写出该反应的热化学方程式____________________________ 。
(4)T ℃时,能发生反应:2CH3OH(g) CH3OCH3(g)+H2O(g)。已知反应平衡常数为400,此温度下,在1 L密闭容器中加入一定量的甲醇,反应到某时刻测得各组分的物质的量浓度如表:
CH3OCH3(g)+H2O(g)。已知反应平衡常数为400,此温度下,在1 L密闭容器中加入一定量的甲醇,反应到某时刻测得各组分的物质的量浓度如表:
此刻正、逆反应速率的关系是v(正)_______ (填“>”、“<”或“=”)v(逆),平衡时c(CH3OCH3)是___________ 。
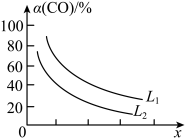
(5)已知反应3CO(g)+3H2(g) CH3OCH3(g)+CO2(g),CO的平衡转化率α(CO)与温度、压强的关系如图所示。图中X表示
CH3OCH3(g)+CO2(g),CO的平衡转化率α(CO)与温度、压强的关系如图所示。图中X表示_________ (填“温度”或“压强”),判断的理由是_______________________ 。
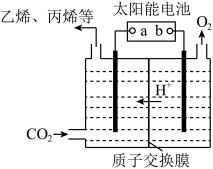
(6)强酸性电解质溶液中,用惰性电极电解CO2可转化为多种燃料,其原理如图所示。b为电源的_____ 极。电解时,生成乙烯的电极反应式为_________________________ 。
Ⅰ.利用工业废水中的CO2制取甲醇,反应为CO2+3H2
 CH3OH+H2O。
CH3OH+H2O。(1)已知下列反应的能量变化如图所示:

由二氧化碳和氢气制备甲醇的热化学方程式为
Ⅱ.利用工业废气CO合成甲醇,反应为CO(g)+2H2(g)
 CH3OH(g)。
CH3OH(g)。(2)一定条件下,在1 L密闭容器中充入0.6 mol CO和1.4 mol H2,8 min后达到平衡,CO的转化率为50%,则8 min内H2的平均反应速率为
(3)若反应原料是来自煤的气化,已知该反应的平衡常数表达式为K=
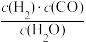 ,每生成1 mol H2需要吸收131.3 kJ的热量。写出该反应的热化学方程式
,每生成1 mol H2需要吸收131.3 kJ的热量。写出该反应的热化学方程式(4)T ℃时,能发生反应:2CH3OH(g)
 CH3OCH3(g)+H2O(g)。已知反应平衡常数为400,此温度下,在1 L密闭容器中加入一定量的甲醇,反应到某时刻测得各组分的物质的量浓度如表:
CH3OCH3(g)+H2O(g)。已知反应平衡常数为400,此温度下,在1 L密闭容器中加入一定量的甲醇,反应到某时刻测得各组分的物质的量浓度如表:| 物质 | CH3OH | CH3OCH3 | H2O |
| c/(mol·L-1) | 0.46 | 1.0 | 1.0 |
此刻正、逆反应速率的关系是v(正)

(5)已知反应3CO(g)+3H2(g)
 CH3OCH3(g)+CO2(g),CO的平衡转化率α(CO)与温度、压强的关系如图所示。图中X表示
CH3OCH3(g)+CO2(g),CO的平衡转化率α(CO)与温度、压强的关系如图所示。图中X表示
(6)强酸性电解质溶液中,用惰性电极电解CO2可转化为多种燃料,其原理如图所示。b为电源的
您最近一年使用:0次
2017-04-12更新
|
350次组卷
|
4卷引用:新疆维吾尔自治区和田地区洛浦县2022-2023学年高二上学期11月期中考试化学试题
新疆维吾尔自治区和田地区洛浦县2022-2023学年高二上学期11月期中考试化学试题青海省西宁市2017届高三下学期复习检测一(一模)理综-化学试题(已下线)2019年5月1日 《每日一题》三轮复习-化学反应原理综合题(已下线)2019年5月16日 《每日一题》四轮复习——押高考化学第28题(1)
名校
解题方法
8 . (一)莽草酸是合成治疗禽流感的药物——达菲的原料之一。莽草酸是A的一种同分异构体,A的结构简式为
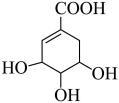
回答下列问题:
(1)A的分子式为_______________________________ 。
(2)A可能发生的化学反应有_____________________ 。(填编号)
①能使溴的四氯化碳溶液和酸性高锰酸钾溶液褪色
②可发生酯化反应
③可与氢氧化钠溶液发生中和反应
④可与金属钠发生置换反应
⑤在铜或银的催化作用下,可被空气中的氧气氧化
(二)乙醇在能源、生产及日常生活等许多方面都有十分广泛的应用。请计算:
(3)将足量乙醇与9.2g金属钠充分反应,则标准状况下生成气体的体积是_____________________ L。
(4)若一定量的乙醇和O2在密闭容器中燃烧后的产物为CO2、CO和H2O(g)。产物依次经过浓硫酸和碱石灰使其被充分吸收,浓硫酸增重10.8g,碱石灰重13.2g。求氧气的的物质的量是____________ mol,燃烧产物的平均摩尔质量是____________ 。

回答下列问题:
(1)A的分子式为
(2)A可能发生的化学反应有
①能使溴的四氯化碳溶液和酸性高锰酸钾溶液褪色
②可发生酯化反应
③可与氢氧化钠溶液发生中和反应
④可与金属钠发生置换反应
⑤在铜或银的催化作用下,可被空气中的氧气氧化
(二)乙醇在能源、生产及日常生活等许多方面都有十分广泛的应用。请计算:
(3)将足量乙醇与9.2g金属钠充分反应,则标准状况下生成气体的体积是
(4)若一定量的乙醇和O2在密闭容器中燃烧后的产物为CO2、CO和H2O(g)。产物依次经过浓硫酸和碱石灰使其被充分吸收,浓硫酸增重10.8g,碱石灰重13.2g。求氧气的的物质的量是
您最近一年使用:0次
2016-12-09更新
|
344次组卷
|
2卷引用:新疆和田地区第二中学2022-2023学年高三上学期11月期中考试化学试题



