名校
解题方法
1 . 一定条件下的密闭容器中,发生可逆反应 ,下列情况不能说明该反应达到化学平衡的是
,下列情况不能说明该反应达到化学平衡的是
 ,下列情况不能说明该反应达到化学平衡的是
,下列情况不能说明该反应达到化学平衡的是A. 的质量恒定 的质量恒定 | B. 的质量分数保持不变 的质量分数保持不变 |
| C.正反应和逆反应的速率相等 | D. 、 、 、 、 的物质的量之比为 的物质的量之比为 |
您最近一年使用:0次
2023-04-28更新
|
934次组卷
|
20卷引用:新疆额敏县第二中学2021-2022学年高一下学期期中考试化学试题
新疆额敏县第二中学2021-2022学年高一下学期期中考试化学试题辽宁省阜新市第二高级中学2019-2020学年高一下学期线上考试化学试题山东省2020年夏季普通高中学业水平合格考试模拟(一)化学试题辽宁省大连市第一中学2020-2021学年高一下学期期中(合格性)考试化学试题人教2019版必修第二册第六章第二节 化学反应的速率与限度课后习题云南省2021年高二上学期期末普通高中学业水平考试化学(新教材)试题广东省佛山市第四中学2021-2022学年高一下学期3月段考化学试题吉林省吉化第一高级中学校2021-2022学年高一下学期4月期中考试化学试题北京市北京师范大学附属实验中学2021-2022学年高一下学期期中考试化学试题北京师范大学附属实验中学2021-2022学年高一下学期期中考试化学试题云南省富源一中2021-2022学年高一下学期期末考试化学(文科)试题黑龙江省饶河县高级中学2021-2022学年高一下学期学业水平(合格考)化学试题云南省2022年1月普通高中学业水平考试化学试题广东省茂名市电白区2021-2022学年高一下学期期中(选择性)考试化学试题浙江省宁波市姜山中学2022-2023学年高一下学期3月月考化学试题天津市天津市河西区2022-2023学年高一下学期4月期中考试化学试题广西钦州市浦北县2022-2023学年高一下学期4月期中考试化学试题云南省昆明市第一中学2022-2023学年高一下学期期中考试化学试题四川省甘孜藏族自治州某重点中学2023-2024学年高一下学期4月期中考试化学试题新疆维霍尔果斯市苏港中学2023-2024学年高一下学期4月月考化学试题
名校
解题方法
2 . 计算(要有计算过程)
(1)常温常压下,用等质量的 、
、 、
、 三种气体分别吹出三个气球,求三个气球的体积之比为
三种气体分别吹出三个气球,求三个气球的体积之比为______ 。
(2)把 溶液和
溶液和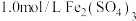 溶液各0.5L混合(假设混合溶液的体积等于混合前两种溶液的体积之和),再向其中加入足量的铁粉,经过足够长的时间后,铁粉有剩余。求此时溶液中
溶液各0.5L混合(假设混合溶液的体积等于混合前两种溶液的体积之和),再向其中加入足量的铁粉,经过足够长的时间后,铁粉有剩余。求此时溶液中 的物质的量浓度
的物质的量浓度___________ 。
(3)某种胃药的有效成分为碳酸钠,测定其中碳酸钙含量的操作如下(设该药片中的其他成分不与盐酸或氢氧化钠反应):
①向一粒研碎后的药片(0.10g)中加入20.00ml蒸馏水;
②配置 稀盐酸和
稀盐酸和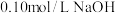 溶液;
溶液;
③加入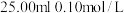 稀盐酸;
稀盐酸;
④用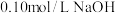 溶液中和过量的稀盐酸,记录所消耗NaOH溶液的体积;
溶液中和过量的稀盐酸,记录所消耗NaOH溶液的体积;
某同学4次测定所消耗的NaOH溶液的体积如下:
根据这个同学的实验数据,计算这种药片中碳酸钙的质量分数_________ 。
(1)常温常压下,用等质量的
 、
、 、
、 三种气体分别吹出三个气球,求三个气球的体积之比为
三种气体分别吹出三个气球,求三个气球的体积之比为(2)把
 溶液和
溶液和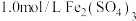 溶液各0.5L混合(假设混合溶液的体积等于混合前两种溶液的体积之和),再向其中加入足量的铁粉,经过足够长的时间后,铁粉有剩余。求此时溶液中
溶液各0.5L混合(假设混合溶液的体积等于混合前两种溶液的体积之和),再向其中加入足量的铁粉,经过足够长的时间后,铁粉有剩余。求此时溶液中 的物质的量浓度
的物质的量浓度(3)某种胃药的有效成分为碳酸钠,测定其中碳酸钙含量的操作如下(设该药片中的其他成分不与盐酸或氢氧化钠反应):
①向一粒研碎后的药片(0.10g)中加入20.00ml蒸馏水;
②配置
 稀盐酸和
稀盐酸和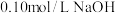 溶液;
溶液;③加入
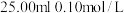 稀盐酸;
稀盐酸;④用
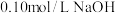 溶液中和过量的稀盐酸,记录所消耗NaOH溶液的体积;
溶液中和过量的稀盐酸,记录所消耗NaOH溶液的体积;某同学4次测定所消耗的NaOH溶液的体积如下:
| 测定次数 | 第一次 | 第二次 | 第三次 | 第四次 |
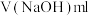 | 13.00 | 12.90 | 13.10 | 13.50 |
您最近一年使用:0次
名校
解题方法
3 . 以下四个实验中,实验装置符合规范且能达到实验目的有
| 装置 | 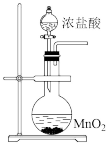 |  |
| 目的 | 制取氯气的发生装置 | 鉴别等物质的量浓度的NaHCO3和Na2CO3溶液 |
| 装置 | 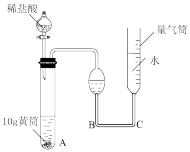 | 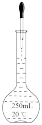 |
| 目的 | 测定黄铜(铜锌合金)中铜的质量分数 | 定容 |
| A.1项 | B.2项 | C.3项 | D.4项 |
您最近一年使用:0次
名校
4 . I.实验室需要480 mL0.2mol•L-1Na2CO3溶液。
(1)除烧杯和玻璃棒、胶头滴管外,还需要的玻璃仪器有______ 。
(2)用Na2CO3•10H2O固体配置,所需固体的质量______ 。
(3)下列错误操作可使所配制碳酸钠溶液浓度偏低的是______。
II.我国化工专家侯德榜对索尔维制碱法进行了改进,将合成氨工业与纯碱工业联合,发明了联合制碱法,实验室模拟工业上联合制碱法原理制备纯碱
(4)如图1操作未涉及的是______。
生产流程可简要表示如图2:
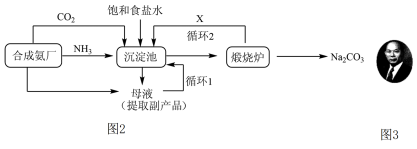
(5)沉淀池中总反应的化学方程式为______ 。
(6)ag含碳酸氢钠杂质的碳酸钠,充分加热至固体质量保持不变,所得固体的质量为bg,用字母表示碳酸氢钠的质量分数______ 。
(1)除烧杯和玻璃棒、胶头滴管外,还需要的玻璃仪器有
(2)用Na2CO3•10H2O固体配置,所需固体的质量
(3)下列错误操作可使所配制碳酸钠溶液浓度偏低的是______。
| A.容量瓶洗净后残留了部分的水 |
| B.转移时溶液溅到容量瓶外面 |
| C.定容时俯视容量瓶的刻度线 |
| D.摇匀后见液面下降,再加水至刻度线 |
II.我国化工专家侯德榜对索尔维制碱法进行了改进,将合成氨工业与纯碱工业联合,发明了联合制碱法,实验室模拟工业上联合制碱法原理制备纯碱
(4)如图1操作未涉及的是______。
A.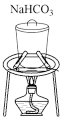 | B.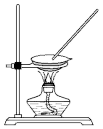 | C. | D. |
生产流程可简要表示如图2:

(5)沉淀池中总反应的化学方程式为
(6)ag含碳酸氢钠杂质的碳酸钠,充分加热至固体质量保持不变,所得固体的质量为bg,用字母表示碳酸氢钠的质量分数
您最近一年使用:0次
名校
解题方法
5 . 在科学实验和工农业生产中都要使用到一定物质的量浓度的溶液,因此溶液的配制尤为重要。
I.
(1)实验室欲用NaOH固体配制 的NaOH溶液480mL,某同学欲称量NaOH的质量,他先用托盘天平称量烧杯的质量,天平平衡后的状态如图,烧杯的实际质量为
的NaOH溶液480mL,某同学欲称量NaOH的质量,他先用托盘天平称量烧杯的质量,天平平衡后的状态如图,烧杯的实际质量为_______ g。

(2)若配制 的硫酸溶液450mL,需用量筒量取质量分数为98%、密度为
的硫酸溶液450mL,需用量筒量取质量分数为98%、密度为 的浓硫酸的体积为
的浓硫酸的体积为_____ mL,如果实验室有10mL、15mL、20mL量筒,应最好选用______ mL量筒。
(3)以上两种溶液配制时,所需仪器除了托盘天平、药匙、量筒、玻璃棒、烧杯、还缺少玻璃仪器____ 。
II.
(4)下列对容量瓶及其使用方法的描述中正确的是_______。
(5)下列操作会使所配溶液物质的量浓度偏高的是_______ (填序号)。
A.转移前,容量瓶中含有少量蒸馏水
B.向容量瓶转移溶液时,有少量液体溅出
C.烧杯内溶解溶质后未等冷却就立即转移到容量瓶中并定容
D.定容时俯视刻度线
E.移液时未洗涤烧杯和玻璃棒
F.倒转容量瓶摇匀后,液面降至刻度线下,再加水至刻度
I.
(1)实验室欲用NaOH固体配制
 的NaOH溶液480mL,某同学欲称量NaOH的质量,他先用托盘天平称量烧杯的质量,天平平衡后的状态如图,烧杯的实际质量为
的NaOH溶液480mL,某同学欲称量NaOH的质量,他先用托盘天平称量烧杯的质量,天平平衡后的状态如图,烧杯的实际质量为
(2)若配制
 的硫酸溶液450mL,需用量筒量取质量分数为98%、密度为
的硫酸溶液450mL,需用量筒量取质量分数为98%、密度为 的浓硫酸的体积为
的浓硫酸的体积为(3)以上两种溶液配制时,所需仪器除了托盘天平、药匙、量筒、玻璃棒、烧杯、还缺少玻璃仪器
II.
(4)下列对容量瓶及其使用方法的描述中正确的是_______。
| A.容量瓶上标有容积、温度和浓度 |
| B.容量瓶用蒸馏水洗净后,必须烘干 |
| C.配制溶液时,把冷却至室温的溶液直接倒入容量瓶中,加入蒸馏水到接近刻度线1~2cm处,改用胶头滴管加蒸馏水至刻度线 |
| D.使用前应检查容量瓶是否漏水 |
A.转移前,容量瓶中含有少量蒸馏水
B.向容量瓶转移溶液时,有少量液体溅出
C.烧杯内溶解溶质后未等冷却就立即转移到容量瓶中并定容
D.定容时俯视刻度线
E.移液时未洗涤烧杯和玻璃棒
F.倒转容量瓶摇匀后,液面降至刻度线下,再加水至刻度
您最近一年使用:0次
名校
6 . 某碳酸钾和碳酸氢钾组成的混合物样品61.4 g,加水溶解后,取所得溶液的十分之一,向其中缓缓加入一定浓度的稀盐酸,并同时记录放出CO2的质量和消耗稀盐酸的体积,得到如图所示的曲线。下列说法不正确的是


| A.该过程所发生反应的化学方程式:K2CO3+HCl =KCl+KHCO3;KHCO3+HCl=KCl+H2O+CO2↑ |
| B.混合物样品中含碳酸钾20.0g |
| C.混合物中碳元素的质量分数为9. 77% |
| D.若将61.4 g原混合物样品充分加热,放出CO2的质量为4.40g |
您最近一年使用:0次
2022-06-15更新
|
1267次组卷
|
4卷引用:新疆维吾尔自治区塔城市第三中学2022-2023学年高一上学期11月期中化学试题
新疆维吾尔自治区塔城市第三中学2022-2023学年高一上学期11月期中化学试题新疆维吾尔自治区2022届高三第二次适应性检测理科综合化学试题(已下线)第三章 金属及其化合物(测)-2023年高考化学一轮复习讲练测(全国通用)辽宁省沈阳市东北育才学校高三上学期10月第一次模拟考试化学试题
名校
7 . 降低大气中CO2的含量及有效地开发利用CO2引起了全世界的普遍重视。
(1)如下图所示。已知:CO(g)+H2O(g) CO2(g)+H2(g) ΔH1= -41 kJ·mol−1
CO2(g)+H2(g) ΔH1= -41 kJ·mol−1
CH3CH2OH(g)+3H2O(g) 2CO2(g)+6H2(g) ΔH2= +174.1 kJ·mol−1
2CO2(g)+6H2(g) ΔH2= +174.1 kJ·mol−1
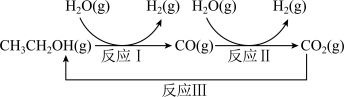
反应 Ⅰ 的热化学方程式为_________ 。
(2)目前工业上有一种方法是用CO2来生产燃料甲醇。为探究该反应原理,进行如下实验:在容积为1L的密闭容器中,充入1 mol CO2和3mol H2,在500℃下发生发应,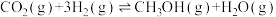 实验测得CO2和
实验测得CO2和 的物质的量(n)随时间变化如图1所示:
的物质的量(n)随时间变化如图1所示:
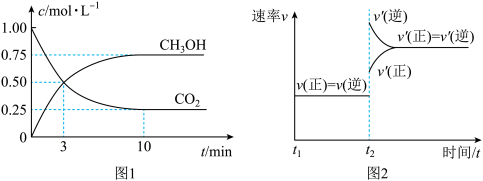
①500℃达平衡时, 物质的量分数为
物质的量分数为____________ 。图2是改变温度时速率随时间变化的示意图,则该反应的正反应为____________ 反应(填“放热”或“吸热”)。
②500℃该反应的平衡常数为____________ ,若提高温度800℃进行,达平衡时,K值____________ (填“增大”“减小”或“不变”)。
③500℃条件下,测得某时刻,CO2(g)、H2(g)、CH3OH(g) 和H2O(g) 的浓度均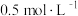 此时v(正)
此时v(正)_____________ v(逆)(填“>”“<”或“=”)
④下列措施能使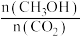 增大的是
增大的是____________ 。
A.升高温度 B.在原容器中充入
C.原容器中充入1 mol CO2和3 mol H2 D.缩小容器容积,增大压强
(1)如下图所示。已知:CO(g)+H2O(g)
 CO2(g)+H2(g) ΔH1= -41 kJ·mol−1
CO2(g)+H2(g) ΔH1= -41 kJ·mol−1CH3CH2OH(g)+3H2O(g)
 2CO2(g)+6H2(g) ΔH2= +174.1 kJ·mol−1
2CO2(g)+6H2(g) ΔH2= +174.1 kJ·mol−1
反应 Ⅰ 的热化学方程式为
(2)目前工业上有一种方法是用CO2来生产燃料甲醇。为探究该反应原理,进行如下实验:在容积为1L的密闭容器中,充入1 mol CO2和3mol H2,在500℃下发生发应,
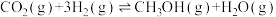 实验测得CO2和
实验测得CO2和 的物质的量(n)随时间变化如图1所示:
的物质的量(n)随时间变化如图1所示:
①500℃达平衡时,
 物质的量分数为
物质的量分数为②500℃该反应的平衡常数为
③500℃条件下,测得某时刻,CO2(g)、H2(g)、CH3OH(g) 和H2O(g) 的浓度均
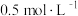 此时v(正)
此时v(正)④下列措施能使
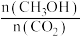 增大的是
增大的是A.升高温度 B.在原容器中充入

C.原容器中充入1 mol CO2和3 mol H2 D.缩小容器容积,增大压强
您最近一年使用:0次
2023-08-08更新
|
107次组卷
|
2卷引用:新疆塔城地区第一高级中学2023-2024学年高二上学期9月月考化学试题
名校
解题方法
8 . 高锰酸钾溶液常用于物质的定性检验与定量分析。
(1)实验室里欲用KMnO4固体来配制250.00 mL 0.1000 mol•L-1的KMnO4酸性溶液。
①需用的仪器有天平、药匙、烧杯、玻璃棒、量筒、_________ 、_________ 。
②下列关于“容量瓶及其使用”的叙述中正确的是_________ (填序号)。
A.使用前必须检查是否漏水 B.能配制一定体积准确浓度的标准溶液
C.可用来长期贮存溶液 D.能用作溶解固体、稀释浓溶液的容器
③下列操作对实验结果的影响偏高的是_________ (填序号)。
A.加水定容时俯视刻度线
B.未洗涤溶解后的烧杯和玻璃棒
C.颠倒摇匀后发现凹液面低于刻度线,没有加水补到刻度线
D.未经冷却趁热将溶液注入容量瓶中并进行定容
(2)用上述酸性KMnO4溶液来测定FeSO4溶液中Fe2+的物质的量浓度。原理如下:FeSO4 + KMnO4 + H2SO4 — K2SO4 + MnSO4 + Fe2(SO4)3 + H2O (未配平),实验时应测定的数据有:量取FeSO4溶液的体积和__________________ 。该反应中还原剂与氧化剂的物质的量之比为_________ 。
(3)维生素C的水溶液能使高锰酸钾溶液褪色,根据这一原理,常用高锰酸钾测定蔬菜或水果中的维生素C的含量。上述实验原理体现了维生素C具有_____ (填氧化性、还原性)。
(1)实验室里欲用KMnO4固体来配制250.00 mL 0.1000 mol•L-1的KMnO4酸性溶液。
①需用的仪器有天平、药匙、烧杯、玻璃棒、量筒、
②下列关于“容量瓶及其使用”的叙述中正确的是
A.使用前必须检查是否漏水 B.能配制一定体积准确浓度的标准溶液
C.可用来长期贮存溶液 D.能用作溶解固体、稀释浓溶液的容器
③下列操作对实验结果的影响偏高的是
A.加水定容时俯视刻度线
B.未洗涤溶解后的烧杯和玻璃棒
C.颠倒摇匀后发现凹液面低于刻度线,没有加水补到刻度线
D.未经冷却趁热将溶液注入容量瓶中并进行定容
(2)用上述酸性KMnO4溶液来测定FeSO4溶液中Fe2+的物质的量浓度。原理如下:FeSO4 + KMnO4 + H2SO4 — K2SO4 + MnSO4 + Fe2(SO4)3 + H2O (未配平),实验时应测定的数据有:量取FeSO4溶液的体积和
(3)维生素C的水溶液能使高锰酸钾溶液褪色,根据这一原理,常用高锰酸钾测定蔬菜或水果中的维生素C的含量。上述实验原理体现了维生素C具有
您最近一年使用:0次
2023-01-06更新
|
208次组卷
|
2卷引用:新疆塔城地区第一高级中学2022-2023学年高一下学期开学考试化学试题
名校
解题方法
9 . 某温度下,2L容积不变的密闭容器中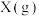 与
与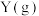 反应生成
反应生成 ,反应过程中X、Y、Z的物质的量变化如图1所示。保持其他条件不变,温度分别为
,反应过程中X、Y、Z的物质的量变化如图1所示。保持其他条件不变,温度分别为 和
和 时,Z的体积百分含量与时间的关系如图2所示。下列结论错误的是
时,Z的体积百分含量与时间的关系如图2所示。下列结论错误的是
 与
与 反应生成
反应生成 ,反应过程中X、Y、Z的物质的量变化如图1所示。保持其他条件不变,温度分别为
,反应过程中X、Y、Z的物质的量变化如图1所示。保持其他条件不变,温度分别为 和
和 时,Z的体积百分含量与时间的关系如图2所示。下列结论错误的是
时,Z的体积百分含量与时间的关系如图2所示。下列结论错误的是
A.反应的前3min内,用X表示的反应速率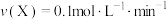 |
B.容器中发生的反应可表示为: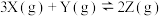 |
| C.保持其他条件不变,升高温度,化学平衡向正反应方向移动 |
| D.若改变反应条件,反应进程如图3所示,则改变的条件是使用催化剂 |
您最近一年使用:0次
2023-08-08更新
|
291次组卷
|
5卷引用:新疆塔城地区第一高级中学2023-2024学年高二上学期9月月考化学试题
新疆塔城地区第一高级中学2023-2024学年高二上学期9月月考化学试题安徽省滁州市实验中学等2校2022-2023学年高二上学期1月期末考试化学试题河南省郑州市中牟县2023-2024学年高二上学期期中考试化学试题(已下线)专题04 化学平衡-【好题汇编】备战2023-2024学年高二化学上学期期末真题分类汇编(人教版2019)江西省部分学校2023-2024学年高二下学期开学考试化学试题
名校
解题方法
10 . 甲醇又称“木醇”或“木精”,具有毒性。工业酒精中大约含有4%的甲醇,若被不法分子当作食用酒精制作假酒,饮用后,会产生甲醇中毒。甲醇的致命剂量大约是70 ,但甲醇也是一种新型可再生能源,具有开发和应用的广阔前景,工业通常由一氧化碳与氢气反应制得,原理如下:
,但甲醇也是一种新型可再生能源,具有开发和应用的广阔前景,工业通常由一氧化碳与氢气反应制得,原理如下: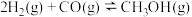
(1)下表所列数据是在不同温度下,工业合成甲醇反应的化学平衡常数(K)
则该反应的平衡常数表达式
_______ ,
_______ 0(填“>”、“<”或“=”)
(2)某温度下,将2
 和4
和4
 充入2L密闭容器中充分反应后,达到平衡,测得
充入2L密闭容器中充分反应后,达到平衡,测得 的物质的量浓度为0.5
的物质的量浓度为0.5 ,则此时氢气的转化率为
,则此时氢气的转化率为_________ ,反应进行的温度为_________ 。
(3)将一定量的氢气与一氧化碳通入一个密闭容器中,模拟工业制取甲醇的过程,当压强一定的体系时,测得平衡体系中甲醇的质量分数 随温度变化情况如下图所示,回答下列问题:
随温度变化情况如下图所示,回答下列问题:
①A B C D E各状态中, (正)>
(正)> (逆)的是
(逆)的是_________ (填字母)
②若维持 不变,从E点→A点所需时间
不变,从E点→A点所需时间 ,维持
,维持 不变,从D点→C点所需时间为
不变,从D点→C点所需时间为 ,则
,则
________  (填“>”“=”或“<”)
(填“>”“=”或“<”)
③欲要求E状态从水平方向到C状态后,再沿平衡曲线到达A状态,从理论上讲,可选用的条件是________ (填字母)
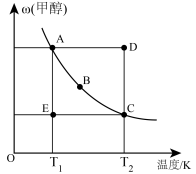
A.从T1无限缓慢升温至T2,再由T2无限缓慢降温至T1
B.从T1迅速升温至T2,再由T2无限缓慢降温至T1
C.从T1迅速升温至T2,再由T2迅速降温至T1
 ,但甲醇也是一种新型可再生能源,具有开发和应用的广阔前景,工业通常由一氧化碳与氢气反应制得,原理如下:
,但甲醇也是一种新型可再生能源,具有开发和应用的广阔前景,工业通常由一氧化碳与氢气反应制得,原理如下: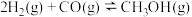
(1)下表所列数据是在不同温度下,工业合成甲醇反应的化学平衡常数(K)
| 温度/℃ | 250 | 300 | 350 |
| K | 2.0 | 1.0 | 0.01 |
则该反应的平衡常数表达式


(2)某温度下,将2

 和4
和4
 充入2L密闭容器中充分反应后,达到平衡,测得
充入2L密闭容器中充分反应后,达到平衡,测得 的物质的量浓度为0.5
的物质的量浓度为0.5 ,则此时氢气的转化率为
,则此时氢气的转化率为(3)将一定量的氢气与一氧化碳通入一个密闭容器中,模拟工业制取甲醇的过程,当压强一定的体系时,测得平衡体系中甲醇的质量分数
 随温度变化情况如下图所示,回答下列问题:
随温度变化情况如下图所示,回答下列问题:①A B C D E各状态中,
 (正)>
(正)> (逆)的是
(逆)的是②若维持
 不变,从E点→A点所需时间
不变,从E点→A点所需时间 ,维持
,维持 不变,从D点→C点所需时间为
不变,从D点→C点所需时间为 ,则
,则
 (填“>”“=”或“<”)
(填“>”“=”或“<”)③欲要求E状态从水平方向到C状态后,再沿平衡曲线到达A状态,从理论上讲,可选用的条件是

A.从T1无限缓慢升温至T2,再由T2无限缓慢降温至T1
B.从T1迅速升温至T2,再由T2无限缓慢降温至T1
C.从T1迅速升温至T2,再由T2迅速降温至T1
您最近一年使用:0次



