1 .  是最常见的硫的氧化物,某小组利用如图所示的装置制备并检验其性质。下列说法正确的是
是最常见的硫的氧化物,某小组利用如图所示的装置制备并检验其性质。下列说法正确的是
 是最常见的硫的氧化物,某小组利用如图所示的装置制备并检验其性质。下列说法正确的是
是最常见的硫的氧化物,某小组利用如图所示的装置制备并检验其性质。下列说法正确的是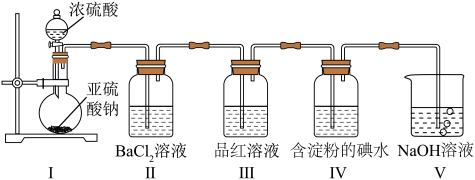
| A.装置Ⅰ中浓硫酸体现强氧化性 |
| B.装置Ⅱ无明显变化,实验结束后向其中通入空气,也无明显变化 |
C.装置Ⅲ中现象证明 具有漂白性,装置Ⅳ中现象证明 具有漂白性,装置Ⅳ中现象证明 具有氧化性 具有氧化性 |
| D.装置V中使用酸性高锰酸钾溶液也可达到实验目的 |
您最近一年使用:0次
2 . 下列装置(部分夹持装置略去)中仪器使用规范且能达到实验目的的是
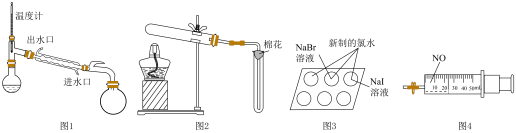
| A.图1:采用蒸馏法分离正己烷(沸点69℃)和正庚烷(沸点98℃) |
B.图2:用 和 和 制备并收集 制备并收集 |
| C.图3:通过观察实验现象,验证氯、溴和碘元素性质的递变规律 |
D.图4:利用该装置实现NO、 和 和 充分反应转化为 充分反应转化为 |
您最近一年使用:0次
2024-05-14更新
|
92次组卷
|
2卷引用:2024届河南省平许济洛四市高三下学期第四次质量检测理科综合试题-高中化学
2023·全国·模拟预测
解题方法
3 . 为完成各组实验,下列所选试剂、实验操作方法和实验现象的描述均正确的是
| 选项 | 实验目的 | 试剂 | 操作方法 | 实验现象 |
| A | 制备 并检验其性质 并检验其性质 | 浓氨水、蒸馏水、pH试纸 | 加热浓氨水,用湿润的pH试纸检验逸出的气体 | 浓氮水冒气泡,pH试纸变蓝 |
| B | 检验溴乙烷中含溴元素 | 溴乙烷、KOH溶液、 溶液 溶液 | 加热溴乙烷与KOH的混合液,然后滴加 溶液 溶液 | 有淡黄色沉淀生成 |
| C | 钠盐的焰色试验 |  溶液、稀硫酸 溶液、稀硫酸 | 用铂丝蘸取稀硫酸,并在酒精灯火焰上灼烧,然后再蘸取 溶液灼烧 溶液灼烧 | 焰色为黄色 |
| D | 探究金属腐蚀类型 | NaCl溶液、铁钉 | 将铁钉用NaCl溶液浸泡,然后放入气密性良好的下列装置中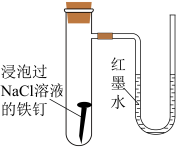 | U形管中红墨水右端高、左端低 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
4 .  具有氧化性、还原性和漂白性,某同学在实验室利用
具有氧化性、还原性和漂白性,某同学在实验室利用 做相关验证和探究实验。回答下列问题:
做相关验证和探究实验。回答下列问题:
(1)用如图1装置(夹持仪器已省略)验证 具有氧化性。
具有氧化性。 的名称为
的名称为___________ 。
②装置甲试管中反应的离子方程式为___________ 。
③说明 具有氧化性的现象为
具有氧化性的现象为___________ 。
(2)该同学设计如图2所示装置(夹持仪器已省略)制备 (难溶解于水中)。
(难溶解于水中)。 的作用是
的作用是___________ 。
②三颈烧瓶中反应的化学方程式为___________ 。
(3)该实验体现了 的性质是
的性质是___________ 。
(4)实验表明,将纯净的 缓缓地通入到
缓缓地通入到 溶液中,得到
溶液中,得到 沉淀。为了探究该反应中的氧化剂,该同学提出以下假设:
沉淀。为了探究该反应中的氧化剂,该同学提出以下假设:
假设Ⅰ:溶液中的 ;
;
假设Ⅱ:溶解在水中的氧气。
①验证假设Ⅰ(配制溶液前已将蒸馏水煮沸并密封冷却)。
实验i现象为___________ ,实验ii的现象为___________ 。
②验证假设Ⅱ。请完成下列表格:
实验iv的步骤为___________ ,实验目的是___________ 。
 具有氧化性、还原性和漂白性,某同学在实验室利用
具有氧化性、还原性和漂白性,某同学在实验室利用 做相关验证和探究实验。回答下列问题:
做相关验证和探究实验。回答下列问题:(1)用如图1装置(夹持仪器已省略)验证
 具有氧化性。
具有氧化性。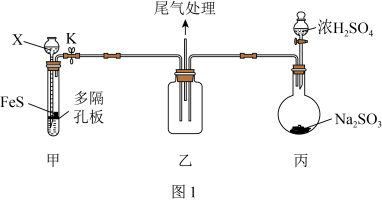
 的名称为
的名称为②装置甲试管中反应的离子方程式为
③说明
 具有氧化性的现象为
具有氧化性的现象为(2)该同学设计如图2所示装置(夹持仪器已省略)制备
 (难溶解于水中)。
(难溶解于水中)。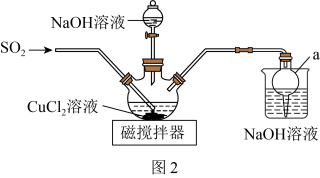
 的作用是
的作用是②三颈烧瓶中反应的化学方程式为
(3)该实验体现了
 的性质是
的性质是(4)实验表明,将纯净的
 缓缓地通入到
缓缓地通入到 溶液中,得到
溶液中,得到 沉淀。为了探究该反应中的氧化剂,该同学提出以下假设:
沉淀。为了探究该反应中的氧化剂,该同学提出以下假设:假设Ⅰ:溶液中的
 ;
;假设Ⅱ:溶解在水中的氧气。
①验证假设Ⅰ(配制溶液前已将蒸馏水煮沸并密封冷却)。
| 实验步骤 | 实验操作 | 实验现象 | 结论 |
实验 | 向 溶液中缓慢通入纯净的 溶液中缓慢通入纯净的 气体 气体 | 假设I成立 | |
实验 | 向 溶液的烧杯中缓慢通入纯净的 溶液的烧杯中缓慢通入纯净的 气体 气体 |
②验证假设Ⅱ。请完成下列表格:
| 实验步骤 | 实验现象 | 实验目的 | |
| 实验iii | 同实验 步骤 步骤 | 同实验 的相关现象 的相关现象 | 作对照实验 |
| 实验iv | 产生白色沉淀 | ||
您最近一年使用:0次
2024-02-23更新
|
670次组卷
|
8卷引用:2024届内蒙古自治区乌海市第六中学高三下学期第三次模拟考试理综试题-高中化学
2024届内蒙古自治区乌海市第六中学高三下学期第三次模拟考试理综试题-高中化学江西省部分学校2023-2024学年高三上学期2月月考化学试题(已下线)专题03 常见气体的实验室制取(考题猜想)(6大题型)-2023-2024学年高一化学下学期期中考点大串讲(人教版2019必修第二册)四川省绵阳中学2023-2024学年高三下学期2月开学考理科综合-高中化学(已下线)大题02 化学实验综合题(分类过关)-【大题精做】冲刺2024年高考化学大题突破+限时集训(新高考专用)河南省郑州市第五高级中学2023-2024学年高三2月开学考理综试题-高中化学四川省广元市川师大万达中学2023-2024学年高一下学期3月月考化学试题黑龙江省牡丹江市第一高级中学2023-2024学年高一下学期5月期中考试化学试题
解题方法
5 . 氧化亚铜和溴化亚铜均是常见的一价铜化合物,氧化亚铜在强酸性溶液中易发生歧化反应,溴化亚铜常用作有机合成原料和反应催化剂。
(1)可利用葡萄糖还原CuSO4溶液制备氧化亚铜。
①配制490mL0.1mol·L-1CuSO4溶液,需要称取胆矾晶体的质量为_______ 。
②某同学为检验CuO样品中是否含有Cu2O,可向样品中加入足量稀硫酸,若观察到_______ ,则说明样品中含有Cu2O杂质。
(2)向CuSO4和NaBr的混合溶液中通入足量的二氧化硫可得到溴化亚铜沉淀。完成该反应的离子方程式:□Cu2++□Br-+□SO2+□H2O=□CuBr↓+□ +□_____。
+□_____。_______ ,该反应完毕的现象标志是_______ ,洗涤CuBr沉淀时采用二氧化硫的水溶液而不采用蒸馏水的目的是_______ 。
(3)某小组同学取含有少量CuO杂质的Cu2O样品进行如下实验,以测定氧化亚铜的纯度。
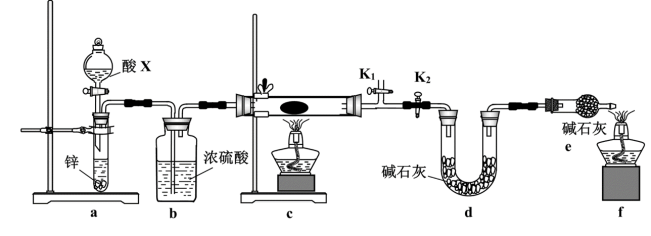
①装置a中所加的酸X是_______ (填化学式)。
②通过测定下列物理量,能达到实验目的的是_______ (填字母)。
A.反应前后装置a的质量 B.充分反应后装置c所得固体的质量
C.反应前后装置d的质量 D.反应前后装置e的质量
③熄灭酒精灯之后,仍需通一段时间H2至试管冷却,原因是_______ 。
(1)可利用葡萄糖还原CuSO4溶液制备氧化亚铜。
①配制490mL0.1mol·L-1CuSO4溶液,需要称取胆矾晶体的质量为
②某同学为检验CuO样品中是否含有Cu2O,可向样品中加入足量稀硫酸,若观察到
(2)向CuSO4和NaBr的混合溶液中通入足量的二氧化硫可得到溴化亚铜沉淀。完成该反应的离子方程式:□Cu2++□Br-+□SO2+□H2O=□CuBr↓+□
 +□_____。
+□_____。(3)某小组同学取含有少量CuO杂质的Cu2O样品进行如下实验,以测定氧化亚铜的纯度。

①装置a中所加的酸X是
②通过测定下列物理量,能达到实验目的的是
A.反应前后装置a的质量 B.充分反应后装置c所得固体的质量
C.反应前后装置d的质量 D.反应前后装置e的质量
③熄灭酒精灯之后,仍需通一段时间H2至试管冷却,原因是
您最近一年使用:0次
6 . 氯化铁主要用于金属蚀刻,污水处理,某化学活动小组同学利用下列部分装置在实验室制备纯净的 。
。

查阅资料:
回答下列问题:
(1)基态Fe原子的电子排布式为_______ 。
(2)装置H中仪器b的名称为_______ ,c中盛放的药品名称为_______ ,装置A中导管a的作用是_______ 。
(3)若用高锰酸钾固体和浓盐酸制取氯气,反应的离子方程式为_______ ,为了达到实验目的,需要选用的上述装置有_______ (请按气流通过的顺序填入对应的字母,每套装置只能使用一次)。
(4)你认为选择该收集装置的理由是_______ 。
(5)请设计实验验证制得的氯化铁中是否存在氯化亚铁,实验操作和现象为_______ 。
(6)实验完成后,称取9.00 g样品溶于过量的稀盐酸,然后加入足量的NaOH溶液,充分反应后过滤、洗涤,灼烧至恒重为4.80 g。则该样品中铁元素的质量分数为_______ %(计算结果保留小数点后一位)。
 。
。
查阅资料:
| 物质 | 熔点 | 沸点 | 性质 | 工业制法 |
| 氯化铁 | 306℃ | 315℃ | 易溶于水并且有强烈的吸水性,易潮解易升华 | 向500~600℃的铁粉中通入氯气 |
| 氯化亚铁 | 670℃ | 700℃ | 易潮解,易溶于水、乙醇、乙酸 | 向炽热铁粉中通入氯化氢 |
(1)基态Fe原子的电子排布式为
(2)装置H中仪器b的名称为
(3)若用高锰酸钾固体和浓盐酸制取氯气,反应的离子方程式为
(4)你认为选择该收集装置的理由是
(5)请设计实验验证制得的氯化铁中是否存在氯化亚铁,实验操作和现象为
(6)实验完成后,称取9.00 g样品溶于过量的稀盐酸,然后加入足量的NaOH溶液,充分反应后过滤、洗涤,灼烧至恒重为4.80 g。则该样品中铁元素的质量分数为
您最近一年使用:0次
名校
解题方法
7 . 一氯甲烷(CH3Cl)一种重要的化工原料,常温下它是无色有毒气体,微溶于水,易溶于乙醇、CCl4等有机浓剂。
(1)甲组同学在实验室用装置A模拟催化法制备一氯甲烷并检验CH3Cl的稳定性。
A.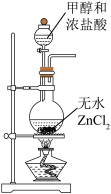 B.
B. 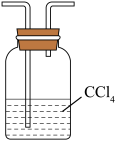 C.
C. 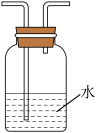 D.
D. 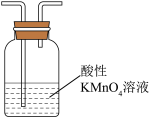
①装置A中仪器a的名称为__________ ,a瓶中发生反应的化学方程式为________ 。
②实验室干燥ZnCl2晶体制备无水ZnCl2的方法是________ 。
(2)为探究CH3Cl与CH4分子稳定性的差别,乙组同学设计实验验证CH3C1能被酸性KMnO4溶液氧化。
①为达到实验目的,上面装置图中装置连接的合理顺序为A________
②装置中水的主要作用是__________ 。
③若实验过程中还产生了一种黄绿色气体和一种无色气体,该反应的离子方程式为_____ 。
(3)丙组同学选用A装置设计实验探究甲醇的转化率。取6.4g甲醇与足量的浓盐酸充分反应,将收集到的CH3Cl气体在足量的氧气中充分燃烧,产物用过量的V1mL、c1mol·L-1NaOH溶液充分吸收。现以甲基橙作指示剂,用c2mol·L-1盐酸标准溶液对吸收液进行返滴定,最终消耗V2mL盐酸。(已知:2CH3Cl+3O2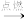 2CO2+2H2O+2HCl)
2CO2+2H2O+2HCl)
①滴定终点的现象为____________
②该反应甲醇的转化率为________ 。(用含有V、c的式子表示)
(1)甲组同学在实验室用装置A模拟催化法制备一氯甲烷并检验CH3Cl的稳定性。
A.
 B.
B.  C.
C.  D.
D. 
①装置A中仪器a的名称为
②实验室干燥ZnCl2晶体制备无水ZnCl2的方法是
(2)为探究CH3Cl与CH4分子稳定性的差别,乙组同学设计实验验证CH3C1能被酸性KMnO4溶液氧化。
①为达到实验目的,上面装置图中装置连接的合理顺序为A
②装置中水的主要作用是
③若实验过程中还产生了一种黄绿色气体和一种无色气体,该反应的离子方程式为
(3)丙组同学选用A装置设计实验探究甲醇的转化率。取6.4g甲醇与足量的浓盐酸充分反应,将收集到的CH3Cl气体在足量的氧气中充分燃烧,产物用过量的V1mL、c1mol·L-1NaOH溶液充分吸收。现以甲基橙作指示剂,用c2mol·L-1盐酸标准溶液对吸收液进行返滴定,最终消耗V2mL盐酸。(已知:2CH3Cl+3O2
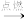 2CO2+2H2O+2HCl)
2CO2+2H2O+2HCl)①滴定终点的现象为
②该反应甲醇的转化率为
您最近一年使用:0次
2020-02-24更新
|
145次组卷
|
2卷引用:四川省遂宁市第二中学2020届高三上学期第三次高考模拟理综化学试题
8 . 用下图装置进行①中实验,对应②中现象正确,且能达成相应实验目的的是
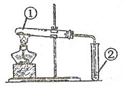

| 选项 | ①中实验 | ②中现象 | 实验目的 |
| A | 将浸透石蜡油的石棉加热 | Br2的CCl4溶液褪色 | 石蜡裂解产物中含有烯烃 |
| B | 加热NH4Cl固体 | 酚酞溶液变红 | 制备氨气并检验氨气性质 |
| C | 加热NaHCO3与Na2CO3混合粉末 | 澄清石灰水变浑浊 | 验证 NaHCO3具有热不稳定性 |
| D | 加热铁粉及湿棉花 | 肥皂水中有气泡冒出 | Fe 与H2O发生了置换反应 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
9 . 氯化铁,黑棕色结晶,熔点306℃、沸点315℃,易升华;FeCl3易溶于水且具有强烈的吸水性。某化学兴趣小组利用如下装置(夹持仪器略去)制备氯化铁晶体 ( FeCl3.6H2O)。
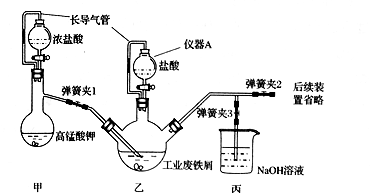
(1)仪器A的名称是____ ,在该实验中长导气管的作用是____ ,同时防止盐酸挥发污染环境。
(2)装置甲中发生反应的离子方程式为____ ,装置丙的作用为__________________ 。
(3)为顺利达成实验目的,实验过程中先关闭弹簧夹l和3,打开弹簧夹2,再打开乙装置中的活塞,待铁粉完全溶解后,关闭乙中的活塞,___ 再打开甲中的活塞。
(4)在实验过程中判断乙瓶中铁元素完全转化成氯化铁的方法是:取试样于试管中,然后向试管中力口入__ (填试剂)后观察现象。
(5)反应结束后,将乙中溶液边加入____ ,边进行加热浓缩、____ 、过滤、洗涤、干燥即得到产品。

(1)仪器A的名称是
(2)装置甲中发生反应的离子方程式为
(3)为顺利达成实验目的,实验过程中先关闭弹簧夹l和3,打开弹簧夹2,再打开乙装置中的活塞,待铁粉完全溶解后,关闭乙中的活塞,
(4)在实验过程中判断乙瓶中铁元素完全转化成氯化铁的方法是:取试样于试管中,然后向试管中力口入
(5)反应结束后,将乙中溶液边加入
您最近一年使用:0次
10 . 将NaCl溶液电解后通入ClO2,能得到一种高效漂白剂和氧化剂NaClO2。某同学在实验室中对此反应进行了探究。回答下列问题:
(1)配制一定物质的量浓度的NaCl溶液,除容量瓶、玻璃棒、量筒、烧杯外,还需要的玻璃仪器是_________ (填名称)。
(2)ClO2是一种易溶于水而难溶于有机溶剂的气体,用亚氯酸钠固体与纯净的氯气反应可制取,反应为2NaClO2+Cl2=2ClO2+2NaCl。下图是实验室用于制备并收集一定量纯净ClO2的装置,其连按顺序为:a→__________ (按气流方向,用小写字母表示),E 装置的作用是________ 。
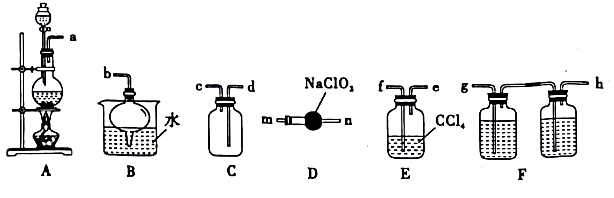
(3)探究NaClO2的氧化性及测定其纯度时进行了如下实验:
(1)配制一定物质的量浓度的NaCl溶液,除容量瓶、玻璃棒、量筒、烧杯外,还需要的玻璃仪器是
(2)ClO2是一种易溶于水而难溶于有机溶剂的气体,用亚氯酸钠固体与纯净的氯气反应可制取,反应为2NaClO2+Cl2=2ClO2+2NaCl。下图是实验室用于制备并收集一定量纯净ClO2的装置,其连按顺序为:a→

(3)探究NaClO2的氧化性及测定其纯度时进行了如下实验:
| 实验目的 | 操作步骤 | 现象或原因 |
| 1.证明NaClO2具有氧化性 | 取一定量的样品,用H2SO4酸化,再加入适量 | 溶液显红色 |
| 2.测定NaClO2的纯度 | ①准确称一定质量的样品,在酸性条件下加入适量蒸馏水和足量的KI晶体 | 致溶液显黄色的离子方程式 |
| ②取25.00mL上述待测溶液,加入 | 反应的离子方程式:I2+2S2O32-=2I-+S4O62- | |
| ③用一定浓度的Na2S2O3标准液滴定,当滴入最后一滴标准溶液时,反应达到滴定终点 |
您最近一年使用:0次



