21-22高二·全国·单元测试
1 . 下图所示为元素周期表的大致框架:
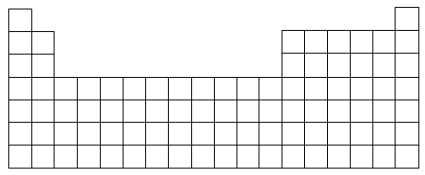
(1)在上图所示元素周期表中画出金属元素与非金属元素的分界线_______ 。
(2)鉴于NaH的存在,有人建议可把氢元素归到第ⅦA族。根据氢元素最高正化合价与最低负化合价的绝对值相等,也可把氢元素归到元素周期表中的_______ 族。
(3)现有甲、乙两种元素,甲元素原子核外3p能级上有5个电子,乙元素的焰色实验呈黄色。
①在上图所示的元素周期表中,将甲、乙两元素的元素符号填在元素周期表中的相应位置_______ 。
②甲元素与硫元素相比,非金属性较强的是_______ (填元素名称),写出可以验证该结论的一个化学方程式:_______ 。
(4)近年来“铊中毒”事件屡屡发生,铊再次成为公众关注的焦点。铊元素的相关信息如下图所示。下列叙述不正确的是_______ (填字母)。

A.铊元素在元素周期表中的位置是第六周期第ⅡA族
B.铊原子的中子数为204-81=123
C.6s26p1表示铊原子有6个电子层,最外电子层上有3个电子
D.铊元素的金属性比铝元素的强
E.铊元素是p区元素

(1)在上图所示元素周期表中画出金属元素与非金属元素的分界线
(2)鉴于NaH的存在,有人建议可把氢元素归到第ⅦA族。根据氢元素最高正化合价与最低负化合价的绝对值相等,也可把氢元素归到元素周期表中的
(3)现有甲、乙两种元素,甲元素原子核外3p能级上有5个电子,乙元素的焰色实验呈黄色。
①在上图所示的元素周期表中,将甲、乙两元素的元素符号填在元素周期表中的相应位置
②甲元素与硫元素相比,非金属性较强的是
(4)近年来“铊中毒”事件屡屡发生,铊再次成为公众关注的焦点。铊元素的相关信息如下图所示。下列叙述不正确的是

A.铊元素在元素周期表中的位置是第六周期第ⅡA族
B.铊原子的中子数为204-81=123
C.6s26p1表示铊原子有6个电子层,最外电子层上有3个电子
D.铊元素的金属性比铝元素的强
E.铊元素是p区元素
您最近一年使用:0次
名校
解题方法
2 . 氯化钠是化学工业的最基本原料之一,被称为“化学工业之母”。下列有关说法正确的是
| A.“制钠”:海水为原料制得精盐,再电解氯化钠溶液制备钠 |
| B.“氯碱工业”:采用“阴离子交换膜”电解槽电解饱和食盐水获得氯气和烧碱 |
| C.“侯氏制碱”:将二氧化碳通入氨化的氯化钠饱和溶液中,析出碳酸钠 |
| D.“制皂”:向油脂的碱性水解液中加入热的饱和食盐水,使高级脂肪酸盐析出,制得肥皂 |
您最近一年使用:0次
2021-09-11更新
|
662次组卷
|
4卷引用:第4章 化学反应与电能(能力提升卷)-【高效检测】2021-2022学年高二化学章末测试卷(人教版2019选择性必修1)
(已下线)第4章 化学反应与电能(能力提升卷)-【高效检测】2021-2022学年高二化学章末测试卷(人教版2019选择性必修1)江苏省苏州市2021-2022学年高三上学期期初调研考试化学试题江苏省苏州市相城区陆慕高级中学2022届高三上学期期初调研化学试题辽宁省大连市金普新区省示范性高中联合体2021-2022学年高三上学期第二阶段考试化学试题
名校
解题方法
3 . 按要求回答下列问题
(1)一定温度下,现有a.盐酸,b.硫酸,c.醋酸三种酸
①当三种酸体积相同,物质的量浓度相同时,使其恰好完全中和所需NaOH的物质的量由大到小的顺序是_______ (用a、b、c表示)
②当三者c(H+)相同且体积也相同时,分别放入足量的锌,相同状况下产生气体的体积由大到小的顺序是_______ (用a、b、c表示)
③当c(H+)相同、体积相同时,同时加入形状、密度、质量完全相同的锌,若产生相同体积的H2(相同状况),则开始时反应速率的大小关系为_______ (用a、b、c表示)
(2)现用中和滴定法测定某烧碱溶液的浓度,有关数据记录如表:
①用_______ 式滴定管盛装 盐酸标准液。如图表示第二次滴定前后50mL滴定管中液面的位置。
盐酸标准液。如图表示第二次滴定前后50mL滴定管中液面的位置。
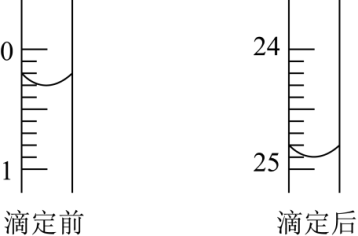
该次滴定所用标准盐酸体积为_______ mL。
②现实验室中有石蕊和酚酞两种指示剂,该实验应选用_______ 作指示剂。
③根据所给数据,该烧碱样品的物质的量浓度为_______ 。
④若操作过程中滴加盐酸速度过快,未充分振荡,刚看到溶液变色,就立刻停止滴定,则会造成测定结果_______ (填“偏低”“偏高”或“无影响”)。
(1)一定温度下,现有a.盐酸,b.硫酸,c.醋酸三种酸
①当三种酸体积相同,物质的量浓度相同时,使其恰好完全中和所需NaOH的物质的量由大到小的顺序是
②当三者c(H+)相同且体积也相同时,分别放入足量的锌,相同状况下产生气体的体积由大到小的顺序是
③当c(H+)相同、体积相同时,同时加入形状、密度、质量完全相同的锌,若产生相同体积的H2(相同状况),则开始时反应速率的大小关系为
(2)现用中和滴定法测定某烧碱溶液的浓度,有关数据记录如表:
| 滴定序号 | 待测液体积 | 所消耗盐酸标准液的体积 | ||
| 滴定前 | 滴定后 | 消耗的体积 | ||
| 1 | 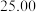 | 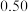 |  |  |
| 2 | 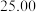 |  |  |  |
| 3 | 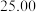 |  |  |  |
 盐酸标准液。如图表示第二次滴定前后50mL滴定管中液面的位置。
盐酸标准液。如图表示第二次滴定前后50mL滴定管中液面的位置。
该次滴定所用标准盐酸体积为
②现实验室中有石蕊和酚酞两种指示剂,该实验应选用
③根据所给数据,该烧碱样品的物质的量浓度为
④若操作过程中滴加盐酸速度过快,未充分振荡,刚看到溶液变色,就立刻停止滴定,则会造成测定结果
您最近一年使用:0次
2021-09-08更新
|
2381次组卷
|
9卷引用:第3章 水溶液中的离子平衡(提分小卷)-【单元测试】2021-2022学年高二化学尖子生选拔卷(人教版选修4)
(已下线)第3章 水溶液中的离子平衡(提分小卷)-【单元测试】2021-2022学年高二化学尖子生选拔卷(人教版选修4)辽宁省辽河油田第二高级中学2021-2022学年高二上学期开学考试化学试题河北饶阳中学2021-2022学年高二上学期第一阶段考试化学试题(已下线)3.2.3 酸碱中和滴定(基础过关A练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修1)(已下线)第三章 水溶液中的离子反应与平衡(A卷·知识通关练)-【单元测试】2022-2023学年高二化学分层训练AB卷(人教版2019选择性必修1)内蒙古乌兰察布市2021-2022学年高二上学期期末考试化学试题新疆乌鲁木齐市第四中学2021-2022学年高二上学期期末考试化学试题湖北省武汉海淀外国语实验学校2022-2023学年高二上学期10月月考化学试题(已下线)专题突破卷09 水溶液中的离子反应与平衡 ?-2024年高考化学一轮复习考点通关卷(新教材新高考)
2021高二·全国·专题练习
4 . 写出下列热化学方式
(1)在101 kPa时,4.0 g硫粉在氧气中完全燃烧生成二氧化硫,放出27 kJ的热量,硫燃烧的热化学方程式为___________ 。
(2)在101 kPa时,氢气在1.0 mol氧气中完全燃烧,生成2.0 mol液态水,放出571.6 kJ的热量,表示氢气燃烧的热化学方程式为___________ 。
(3)稀的强酸与稀的强碱反应生成生成1molH2O(l)时放出的热称为中和热。已知含20.0 g NaOH的稀溶液与稀盐酸完全中和,放出28.7 kJ的热量。写出表示中和热的热化学方程式:
___________ 。
(4)已知:0.4 mol液态肼(N2H4)与足量的液态双氧水反应,生成氮气和水蒸气,并放出256.65 kJ的热量,反应的热化学方程式为___________ 。
(5)已知充分燃烧a g乙炔(C2H2)气体时生成1 mol二氧化碳气体和液态水,并放出热量b kJ,乙炔燃烧的热化学方程式为___________ 。
(1)在101 kPa时,4.0 g硫粉在氧气中完全燃烧生成二氧化硫,放出27 kJ的热量,硫燃烧的热化学方程式为
(2)在101 kPa时,氢气在1.0 mol氧气中完全燃烧,生成2.0 mol液态水,放出571.6 kJ的热量,表示氢气燃烧的热化学方程式为
(3)稀的强酸与稀的强碱反应生成生成1molH2O(l)时放出的热称为中和热。已知含20.0 g NaOH的稀溶液与稀盐酸完全中和,放出28.7 kJ的热量。写出表示中和热的热化学方程式:
(4)已知:0.4 mol液态肼(N2H4)与足量的液态双氧水反应,生成氮气和水蒸气,并放出256.65 kJ的热量,反应的热化学方程式为
(5)已知充分燃烧a g乙炔(C2H2)气体时生成1 mol二氧化碳气体和液态水,并放出热量b kJ,乙炔燃烧的热化学方程式为
您最近一年使用:0次
2021-08-28更新
|
2648次组卷
|
4卷引用:第1章 化学反应的热效应(能力提升卷)-【高效检测】2021-2022学年高二化学章末测试卷(人教版2019选择性必修1)
(已下线)第1章 化学反应的热效应(能力提升卷)-【高效检测】2021-2022学年高二化学章末测试卷(人教版2019选择性必修1)(已下线)1.1.1 化学反应的焓变(2)(备作业)-【上好课】2021-2022学年高二化学同步备课系列(苏教版2019选择性必修1)河南省浉河区新时代学校2021-2022学年高二上学期第一次月考化学试题山东省德州市陵城区祥龙高级中学2022-2023学年高二上学期9月月考化学试题
5 . 已知常温下:
① ,
, ,
, ,
, ;
;
②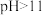 时,
时, 会转化为
会转化为 ;
;
③离子完全除去的标准:该离子浓度 。
。
某工业废水中含有 和
和 ,可采用沉淀法将其除去。
,可采用沉淀法将其除去。
(1)若加入 来沉淀
来沉淀 和
和 ,当溶液中
,当溶液中 和
和 共存时,
共存时,
___________ 。
(2)若加入 溶液来调节
溶液来调节 ,使
,使 和
和 完全沉淀,
完全沉淀, 应满足的范围为
应满足的范围为___________ 。
①
 ,
, ,
, ,
, ;
;②
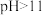 时,
时, 会转化为
会转化为 ;
;③离子完全除去的标准:该离子浓度
 。
。某工业废水中含有
 和
和 ,可采用沉淀法将其除去。
,可采用沉淀法将其除去。(1)若加入
 来沉淀
来沉淀 和
和 ,当溶液中
,当溶液中 和
和 共存时,
共存时,
(2)若加入
 溶液来调节
溶液来调节 ,使
,使 和
和 完全沉淀,
完全沉淀, 应满足的范围为
应满足的范围为
您最近一年使用:0次
名校
6 . CH4、CO2在催化剂作用下可以反应生成CH3COOH,该反应历程(化学吸附至脱附)可以用下图表示。下列说法不正确 的是


A.CH4在催化剂表面发生化学吸附可表示为:CH4(g) H*+CH3*(*表示吸附态) H*+CH3*(*表示吸附态) |
| B.②过程表示CH3COOH分子的脱附过程 |
| C.反应过程中有C-H键、C-C键、O-H键生成 |
| D.该合成反应是放热反应 |
您最近一年使用:0次
2021-07-12更新
|
1120次组卷
|
10卷引用:第一单元培优练-2021-2022学年高二化学课后培优练(人教版2019选择性必修1)
(已下线)第一单元培优练-2021-2022学年高二化学课后培优练(人教版2019选择性必修1)浙江省丽水市2020-2021学年高二下学期普通高中教学质量监控化学试题(已下线)1.1.3 能源的充分利用-2021-2022学年高二化学课后培优练(苏教版2019选择性必修1)浙江省绍兴鲁迅中学2021-2022学年高二上学期第一次限时训练化学试题浙江省桐庐中学2021-2022学年高二12月阶段性测试化学试题云南省楚雄天人中学2022-2023学年高二上学期九月月考化学试题吉林省长春市新解放学校2022-2023学年高二上学期11月月考化学试题广东省松湖莞中、深大附中两校2023-2024学年高二上学期10月联考化学试题云南省下关第一中学2023-2024学年高二上学期9月月考化学试题福建省龙岩市永定区城关中学2023-2024学年高二上学期期中考试化学试题
名校
7 . 现有浓度均为0.1mol•L-1某二元酸H2A和某一元酸HB,已知H2A的电离方程式为:H2A=H++HA-,HA- H++A2-。则下列有关说法
H++A2-。则下列有关说法不正确 的是
 H++A2-。则下列有关说法
H++A2-。则下列有关说法| A.若KHA溶液显酸性,说明HA-的电离程度大于水解程度 |
| B.中和相同体积的两种溶液,需要相同浓度的NaOH溶液体积比为V(H2A):V(HB)=2:1 |
| C.常温下,若两溶液有pH(H2A)<pH(HB),不能据此说明H2A的酸性强于HB |
| D.常温下,若已知Ka(HB)=1.6×10-6,则该酸的电离度约为0.4% |
您最近一年使用:0次
2021-06-30更新
|
1172次组卷
|
6卷引用:第3章 水溶液中的离子平衡(提分小卷)-【单元测试】2021-2022学年高二化学尖子生选拔卷(人教版选修4)
(已下线)第3章 水溶液中的离子平衡(提分小卷)-【单元测试】2021-2022学年高二化学尖子生选拔卷(人教版选修4)浙江省舟山市2020-2021学年高二下学期期末检测化学试题(已下线)3.1.2 电离平衡常数(基础过关A练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修1)(已下线)第三章 水溶液中的离子反应与平衡(A卷·知识通关练)-【单元测试】2022-2023学年高二化学分层训练AB卷(人教版2019选择性必修1)江西省宜春市万载中学2021-2022学年高一下学期第二次月考化学试题云南省开远市第一中学校2023-2024学年高二下学期3月月考化学试题
8 . (1)已知1g的甲烷完全燃烧生成液态水放出akJ的热量,写出表示甲烷燃烧热的热化学方程式为___ 。
(2)某实验小组用100mL0.55mol·L-1NaOH溶液与100mL0.5mol·L-1盐酸进行中和热的测定。装置如图所示。
回答下列问题:
①图中装置缺少的仪器是____ 。
②碱稍过量的原因是____ 。
③若将盐酸改为相同体积、相同浓度的醋酸,测得中和热为ΔH1,NaOH溶液与盐酸反应中和热为ΔH,则ΔH1____ ΔH(填写<、>、=);若测得该反应放出的热量为2.865kJ,请写出盐酸与NaOH溶液反应的中和热的热化学方程式:__
(3)已知拆开1molH-H键、1molCl-Cl键、1molH—Cl键分别需要的能量是akJ、bkJ、ckJ,则反应H2(g)+Cl2(g)=2HCl(g)的∆H=____ 。
(4)①2O2(g)+N2(g)=N2O4(l) ∆H1
②N2(g)+2H2(g)=N2H4(l) ∆H2
③O2(g)+2H2(g)=2H2O(g) ∆H3
④2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g) ∆H4
上述反应热效应之间的关系式为∆H4=____ (用∆H1、∆H2、∆H3表示)。
(2)某实验小组用100mL0.55mol·L-1NaOH溶液与100mL0.5mol·L-1盐酸进行中和热的测定。装置如图所示。

回答下列问题:
①图中装置缺少的仪器是
②碱稍过量的原因是
③若将盐酸改为相同体积、相同浓度的醋酸,测得中和热为ΔH1,NaOH溶液与盐酸反应中和热为ΔH,则ΔH1
(3)已知拆开1molH-H键、1molCl-Cl键、1molH—Cl键分别需要的能量是akJ、bkJ、ckJ,则反应H2(g)+Cl2(g)=2HCl(g)的∆H=
(4)①2O2(g)+N2(g)=N2O4(l) ∆H1
②N2(g)+2H2(g)=N2H4(l) ∆H2
③O2(g)+2H2(g)=2H2O(g) ∆H3
④2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g) ∆H4
上述反应热效应之间的关系式为∆H4=
您最近一年使用:0次
名校
9 . 下列说法不正确的是
| A.碳原子核外最外电子层有4个电子 |
| B.1个碳原子可以与其他非金属原子形成4个共价键 |
| C.两个碳原子之间能形成单键、双键或三键 |
| D.所有有机化合物都含有σ键和π键 |
您最近一年使用:0次
2021-05-19更新
|
407次组卷
|
4卷引用:第一章 有机化合物的结构特点与研究方法 章末测试(B)-2021-2022学年高二化学同步课时跟踪训练(人教版2019选择性必修3)
(已下线)第一章 有机化合物的结构特点与研究方法 章末测试(B)-2021-2022学年高二化学同步课时跟踪训练(人教版2019选择性必修3)辽宁省葫芦岛市第八高级中学2020-2021学年高二下学期期中考试化学试题(已下线)【知识图鉴】单元讲练测选择性必修3第1单元03巩固练安徽省安庆市第七中学2021-2022学年高二下学期3月阶段性考试化学试题
解题方法
10 . 苯甲酸是一种重要原料。实验室可以用高锰酸钾在中性条件下氧化甲苯(副产品为MnO2)制得,有关数据如下:
合成步骤:
①在装有电动搅拌,温度计和球形冷凝管的三颈烧瓶中加入2.7mL甲苯和100mL蒸馏水,分批加入8.5g高锰酸钾固体,回流4小时。
②反应结束后,趁热过滤,热水洗涤后,冰水冷却,盐酸酸化,抽滤,洗涤,沸水浴干燥得苯甲酸粗品。
回答下列问题;
(1)基态Mn原子的电子排布式:_______ 。
(2)请写出甲苯被高锰酸钾氧化的化学反应方程式:_______ 。
(3)球形冷凝管的作用是_______ ,步骤①中反应完全的现象是_______ 。
(4)实验过程中,发现滤液呈紫色,盐酸酸化时产生了黄绿色气体,酸化操作前加入最理想的_______ 溶液消除过量的高锰酸钾。
A.NaHSO3 B.H2O2 C.Na D.FeCl3
(5)重结晶时,苯甲酸粗品完全溶解后,须补加少量蒸馏水,目的是_______ 。
(6)副产品MnO2是碱式锌锰电池的正极材料,放电时产生MnO(OH),正极的反应式为_______ 。
| 熔点/℃ | 沸点/℃ | 水中溶解度/g(25℃) | 相对分子质量 | 密度/(g·cm-3) | |
| 甲苯 | -94.9 | 110.6 | 难溶 | 92 | 0.85 |
| 苯甲酸 | 122.13 | 249 | 0.344 | 122 | 1.27 |
①在装有电动搅拌,温度计和球形冷凝管的三颈烧瓶中加入2.7mL甲苯和100mL蒸馏水,分批加入8.5g高锰酸钾固体,回流4小时。
②反应结束后,趁热过滤,热水洗涤后,冰水冷却,盐酸酸化,抽滤,洗涤,沸水浴干燥得苯甲酸粗品。
回答下列问题;
(1)基态Mn原子的电子排布式:
(2)请写出甲苯被高锰酸钾氧化的化学反应方程式:
(3)球形冷凝管的作用是
(4)实验过程中,发现滤液呈紫色,盐酸酸化时产生了黄绿色气体,酸化操作前加入最理想的
A.NaHSO3 B.H2O2 C.Na D.FeCl3
(5)重结晶时,苯甲酸粗品完全溶解后,须补加少量蒸馏水,目的是
(6)副产品MnO2是碱式锌锰电池的正极材料,放电时产生MnO(OH),正极的反应式为
您最近一年使用:0次



