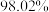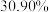名校
1 . 合成氨反应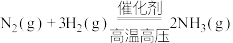 是目前最有效的工业固氮方法,解决数亿人口生存问题。回答下列问题:
是目前最有效的工业固氮方法,解决数亿人口生存问题。回答下列问题:
(1)合成氨反应在催化作用的化学吸附及初步表面反应历程如下:
①写出N2参与化学吸附的反应方程式:_____________ 。
②以上历程须克服的最大能垒为______ eV。
(2)t℃、0.9MPa的条件下,向一恒压密闭容器中通入氢氮比为3的混合气体,体系中气体的含量与时间变化关系如图所示:
______  ,该反应的
,该反应的
______ (用数字表达式表示,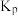 为以分压表示的平衡常数,分压=总压×物质的量分数)。
为以分压表示的平衡常数,分压=总压×物质的量分数)。
②下列叙述能说明该条件下反应达到平衡状态的是______ (填标号)。
a.氨气的体积分数保持不变
b.容器中氢氮比保持不变
c.N2和NH3的平均反应速率之比为1∶2
d.气体密度保持不变
(3)如图是20℃时,NH3-CO2-H2O三元体系相图。纵坐标代表CO2的体积分数,横坐标代表NH3的体积分数,坐标原点代表液态纯水。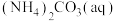 与
与 ,也可选择无水体系反应得到
,也可选择无水体系反应得到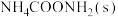 。
。
①20℃时,利用NH3(g)、CO2(g)和H2O(l)制备NH4HCO3(aq)的最佳曲线是______ (填“A-H2O”或“B-H2O”)。
②B点可得到的产品是______ (填化学式)。
(4)钌系催化剂是目前合成氨最先进的催化剂。一种钌的化合物晶胞结构如图。该晶胞中与 等距最近的
等距最近的 有
有______ 个,若该晶胞边长为a pm,该晶体的密度为______  (
(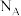 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
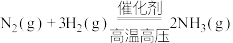 是目前最有效的工业固氮方法,解决数亿人口生存问题。回答下列问题:
是目前最有效的工业固氮方法,解决数亿人口生存问题。回答下列问题:(1)合成氨反应在催化作用的化学吸附及初步表面反应历程如下:

①写出N2参与化学吸附的反应方程式:
②以上历程须克服的最大能垒为
(2)t℃、0.9MPa的条件下,向一恒压密闭容器中通入氢氮比为3的混合气体,体系中气体的含量与时间变化关系如图所示:


 ,该反应的
,该反应的
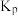 为以分压表示的平衡常数,分压=总压×物质的量分数)。
为以分压表示的平衡常数,分压=总压×物质的量分数)。②下列叙述能说明该条件下反应达到平衡状态的是
a.氨气的体积分数保持不变
b.容器中氢氮比保持不变
c.N2和NH3的平均反应速率之比为1∶2
d.气体密度保持不变
(3)如图是20℃时,NH3-CO2-H2O三元体系相图。纵坐标代表CO2的体积分数,横坐标代表NH3的体积分数,坐标原点代表液态纯水。
 与
与 ,也可选择无水体系反应得到
,也可选择无水体系反应得到 。
。①20℃时,利用NH3(g)、CO2(g)和H2O(l)制备NH4HCO3(aq)的最佳曲线是
②B点可得到的产品是
(4)钌系催化剂是目前合成氨最先进的催化剂。一种钌的化合物晶胞结构如图。该晶胞中与
 等距最近的
等距最近的 有
有 (
(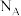 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
您最近一年使用:0次
名校
2 . “零碳甲醇”是符合“碳中和”属性的绿色能源。请回答下列有关问题。
(1)已知: ;
; ,
, (a>0,b>0)假设该反应的焓变和熵变不随温度的改变而改变,则该反应能自发进行温度范围
(a>0,b>0)假设该反应的焓变和熵变不随温度的改变而改变,则该反应能自发进行温度范围_____ K(用含a、b的代数式表示)。
(2)某温度下,用 溶液吸收一定量的
溶液吸收一定量的 后,
后, ,则该溶液pOH=
,则该溶液pOH=_____ (该温度下 的
的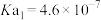 、
、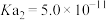 、
、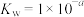 ,用含a的代数式表示)。
,用含a的代数式表示)。
(3)合成甲醇有两种方法。
直接法:
Ⅰ.
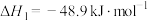
间接法: 和
和 通过逆水煤气反应,先合成CO后,CO和
通过逆水煤气反应,先合成CO后,CO和 再合成甲醇。
再合成甲醇。
Ⅱ.
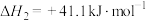
Ⅲ.
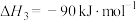
①若利用间接工艺法合成甲醇,反应的决速步为逆水煤气反应,下列示意图中能体现上述反应体系能量变化的是_____ (填字母)。_____ 。
③一定温度、50bar(1bar=100kPa)恒压下,按进料气含a% 、3a%
、3a% (体积分数,杂质气体不反应)合成甲醇,仅发生反应Ⅰ.平衡时二氧化碳转化率为90%,则
(体积分数,杂质气体不反应)合成甲醇,仅发生反应Ⅰ.平衡时二氧化碳转化率为90%,则
_____ bar,反应的平衡常数
_____  (用含a的代数式表示)。
(用含a的代数式表示)。
(4)甲醇、乙醇、正丙醇三种物质在温度传感器尖头处蒸发时的温度变化曲线如图,根据曲线下降的幅度和速率的快慢,可以比较分子间作用力的大小。请判断表示甲醇的曲线是_____ ,理由是_____ 。
(1)已知:
 ;
; ,
, (a>0,b>0)假设该反应的焓变和熵变不随温度的改变而改变,则该反应能自发进行温度范围
(a>0,b>0)假设该反应的焓变和熵变不随温度的改变而改变,则该反应能自发进行温度范围(2)某温度下,用
 溶液吸收一定量的
溶液吸收一定量的 后,
后, ,则该溶液pOH=
,则该溶液pOH= 的
的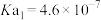 、
、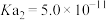 、
、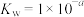 ,用含a的代数式表示)。
,用含a的代数式表示)。(3)合成甲醇有两种方法。
直接法:
Ⅰ.

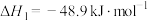
间接法:
 和
和 通过逆水煤气反应,先合成CO后,CO和
通过逆水煤气反应,先合成CO后,CO和 再合成甲醇。
再合成甲醇。Ⅱ.

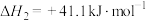
Ⅲ.

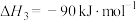
①若利用间接工艺法合成甲醇,反应的决速步为逆水煤气反应,下列示意图中能体现上述反应体系能量变化的是


③一定温度、50bar(1bar=100kPa)恒压下,按进料气含a%
 、3a%
、3a% (体积分数,杂质气体不反应)合成甲醇,仅发生反应Ⅰ.平衡时二氧化碳转化率为90%,则
(体积分数,杂质气体不反应)合成甲醇,仅发生反应Ⅰ.平衡时二氧化碳转化率为90%,则

 (用含a的代数式表示)。
(用含a的代数式表示)。(4)甲醇、乙醇、正丙醇三种物质在温度传感器尖头处蒸发时的温度变化曲线如图,根据曲线下降的幅度和速率的快慢,可以比较分子间作用力的大小。请判断表示甲醇的曲线是

您最近一年使用:0次
名校
3 . 氯化磷酸三钠熔点67℃,常温下较稳定,受热易分解,具有良好的消杀、漂白作用,广泛用于医药、餐饮行业。某小组设计如下流程制备氯化磷酸三钠。下列叙述错误的是
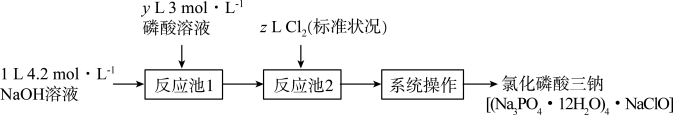
| A.理论上制得的氯化磷酸三钠不超过0.3mol |
B.“反应池1”中最少应加入400mL3 磷酸溶液 磷酸溶液 |
| C.“系列操作”包括蒸发浓缩、降温结晶、过滤、洗涤和高温烘干 |
| D.氧化磷酸三钠因含NaClO而具有消杀、漂白作用 |
您最近一年使用:0次
名校
4 . 化合物Ⅷ是一种用于制备神经抑制剂的中间体,其合成路线如下:
(1)化合物Ⅰ的分子式是________ 。化合物Ⅷ中的非含氧官能团的名称是________ 。
(2)化合物Ⅰ的沸点高于化合物Ⅱ,其原因是____________ 。
(3)反应①是原子利用率100%的反应,则a为________ 。
(4)反应②的反应类型为________ 。
(5)化合物Ⅲ有多种同分异构体,其中含 结构的有
结构的有________ 种(不计Ⅲ),其中核磁共振氢谱的峰面积比为6∶1∶1的结构简式为________ (写出其中一种)。
(6)写出以 和乙醇为原料合成化合物
和乙醇为原料合成化合物 的单体的合成路线(无机试剂任用)
的单体的合成路线(无机试剂任用)_______________ 。

(1)化合物Ⅰ的分子式是
(2)化合物Ⅰ的沸点高于化合物Ⅱ,其原因是
(3)反应①是原子利用率100%的反应,则a为
(4)反应②的反应类型为
(5)化合物Ⅲ有多种同分异构体,其中含
 结构的有
结构的有(6)写出以
 和乙醇为原料合成化合物
和乙醇为原料合成化合物 的单体的合成路线(无机试剂任用)
的单体的合成路线(无机试剂任用)
您最近一年使用:0次
名校
解题方法
5 . 随着煤和石油等不可再生能源的日益枯竭,同时在“碳达峰”与“碳中和”可持续发展的目标下,作为清洁能源的天然气受到了广泛的关注。甲烷干重整反应 可以将两种温室气体(
可以将两种温室气体( 和
和 )直接转化为合成气(主要成分为
)直接转化为合成气(主要成分为 和
和 ),兼具环境效益和经济效益。
),兼具环境效益和经济效益。
(1)已知: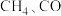 和
和 的燃烧热
的燃烧热 分别为
分别为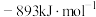 、
、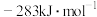 和
和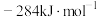 ,则甲烷干重整反应
,则甲烷干重整反应 的
的 为
为___________  。
。
(2)合成气可以用于生成甲醇,在容积为 的恒容密闭容器中加入
的恒容密闭容器中加入 和
和 ,发生反应
,发生反应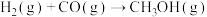 (未配平),各组分的物质的量随时间的变化如图所示。
(未配平),各组分的物质的量随时间的变化如图所示。 内
内
_____________  ;
;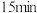 时改变的条件不可能是
时改变的条件不可能是____________ (填标号)。
A.充入 B.充入
B.充入 C.通入惰性气体
C.通入惰性气体
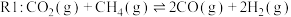 (主反应)
(主反应)
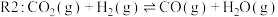
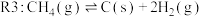
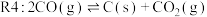
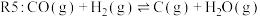
各反应的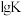 (
( 为各反应的平衡常数)与温度的关系如图所示。由图可知,为提高主反应的转化率应
为各反应的平衡常数)与温度的关系如图所示。由图可知,为提高主反应的转化率应____________ (填“升高温度”或“降低温度”),简述判断的理由________________________ 。
(5)在 、温度为
、温度为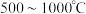 、进料配比
、进料配比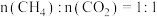 的条件下,甲烷干重整过程中甲烷的转化率、
的条件下,甲烷干重整过程中甲烷的转化率、 的转化率和积碳率随着温度变化的规律如图所示。
的转化率和积碳率随着温度变化的规律如图所示。____________  。
。
②在最佳温度、初始压强 条件下,向某
条件下,向某 的恒容密闭容器中加入
的恒容密闭容器中加入 和
和 ,设只发生
,设只发生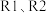 两个反应。达平衡后,测得容器中
两个反应。达平衡后,测得容器中 的浓度为
的浓度为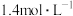 ,
, 的转化率为
的转化率为 ,则此时
,则此时 反应的压强平衡常数
反应的压强平衡常数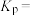
_____________ 。(列出计算式,压强平衡常数用各组分的平衡分压代替物质的量浓度进行计算,平衡分压 物质的量分数
物质的量分数 平衡总压强)。
平衡总压强)。
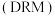 可以将两种温室气体(
可以将两种温室气体( 和
和 )直接转化为合成气(主要成分为
)直接转化为合成气(主要成分为 和
和 ),兼具环境效益和经济效益。
),兼具环境效益和经济效益。(1)已知:
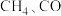 和
和 的燃烧热
的燃烧热 分别为
分别为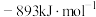 、
、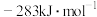 和
和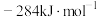 ,则甲烷干重整反应
,则甲烷干重整反应 的
的 为
为 。
。(2)合成气可以用于生成甲醇,在容积为
 的恒容密闭容器中加入
的恒容密闭容器中加入 和
和 ,发生反应
,发生反应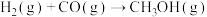 (未配平),各组分的物质的量随时间的变化如图所示。
(未配平),各组分的物质的量随时间的变化如图所示。 内
内
 ;
;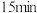 时改变的条件不可能是
时改变的条件不可能是A.充入
 B.充入
B.充入 C.通入惰性气体
C.通入惰性气体
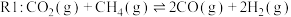 (主反应)
(主反应)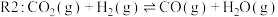
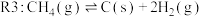
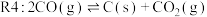
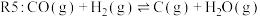
各反应的
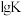 (
( 为各反应的平衡常数)与温度的关系如图所示。由图可知,为提高主反应的转化率应
为各反应的平衡常数)与温度的关系如图所示。由图可知,为提高主反应的转化率应
A. 和 和 的转化率相等 的转化率相等 | B.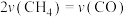 |
C. 的体积分数保持不变 的体积分数保持不变 | D.体系的温度不再变化 |
(5)在
 、温度为
、温度为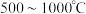 、进料配比
、进料配比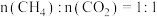 的条件下,甲烷干重整过程中甲烷的转化率、
的条件下,甲烷干重整过程中甲烷的转化率、 的转化率和积碳率随着温度变化的规律如图所示。
的转化率和积碳率随着温度变化的规律如图所示。
 。
。②在最佳温度、初始压强
 条件下,向某
条件下,向某 的恒容密闭容器中加入
的恒容密闭容器中加入 和
和 ,设只发生
,设只发生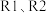 两个反应。达平衡后,测得容器中
两个反应。达平衡后,测得容器中 的浓度为
的浓度为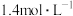 ,
, 的转化率为
的转化率为 ,则此时
,则此时 反应的压强平衡常数
反应的压强平衡常数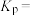
 物质的量分数
物质的量分数 平衡总压强)。
平衡总压强)。
您最近一年使用:0次
名校
解题方法
6 . 某小组设计如下装置测定新装修居室内空气中甲醛的含量(夹持装置略)。
已知:①测定原理为甲醛把Ag+还原成Ag,产生的Ag与Fe3+定量反应生成Fe2+,Fe2+与菲洛嗪形成有色配合物,通过测定吸光度计算出甲醛的含量;
②吸光度用A表示,计算公式为A=abc,其中a为吸光度系数,b为光在样本中经过的距离,c为溶液浓度。
Ⅰ.制备银氨溶液。
(1)仪器A的名称是____________ 。
(2)向仪器A、B中加入药品,将B中的___________ (填“AgNO3溶液”或“氨水”)逐滴加入A中至___________ (填实验现象)。
Ⅱ.吸收室内空气中甲醛。
(3)选择正确的操作,完成室内空气中甲醛含量的测定:
操作①:取下玻璃塞→操作②:____ →操作③:______ →操作④:使可滑动隔板处于最右端→操作⑤:___ →操作⑥:_____ →操作⑦:_____ →再将操作③~⑦重复 4 次 →测定溶液吸光度。
a.打开K1,关闭K2
b.打开K2,关闭K1
c.将可滑动隔板拉至最左端
d.热水浴加热仪器A
e.将可滑动隔板缓慢推至最右端
f.将可滑动隔板迅速推至最右端
(4)装置中使用毛细管而非普通玻璃管的原因是_____________ ,写出甲醛与银氨溶液反应的化学方程式____________ 。
Ⅲ.测定甲醛含量。
(5)将仪器A中溶液的pH调至1,加入足量Fe2(SO4)3溶液,充分反应后加入菲洛嗪,通过测定吸光度确定生成Fe2+1.12mg,则空气中甲醛的含量为__________ mg/L。
(6)下列说法正确的是__________。
(7)Fe2+能够与许多化合物形成配位化合物。邻二氮菲( )与Fe2+形成的红色配合物[Fe(phen)3]2+,该配合物的特征颜色可用于测定Fe2+的浓度。
)与Fe2+形成的红色配合物[Fe(phen)3]2+,该配合物的特征颜色可用于测定Fe2+的浓度。
①红色配离子[Fe(phen)3]2+中不存在的作用力有__________ 。
A.σ键 B.π键 C.离子键 D.氢键 E.配位键
②实验表明,邻二氮菲检验Fe2+的适宜pH范围是2~9,试分析原因是_____________ 。
已知:①测定原理为甲醛把Ag+还原成Ag,产生的Ag与Fe3+定量反应生成Fe2+,Fe2+与菲洛嗪形成有色配合物,通过测定吸光度计算出甲醛的含量;
②吸光度用A表示,计算公式为A=abc,其中a为吸光度系数,b为光在样本中经过的距离,c为溶液浓度。

Ⅰ.制备银氨溶液。
(1)仪器A的名称是
(2)向仪器A、B中加入药品,将B中的
Ⅱ.吸收室内空气中甲醛。
(3)选择正确的操作,完成室内空气中甲醛含量的测定:
操作①:取下玻璃塞→操作②:
a.打开K1,关闭K2
b.打开K2,关闭K1
c.将可滑动隔板拉至最左端
d.热水浴加热仪器A
e.将可滑动隔板缓慢推至最右端
f.将可滑动隔板迅速推至最右端
(4)装置中使用毛细管而非普通玻璃管的原因是
Ⅲ.测定甲醛含量。
(5)将仪器A中溶液的pH调至1,加入足量Fe2(SO4)3溶液,充分反应后加入菲洛嗪,通过测定吸光度确定生成Fe2+1.12mg,则空气中甲醛的含量为
(6)下列说法正确的是__________。
| A.本实验缺少尾气处理装置 |
| B.实验应在室内不同点位进行空气取样,以保证数据的准确性 |
| C.毛细管的作用是减小空气通入速率,保证空气中的HCHO被吸收完全 |
| D.有色配合物浓度越大,测得吸光度数值越大 |
 )与Fe2+形成的红色配合物[Fe(phen)3]2+,该配合物的特征颜色可用于测定Fe2+的浓度。
)与Fe2+形成的红色配合物[Fe(phen)3]2+,该配合物的特征颜色可用于测定Fe2+的浓度。①红色配离子[Fe(phen)3]2+中不存在的作用力有
A.σ键 B.π键 C.离子键 D.氢键 E.配位键
②实验表明,邻二氮菲检验Fe2+的适宜pH范围是2~9,试分析原因是
您最近一年使用:0次
名校
7 . 用过二硫酸铵 溶液作浸取剂可以提取黄铜矿(主要成分为
溶液作浸取剂可以提取黄铜矿(主要成分为 )中的铜。
)中的铜。
已知:ⅰ.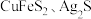 均能导电;
均能导电;
ⅱ.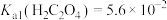 ;
;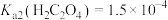 ;
;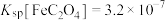
(1) 的晶体中基本结构单元如图1、图2所示。
的晶体中基本结构单元如图1、图2所示。 的配位数为
的配位数为_________ 。
②能够表示 晶胞的是
晶胞的是_____________ 。(填“图1”、“图2”或“图1和图2”)
(2)用 溶液作浸取剂浸取
溶液作浸取剂浸取 的原理示意如图3所示。
的原理示意如图3所示。 与
与 反应的离子方程式为
反应的离子方程式为____________________________ 。
②浸取初期,随着浸取时间延长, 的浸出速率迅速提高,其可能的原因是
的浸出速率迅速提高,其可能的原因是______________ 。
(3)在足量 溶液中添加少量
溶液中添加少量 溶液作为浸取剂与
溶液作为浸取剂与 作用,一段时间结果如下:
作用,一段时间结果如下:
①添加 可以显著提高
可以显著提高 元素的浸出率的原因:
元素的浸出率的原因:_____________________________ 。
②进一步研究发现添加的少量 可以循环参与反应。
可以循环参与反应。 “再生”的离子方程式为:
“再生”的离子方程式为:______________ 。
(4)进一步从浸出液中提取铜并使 再生并得到相对纯净的
再生并得到相对纯净的 的流程如图所示。
的流程如图所示。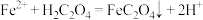 ,该反应化学平衡常数为
,该反应化学平衡常数为______________ 。有同学认为 是二元弱酸,若改用
是二元弱酸,若改用 溶液沉淀效果会更好,你是否同意?
溶液沉淀效果会更好,你是否同意?_____________ (填“是”或“否”)
②生成 的电极反应式是
的电极反应式是_____________________ 。
 溶液作浸取剂可以提取黄铜矿(主要成分为
溶液作浸取剂可以提取黄铜矿(主要成分为 )中的铜。
)中的铜。已知:ⅰ.
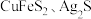 均能导电;
均能导电;ⅱ.
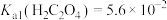 ;
;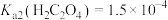 ;
;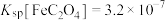
(1)
 的晶体中基本结构单元如图1、图2所示。
的晶体中基本结构单元如图1、图2所示。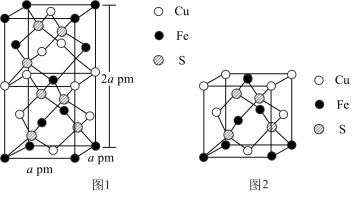
 的配位数为
的配位数为②能够表示
 晶胞的是
晶胞的是(2)用
 溶液作浸取剂浸取
溶液作浸取剂浸取 的原理示意如图3所示。
的原理示意如图3所示。
 与
与 反应的离子方程式为
反应的离子方程式为②浸取初期,随着浸取时间延长,
 的浸出速率迅速提高,其可能的原因是
的浸出速率迅速提高,其可能的原因是(3)在足量
 溶液中添加少量
溶液中添加少量 溶液作为浸取剂与
溶液作为浸取剂与 作用,一段时间结果如下:
作用,一段时间结果如下:添加 | 图3未加 | |
|
|
|
过程中产物形态 |
|
|
 可以显著提高
可以显著提高 元素的浸出率的原因:
元素的浸出率的原因:②进一步研究发现添加的少量
 可以循环参与反应。
可以循环参与反应。 “再生”的离子方程式为:
“再生”的离子方程式为:(4)进一步从浸出液中提取铜并使
 再生并得到相对纯净的
再生并得到相对纯净的 的流程如图所示。
的流程如图所示。
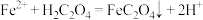 ,该反应化学平衡常数为
,该反应化学平衡常数为 是二元弱酸,若改用
是二元弱酸,若改用 溶液沉淀效果会更好,你是否同意?
溶液沉淀效果会更好,你是否同意?②生成
 的电极反应式是
的电极反应式是
您最近一年使用:0次
名校
解题方法
8 . 一种制备 的工艺路线如图所示,反应
的工艺路线如图所示,反应 所得溶液pH在3~4之间,反应
所得溶液pH在3~4之间,反应 需及时补加
需及时补加 以保持反应在
以保持反应在 条件下进行。常温下,
条件下进行。常温下, 的电离平衡常数
的电离平衡常数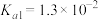 ,
,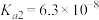 。下列说法正确的是
。下列说法正确的是
 的工艺路线如图所示,反应
的工艺路线如图所示,反应 所得溶液pH在3~4之间,反应
所得溶液pH在3~4之间,反应 需及时补加
需及时补加 以保持反应在
以保持反应在 条件下进行。常温下,
条件下进行。常温下, 的电离平衡常数
的电离平衡常数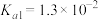 ,
,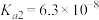 。下列说法正确的是
。下列说法正确的是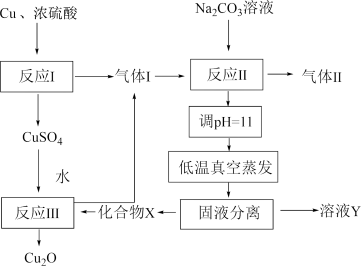
A.反应 、 、 、 、 均为氧化还原反应 均为氧化还原反应 |
B.低温真空蒸发主要目的是防止 被氧化 被氧化 |
C.溶液Y可循环用于反应 所在操作单元吸收气体 所在操作单元吸收气体 |
D.若 产量不变,参与反应 产量不变,参与反应 的X与 的X与 物质的量之比 物质的量之比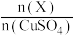 增大时,需补加 增大时,需补加 的量增多 的量增多 |
您最近一年使用:0次
2024-06-10更新
|
100次组卷
|
4卷引用:福建省福州第三中学2023-2024学年高三上学期第五次质量检测化学试题
名校
解题方法
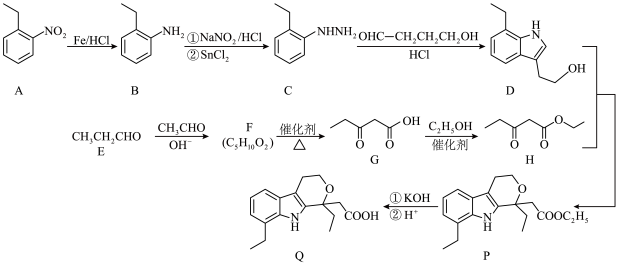
9 . 杂环化合物在药物中广泛存在,依托度酸(etodolac)用于治疗风湿性关节炎、类风湿性关节炎等,具有耐受性好、镇痛作用强等特点,尤其适用于老年患者。以下为其合成路线:
(1)由苯制备物质 ,最好应先引入
,最好应先引入___________ (填“乙基”或“硝基”);物质 中的含氧官能团的名称为
中的含氧官能团的名称为___________ 。
(2) 的系统命名为
的系统命名为___________ ,该物质存在多种同分异构体,其中一定条件下能与 溶液反应的同分异构体有
溶液反应的同分异构体有___________ 种。
(3) 的化学反应方程式为
的化学反应方程式为___________ 。
(4)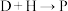 主要经历先
主要经历先___________ 后___________ 两种反应类型, 的另一种产物的结构简式为
的另一种产物的结构简式为___________ 。
(5)在医院里肠杆菌等细菌的鉴定常利用吲哚实验,转换反应式如下: 原子的孤电子对位于
原子的孤电子对位于___________ 轨道;柯氏试剂 化学式为
化学式为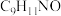 ,该步反应的另一种产物为
,该步反应的另一种产物为 ,则
,则 结构简式为
结构简式为___________ 。

(1)由苯制备物质
 ,最好应先引入
,最好应先引入 中的含氧官能团的名称为
中的含氧官能团的名称为(2)
 的系统命名为
的系统命名为 溶液反应的同分异构体有
溶液反应的同分异构体有(3)
 的化学反应方程式为
的化学反应方程式为(4)
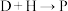 主要经历先
主要经历先 的另一种产物的结构简式为
的另一种产物的结构简式为(5)在医院里肠杆菌等细菌的鉴定常利用吲哚实验,转换反应式如下:
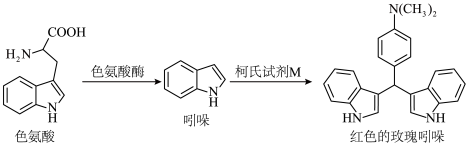
 原子的孤电子对位于
原子的孤电子对位于 化学式为
化学式为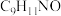 ,该步反应的另一种产物为
,该步反应的另一种产物为 ,则
,则 结构简式为
结构简式为
您最近一年使用:0次
名校
10 . 下列实验操作、现象与结论相匹配的是
选项 | 实验操作 | 现象 | 结论 |
A | 常温,分别测定浓度均为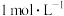 NaCl溶液和CH3COONH4溶液的pH NaCl溶液和CH3COONH4溶液的pH | pH均等于7 | 常温下,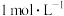 的NaCl溶液和CH3COONH4溶液中水的电离程度相等 的NaCl溶液和CH3COONH4溶液中水的电离程度相等 |
B | 常温,将50 mL苯与50 mL CH3COOH混合 | 混合溶液体积为101 mL | 混合过程中削弱了CH3COOH分子间的氢键,且CH3COOH分子与苯间的作用弱于氢键 |
C | 向Na2SO3和Na2S混合溶液中加入浓硫酸 | 溶液中出现淡黄色沉淀 | +4价和-2价硫可归中为0价 |
D | 取一小块鸡皮于表面皿上,将几滴浓硝酸滴到鸡皮上 | 一段时间后鸡皮变黄 | 鸡皮中含有脂肪 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次