真题
1 . 异山梨醇是一种由生物质制备的高附加值化学品, 时其制备过程及相关物质浓度随时间变化如图所示,
时其制备过程及相关物质浓度随时间变化如图所示,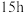 后异山梨醇浓度不再变化。下列说法错误的是
后异山梨醇浓度不再变化。下列说法错误的是
 时其制备过程及相关物质浓度随时间变化如图所示,
时其制备过程及相关物质浓度随时间变化如图所示,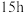 后异山梨醇浓度不再变化。下列说法错误的是
后异山梨醇浓度不再变化。下列说法错误的是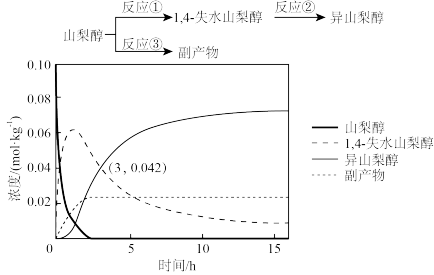
A.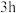 时,反应②正、逆反应速率相等 时,反应②正、逆反应速率相等 |
| B.该温度下的平衡常数:①>② |
C. 平均速率(异山梨醇) 平均速率(异山梨醇)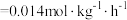 |
| D.反应②加入催化剂不改变其平衡转化率 |
您最近一年使用:0次
真题
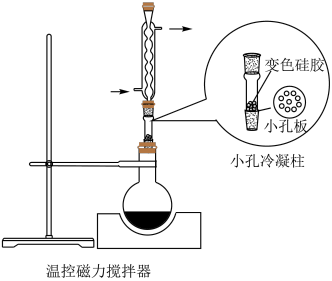
2 . 某实验小组为实现乙酸乙酯的绿色制备及反应过程可视化,设计实验方案如下: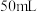 烧瓶中分别加入
烧瓶中分别加入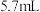 乙酸(
乙酸(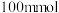 )、
)、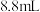 乙醇(
乙醇(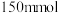 )、
)、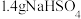 固体及4~6滴
固体及4~6滴 甲基紫的乙醇溶液。向小孔冷凝柱中装入变色硅胶。
甲基紫的乙醇溶液。向小孔冷凝柱中装入变色硅胶。
II.加热回流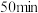 后,反应液由蓝色变为紫色,变色硅胶由蓝色变为粉红色,停止加热。
后,反应液由蓝色变为紫色,变色硅胶由蓝色变为粉红色,停止加热。
III.冷却后,向烧瓶中缓慢加入饱和 溶液至无
溶液至无 逸出,分离出有机相。
逸出,分离出有机相。
IV.洗涤有机相后,加入无水 ,过滤。
,过滤。
V.蒸馏滤液,收集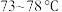 馏分,得无色液体
馏分,得无色液体 ,色谱检测纯度为
,色谱检测纯度为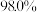 。
。
回答下列问题:
(1) 在反应中起
在反应中起_______ 作用,用其代替浓 的优点是
的优点是_______ (答出一条即可)。
(2)甲基紫和变色硅胶的颜色变化均可指示反应进程。变色硅胶吸水,除指示反应进程外,还可_______ 。
(3)使用小孔冷凝柱承载,而不向反应液中直接加入变色硅胶的优点是_______(填标号)。
(4)下列仪器中,分离有机相和洗涤有机相时均需使用的是_______ (填名称)。_______ (精确至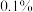 )。
)。
(6)若改用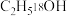 作为反应物进行反应,质谱检测目标产物分子离子峰的质荷比数值应为
作为反应物进行反应,质谱检测目标产物分子离子峰的质荷比数值应为_______ (精确至1)。
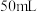 烧瓶中分别加入
烧瓶中分别加入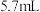 乙酸(
乙酸(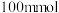 )、
)、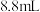 乙醇(
乙醇(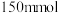 )、
)、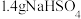 固体及4~6滴
固体及4~6滴 甲基紫的乙醇溶液。向小孔冷凝柱中装入变色硅胶。
甲基紫的乙醇溶液。向小孔冷凝柱中装入变色硅胶。II.加热回流
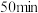 后,反应液由蓝色变为紫色,变色硅胶由蓝色变为粉红色,停止加热。
后,反应液由蓝色变为紫色,变色硅胶由蓝色变为粉红色,停止加热。III.冷却后,向烧瓶中缓慢加入饱和
 溶液至无
溶液至无 逸出,分离出有机相。
逸出,分离出有机相。IV.洗涤有机相后,加入无水
 ,过滤。
,过滤。V.蒸馏滤液,收集
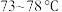 馏分,得无色液体
馏分,得无色液体 ,色谱检测纯度为
,色谱检测纯度为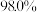 。
。回答下列问题:
(1)
 在反应中起
在反应中起 的优点是
的优点是(2)甲基紫和变色硅胶的颜色变化均可指示反应进程。变色硅胶吸水,除指示反应进程外,还可
(3)使用小孔冷凝柱承载,而不向反应液中直接加入变色硅胶的优点是_______(填标号)。
| A.无需分离 | B.增大该反应平衡常数 |
| C.起到沸石作用,防止暴沸 | D.不影响甲基紫指示反应进程 |
(4)下列仪器中,分离有机相和洗涤有机相时均需使用的是
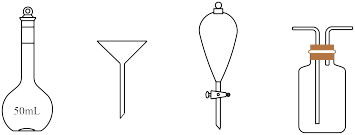
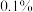 )。
)。(6)若改用
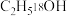 作为反应物进行反应,质谱检测目标产物分子离子峰的质荷比数值应为
作为反应物进行反应,质谱检测目标产物分子离子峰的质荷比数值应为
您最近一年使用:0次
名校
解题方法
3 . 钪(Sc)是一种稀土金属元素,在国防、航天,核能等领域具有重要应用。氯化钪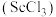 是一种可溶于水的灰白色固体,是制备钪的重要原料。从某工业废料“赤泥”(含有
是一种可溶于水的灰白色固体,是制备钪的重要原料。从某工业废料“赤泥”(含有 、
、 、
、 、
、 、
、 等)中回收
等)中回收 的工艺流程如下:
的工艺流程如下: 难溶于盐酸。
难溶于盐酸。
②常温下,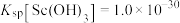 ,
, 。
。
回答下列问题:
(1)某次实验中需要使用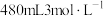 的盐酸,用浓盐酸(密度为
的盐酸,用浓盐酸(密度为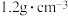 ,质量分数为
,质量分数为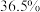 )配制实验所需要的盐酸,则需要量取浓盐酸的体积为
)配制实验所需要的盐酸,则需要量取浓盐酸的体积为___________  。
。
(2)滤渣1的主要成分是___________ (填化学式)。“酸浸”时温度过高,酸浸速率反而减慢,其原因是___________ 。
(3)常温下,“调 ”时,溶液中
”时,溶液中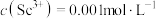 ,为除去杂质离子,应控制的
,为除去杂质离子,应控制的 范围是
范围是___________ (当溶液中某离子浓度c≤1.0×10-5mol/L时,可认为该离子沉淀完全)。
(4)“氧化”时反应的离子方程式为___________ 。
(5)实验室模拟流程中“灼烧”得到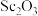 ,用来盛放被灼烧物的仪器为
,用来盛放被灼烧物的仪器为___________ ,“加热氯化”步骤中所加入焦炭过量,写出由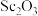 制备三氯化钪反应的化学方程式:
制备三氯化钪反应的化学方程式:___________ 。
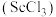 是一种可溶于水的灰白色固体,是制备钪的重要原料。从某工业废料“赤泥”(含有
是一种可溶于水的灰白色固体,是制备钪的重要原料。从某工业废料“赤泥”(含有 、
、 、
、 、
、 、
、 等)中回收
等)中回收 的工艺流程如下:
的工艺流程如下:
 难溶于盐酸。
难溶于盐酸。②常温下,
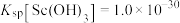 ,
, 。
。回答下列问题:
(1)某次实验中需要使用
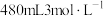 的盐酸,用浓盐酸(密度为
的盐酸,用浓盐酸(密度为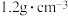 ,质量分数为
,质量分数为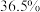 )配制实验所需要的盐酸,则需要量取浓盐酸的体积为
)配制实验所需要的盐酸,则需要量取浓盐酸的体积为 。
。(2)滤渣1的主要成分是
(3)常温下,“调
 ”时,溶液中
”时,溶液中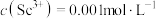 ,为除去杂质离子,应控制的
,为除去杂质离子,应控制的 范围是
范围是(4)“氧化”时反应的离子方程式为
(5)实验室模拟流程中“灼烧”得到
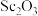 ,用来盛放被灼烧物的仪器为
,用来盛放被灼烧物的仪器为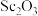 制备三氯化钪反应的化学方程式:
制备三氯化钪反应的化学方程式:
您最近一年使用:0次
4 . 随着大气中 浓度增大带来了一系列环境问题,“负碳”技术开始备受各国关注,所谓“负碳”技术就是将
浓度增大带来了一系列环境问题,“负碳”技术开始备受各国关注,所谓“负碳”技术就是将 转化成甲醇、甲酸等可利用的资源的一系列技术。回答下列问题:
转化成甲醇、甲酸等可利用的资源的一系列技术。回答下列问题:
I. 催化加氢制甲醇
催化加氢制甲醇
以 、
、 为原料合成
为原料合成 涉及的反应如下:
涉及的反应如下:
反应i:
 ;
;
反应ii:
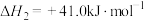 ;
;
反应iii:
 。
。
(1)反应i的
___________ 。
(2)一定温度和催化剂条件下,0.73mol 、0.24mol
、0.24mol 和0.03mol
和0.03mol (已知
(已知 不参与反应)在密闭容器中进行上述反应,平衡时
不参与反应)在密闭容器中进行上述反应,平衡时 的转化率、
的转化率、 和CO的选择性随温度的变化曲线如图。
和CO的选择性随温度的变化曲线如图。___________ (填“ ”“
”“ ”或“CO”)的变化。
”或“CO”)的变化。
②上述反应体系在一定条件下建立平衡后,下列说法错误的有___________ (填字母)。
A.降低温度,反应i~iii的正、逆反应速率都减小
B.恒压条件下,向容器中再通入少量 ,
, 的平衡转化率下降
的平衡转化率下降
C.移去部分 ,反应iii平衡不移动
,反应iii平衡不移动
D.选择合适的催化剂能减小反应iii的焓变
③某温度下(大于180℃), min反应到达平衡,测得容器中
min反应到达平衡,测得容器中 的体积分数为12.5%,容器内气体总压强为8.0MPa.此时用
的体积分数为12.5%,容器内气体总压强为8.0MPa.此时用 的分压表示
的分压表示 时间内的反应速率
时间内的反应速率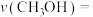
___________  ,此时
,此时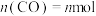 ,不发生反应iii,计算该温度下反应ii的压强平衡常数
,不发生反应iii,计算该温度下反应ii的压强平衡常数
___________ (用含有n的代数式表示,分压=总压×该组分物质的量分数)。
(3)科学家发现了一类金属卤化物钙钛矿材料有着出众的光电性质,有望在“负碳”技术上大放异彩,如图是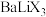 晶胞结构,晶胞参数为:apm,
晶胞结构,晶胞参数为:apm, 与
与 之间最短距离为
之间最短距离为___________ pm,若卤素X中 与
与 的比例为
的比例为 ,晶体密度为
,晶体密度为___________  (
( 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
 浓度增大带来了一系列环境问题,“负碳”技术开始备受各国关注,所谓“负碳”技术就是将
浓度增大带来了一系列环境问题,“负碳”技术开始备受各国关注,所谓“负碳”技术就是将 转化成甲醇、甲酸等可利用的资源的一系列技术。回答下列问题:
转化成甲醇、甲酸等可利用的资源的一系列技术。回答下列问题:I.
 催化加氢制甲醇
催化加氢制甲醇以
 、
、 为原料合成
为原料合成 涉及的反应如下:
涉及的反应如下:反应i:

 ;
;反应ii:

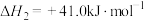 ;
;反应iii:

 。
。(1)反应i的

(2)一定温度和催化剂条件下,0.73mol
 、0.24mol
、0.24mol 和0.03mol
和0.03mol (已知
(已知 不参与反应)在密闭容器中进行上述反应,平衡时
不参与反应)在密闭容器中进行上述反应,平衡时 的转化率、
的转化率、 和CO的选择性随温度的变化曲线如图。
和CO的选择性随温度的变化曲线如图。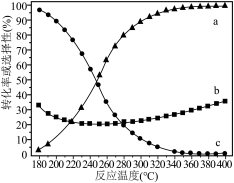
 ”“
”“ ”或“CO”)的变化。
”或“CO”)的变化。②上述反应体系在一定条件下建立平衡后,下列说法错误的有
A.降低温度,反应i~iii的正、逆反应速率都减小
B.恒压条件下,向容器中再通入少量
 ,
, 的平衡转化率下降
的平衡转化率下降C.移去部分
 ,反应iii平衡不移动
,反应iii平衡不移动D.选择合适的催化剂能减小反应iii的焓变
③某温度下(大于180℃),
 min反应到达平衡,测得容器中
min反应到达平衡,测得容器中 的体积分数为12.5%,容器内气体总压强为8.0MPa.此时用
的体积分数为12.5%,容器内气体总压强为8.0MPa.此时用 的分压表示
的分压表示 时间内的反应速率
时间内的反应速率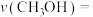
 ,此时
,此时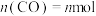 ,不发生反应iii,计算该温度下反应ii的压强平衡常数
,不发生反应iii,计算该温度下反应ii的压强平衡常数
(3)科学家发现了一类金属卤化物钙钛矿材料有着出众的光电性质,有望在“负碳”技术上大放异彩,如图是
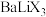 晶胞结构,晶胞参数为:apm,
晶胞结构,晶胞参数为:apm, 与
与 之间最短距离为
之间最短距离为 与
与 的比例为
的比例为 ,晶体密度为
,晶体密度为 (
( 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
您最近一年使用:0次
名校
5 .  不仅是一种温室气体,也是一种来源广泛且廉价易得的碳资源,可通过热化学、电化学等方法再利用。
不仅是一种温室气体,也是一种来源广泛且廉价易得的碳资源,可通过热化学、电化学等方法再利用。
(Ⅰ)科学家通过如下反应利用 合成甲醇:
合成甲醇:
已知: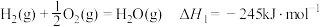
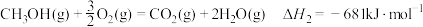
回答下列问题:
(1)计算上述合成甲醇反应的焓变
___________  。
。
(2)科学研究中常用产物的时空收率(单位物质的量催化剂表面产物分子的平均生成速率)来衡量催化效果,在3MPa, 时,不同Ni、Ga配比的
时,不同Ni、Ga配比的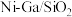 催化剂下,测定甲醇时空收率随温度的变化曲线如图所示,甲醇时空收率随温度变化先增大后减小的原因是
催化剂下,测定甲醇时空收率随温度的变化曲线如图所示,甲醇时空收率随温度变化先增大后减小的原因是___________ 。催化剂的最佳配比和反应温度是___________ 。 和
和 充入恒温恒容密闭容器中反应合成甲醇,已知该温度下反应的化学平衡常数
充入恒温恒容密闭容器中反应合成甲醇,已知该温度下反应的化学平衡常数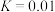 ,下列事实说明该反应已达平衡的是___________。
,下列事实说明该反应已达平衡的是___________。
(Ⅱ)甲烷干重整反应可以将两类重要的温室气体和 进行重整,涉及主要反应如下:
进行重整,涉及主要反应如下:
反应I: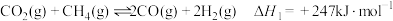
反应Ⅱ: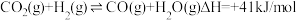
(4)恒温恒容 密闭容器中,按
密闭容器中,按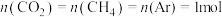 投料,初始总压
投料,初始总压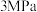 ,达到平衡状态时测得
,达到平衡状态时测得 转化率为
转化率为 ,平衡总压为
,平衡总压为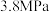 。计算该温度下反应Ⅰ的浓度平衡常数
。计算该温度下反应Ⅰ的浓度平衡常数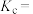
___________ 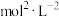 。
。
(5)某研究小组为了评估甲烷干重整反应中不同催化剂的性能差异,在常压、催化剂作用下,按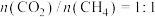 投料,不同温度下反应相同时间,测得
投料,不同温度下反应相同时间,测得 的转化率(柱形图)和产物
的转化率(柱形图)和产物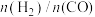 (
( )如图所示。请分析产物
)如图所示。请分析产物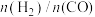 随温度变化的原因(不考虑催化剂失活)
随温度变化的原因(不考虑催化剂失活)___________ 。
 不仅是一种温室气体,也是一种来源广泛且廉价易得的碳资源,可通过热化学、电化学等方法再利用。
不仅是一种温室气体,也是一种来源广泛且廉价易得的碳资源,可通过热化学、电化学等方法再利用。(Ⅰ)科学家通过如下反应利用
 合成甲醇:
合成甲醇:
已知:
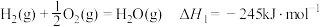
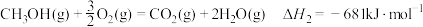
回答下列问题:
(1)计算上述合成甲醇反应的焓变

 。
。(2)科学研究中常用产物的时空收率(单位物质的量催化剂表面产物分子的平均生成速率)来衡量催化效果,在3MPa,
 时,不同Ni、Ga配比的
时,不同Ni、Ga配比的 催化剂下,测定甲醇时空收率随温度的变化曲线如图所示,甲醇时空收率随温度变化先增大后减小的原因是
催化剂下,测定甲醇时空收率随温度的变化曲线如图所示,甲醇时空收率随温度变化先增大后减小的原因是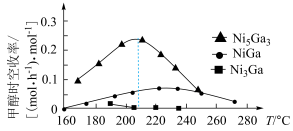
 和
和 充入恒温恒容密闭容器中反应合成甲醇,已知该温度下反应的化学平衡常数
充入恒温恒容密闭容器中反应合成甲醇,已知该温度下反应的化学平衡常数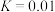 ,下列事实说明该反应已达平衡的是___________。
,下列事实说明该反应已达平衡的是___________。| A.气体密度保持不变 |
B. 与 与 的生成速率相等 的生成速率相等 |
C.某时刻容器中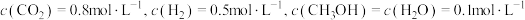 |
| D.混合气体的平均相对分子质量不变 |
(Ⅱ)甲烷干重整反应可以将两类重要的温室气体和
 进行重整,涉及主要反应如下:
进行重整,涉及主要反应如下:反应I:
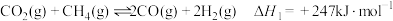
反应Ⅱ:
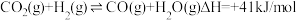
(4)恒温恒容
 密闭容器中,按
密闭容器中,按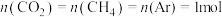 投料,初始总压
投料,初始总压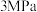 ,达到平衡状态时测得
,达到平衡状态时测得 转化率为
转化率为 ,平衡总压为
,平衡总压为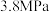 。计算该温度下反应Ⅰ的浓度平衡常数
。计算该温度下反应Ⅰ的浓度平衡常数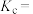
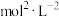 。
。(5)某研究小组为了评估甲烷干重整反应中不同催化剂的性能差异,在常压、催化剂作用下,按
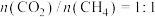 投料,不同温度下反应相同时间,测得
投料,不同温度下反应相同时间,测得 的转化率(柱形图)和产物
的转化率(柱形图)和产物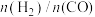 (
( )如图所示。请分析产物
)如图所示。请分析产物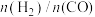 随温度变化的原因(不考虑催化剂失活)
随温度变化的原因(不考虑催化剂失活)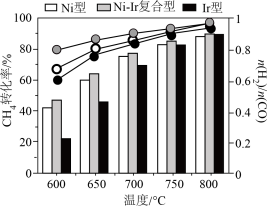
您最近一年使用:0次
名校
6 . 25℃时,某混合溶液中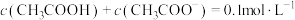 ,
,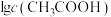 、
、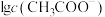 、
、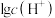 和
和 随
随 变化的关系如下图所示。
变化的关系如下图所示。 为
为 的电离常数,下列说法正确的是
的电离常数,下列说法正确的是
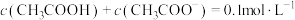 ,
,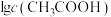 、
、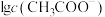 、
、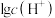 和
和 随
随 变化的关系如下图所示。
变化的关系如下图所示。 为
为 的电离常数,下列说法正确的是
的电离常数,下列说法正确的是
A.由曲线交点 可知, 可知, 的 的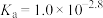 |
B. 点溶液中水的电离程度小于 点溶液中水的电离程度小于 点 点 |
C.该体系中,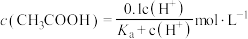 |
D. 点时, 点时,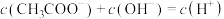 |
您最近一年使用:0次
解题方法
7 . SnO2是锡的重要氧化物,现以锡锑渣(主要含塑料及SnO2、Sb4O6、PbO2)为原料,提纯SnO2的工艺流程图如下:
②Na2SnO3可溶于水,难溶于乙醇。
请回答下列问题:
(1)“焙烧”的主要目的是_______ 。
(2)“沉铅”时同时生成S沉淀的化学方程式_______ 。
(3)“还原”时Na3SbO4发生的离子方程式为_______ 。
(4)在不同溶剂中Na2SnO3的溶解度随温度变化如图。_______ 。
②由Na2SnO3溶液可获得Na2SnO3晶体,具体操作方法为_______ 、用_______ 洗涤、干燥。
(5)下列冶炼方法与本工艺流程中加入焦炭冶炼锡的方法相似的是_______。
(6)将10kg锡锑渣进行碱浸,“还原”时消耗0. 13kg锡粒,假设其余各步损失不计,干燥后称量锡酸钠质量为4. 0kg,滴定测得锡酸钠中锡的质量分数为53. 5%。锡锑渣中锡元素的质量分数为_______ 。

②Na2SnO3可溶于水,难溶于乙醇。
请回答下列问题:
(1)“焙烧”的主要目的是
(2)“沉铅”时同时生成S沉淀的化学方程式
(3)“还原”时Na3SbO4发生的离子方程式为
(4)在不同溶剂中Na2SnO3的溶解度随温度变化如图。
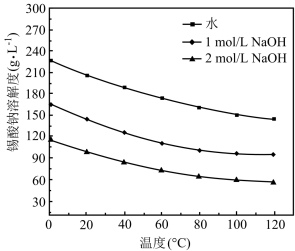
②由Na2SnO3溶液可获得Na2SnO3晶体,具体操作方法为
(5)下列冶炼方法与本工艺流程中加入焦炭冶炼锡的方法相似的是_______。
| A.工业制粗硅 | B.电解熔融氯化钠制钠 |
| C.氧化汞分解制汞 | D.工业炼铁 |
(6)将10kg锡锑渣进行碱浸,“还原”时消耗0. 13kg锡粒,假设其余各步损失不计,干燥后称量锡酸钠质量为4. 0kg,滴定测得锡酸钠中锡的质量分数为53. 5%。锡锑渣中锡元素的质量分数为
您最近一年使用:0次
解题方法
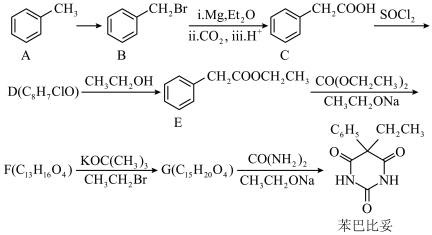
8 . 苯巴比妥是一种巴比妥类的镇静剂及安眠药,合成路线如下(部分试剂和产物已略去):
(1)A →B的反应条件和试剂名称为_______ 。
(2)B→C过程分为三步,第一步生成格氏试剂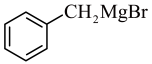 ,第二步与CO2发生加成反应,反应产物的结构简式为
,第二步与CO2发生加成反应,反应产物的结构简式为 _______ ,第三步的反应类型为 _______ 。
(3)F的结构简式为_______ 。
(4)G转变为苯巴比妥的化学方程式为_______ 。
(5)在E的同分异构体中,同时满足下列条件的共有_______ 种(不考虑立体异构);
①能与氢氧化钠溶液反应;②含有三个甲基;③含有苯环;④遇FeCl3溶液不显色
其中,核磁共振氢谱显示为4组峰,且峰面积比为6:3:2:2:1的同分异构体的结构简式_______ (只写出其中一种结构简式即可)。
已知:i. 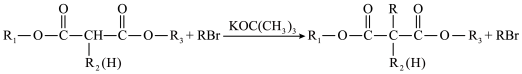
ii. 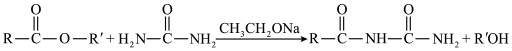
(1)A →B的反应条件和试剂名称为
(2)B→C过程分为三步,第一步生成格氏试剂
 ,第二步与CO2发生加成反应,反应产物的结构简式为
,第二步与CO2发生加成反应,反应产物的结构简式为 (3)F的结构简式为
(4)G转变为苯巴比妥的化学方程式为
(5)在E的同分异构体中,同时满足下列条件的共有
①能与氢氧化钠溶液反应;②含有三个甲基;③含有苯环;④遇FeCl3溶液不显色
其中,核磁共振氢谱显示为4组峰,且峰面积比为6:3:2:2:1的同分异构体的结构简式
您最近一年使用:0次
解题方法
9 . 除少数卤化物外,大部分非金属卤化物都易水解,且反应不可逆。卤化物的水解机理分亲核水解和亲电水解。发生亲核水解的结构条件:中心原子具有 δ+ 和有空的价轨道。发生亲电水解的结构条件:中心原子有孤对电子,可作 Lewis 碱,接受 H2O 的 H+ 进攻。NCl3和SiCl4均可发生水解反应,其中NCl3的水解机理示意图如下:
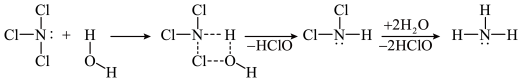
| A.NCl3和SiCl4的水解反应机理相同 | B.PCl3的水解产物为H3PO4 |
| C.由上述理论可知NF3不能发生水解 | D.CCl4的水解历程与SiCl4相似 |
您最近一年使用:0次
名校
解题方法
10 . 肉桂酸广泛应用于香精香料、食品添加剂、医药工业、美容和有机合成等方面。其合成原理及实验室制备方法如下:
i.在50mL仪器a中加入5mL苯甲醛、14mL乙酸酐和12g无水碳酸钾粉末(过量),加热回流45min。
ii.向反应混合物中加入40mL蒸馏水浸泡几分钟,进行水蒸气蒸馏。
iii.将烧瓶冷却后,加入10g碳酸钠,再加入70mL水,加热煮沸,趁热过滤。
iV.待滤液冷却至室温后,在搅拌下小心加入40mL 盐酸,使溶液呈酸性。
盐酸,使溶液呈酸性。
V.冷却结晶,抽滤,用少量试剂b洗涤,80℃烘干,得粗产品4.5g。
回答下列问题:
(1)仪器使用前必须干燥,原因是___________ 。
(2)加热回流装置中仪器a的名称是___________ ,不使用水冷冷凝管而用空气冷凝管是为了___________ 。
(3)整个实验过程中温度不宜超过180℃,原因是___________ 。
(4)水蒸气蒸馏装置中止水夹的主要作用是___________ 。
(5)步骤V中试剂b是___________ 。
(6)本实验肉桂酸的产率最接近___________ (填标号)。若产物不纯,则提纯产物的方法为___________ 。
A.50% B.60% C.70% D.80%
主反应:
温度较高时发生副反应: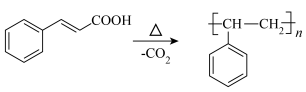
i.在50mL仪器a中加入5mL苯甲醛、14mL乙酸酐和12g无水碳酸钾粉末(过量),加热回流45min。
ii.向反应混合物中加入40mL蒸馏水浸泡几分钟,进行水蒸气蒸馏。
iii.将烧瓶冷却后,加入10g碳酸钠,再加入70mL水,加热煮沸,趁热过滤。
iV.待滤液冷却至室温后,在搅拌下小心加入40mL
 盐酸,使溶液呈酸性。
盐酸,使溶液呈酸性。V.冷却结晶,抽滤,用少量试剂b洗涤,80℃烘干,得粗产品4.5g。

| 名称 | 相对分子质量 | 密度/ | 熔点/℃ | 沸点/℃ | 溶解度:g/100mL | ||
| 水 | 醇 | 醚 | |||||
| 苯甲醛 | 106 | 1.04 | -26 | 178~179 | 0.3 | 互溶 | 互溶 |
| 乙酸酐 | 102 | 1.08 | -79 | 138~140 | 遇水生成乙酸 | 溶 | 不溶 |
| 肉桂 | 148 | 1.24 | 133~134 | 300 | 0.04 | 24 | 溶 |
(1)仪器使用前必须干燥,原因是
(2)加热回流装置中仪器a的名称是
(3)整个实验过程中温度不宜超过180℃,原因是
(4)水蒸气蒸馏装置中止水夹的主要作用是
(5)步骤V中试剂b是
(6)本实验肉桂酸的产率最接近
A.50% B.60% C.70% D.80%
您最近一年使用:0次



