名校
解题方法
1 . 对于1L HNO3和H2SO4的混合溶液,若c(HNO3)+c(H2SO4)=1.0mol/L,则理论上最多可以溶解铜的物质的量为
| A.1.0mol | B.0.8mol | C.0.72mol | D.0.6mol |
您最近一年使用:0次
名校
2 . 下列由实验得出的结论不正确的是
| 实验 | 结论 | |
| A | 将乙烯通入溴的四氯化碳溶液,溶液最终变为无色透明 | 生成的1,2-二溴乙烷无色、可溶于四氯化碳 |
| B | 乙醇和水都可与金属钠反应产生可燃性气体 | 乙醇分子中的氢与水分子中的氢具有相同的活性 |
| C | 用乙酸浸泡水壶中的水垢,可将其清除 | 乙酸的酸性大于碳酸的酸性 |
| D | 甲烷与氯气在光源下反应后的混合气体能使湿润的石蕊试纸变红 | 生成的氯化氢具有酸性 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
解题方法
3 . 除去废水中的含氮化合物一直是环保领域的热点问题。短程硝化-厌氧氨氧化工艺的目的是将氨氮( )废水中的氮元素转变为 N2脱除,其机理如下:
)废水中的氮元素转变为 N2脱除,其机理如下: 会被氧化成
会被氧化成 。
。
(1)该工艺中被氧化的微粒是___________ 。
(2)参与Ⅰ中反应的 n( ):n(O2) =
):n(O2) =_____ 。
(3)废水溶解氧浓度(DO)对氮的脱除率的影响如图所示。当 DO > 2mg/L 时,氮的脱除率为0,其原因可能是厌氧氨氧化菌被抑制,II 中反应无法发生;还有可能是___________ 。 /
/ 采用微生物电解工艺也可有效除去
采用微生物电解工艺也可有效除去 /
/ ,其原理如下图所示。A 是电源
,其原理如下图所示。A 是电源___________ 极。结合电极反应式解释该工艺能提高氮的脱除率的原因:___________ 。________ 。
 )废水中的氮元素转变为 N2脱除,其机理如下:
)废水中的氮元素转变为 N2脱除,其机理如下:
 会被氧化成
会被氧化成 。
。(1)该工艺中被氧化的微粒是
(2)参与Ⅰ中反应的 n(
 ):n(O2) =
):n(O2) =(3)废水溶解氧浓度(DO)对氮的脱除率的影响如图所示。当 DO > 2mg/L 时,氮的脱除率为0,其原因可能是厌氧氨氧化菌被抑制,II 中反应无法发生;还有可能是

 /
/ 采用微生物电解工艺也可有效除去
采用微生物电解工艺也可有效除去 /
/ ,其原理如下图所示。A 是电源
,其原理如下图所示。A 是电源
您最近一年使用:0次
名校
4 . 完成下列问题。
Ⅰ.配制 0.50 mol/L NaOH 溶液用于中和热测定。
(1)若实验中大约要使用 245 mL NaOH 溶液, 至少需要称量 NaOH 固体__________ g。
(2)从下图中选择称量 NaOH 固体所需要的仪器(填字母):________ 。
(3)取 50 mL NaOH 溶液和 30 mL 硫酸溶液进行中和热测定实验实验数值结果小于 57.3 kJ/mol,产生偏差的原因可能是(填字母)___________ 。
a.实验装置保温、隔热效果差
b.配制 0.50 mol/L NaOH 溶液时俯视刻度线读数
c.分多次把 NaOH 溶液倒入盛有硫酸的小烧杯中
d.用温度计测定 NaOH 溶液起始温度后直接测定 H2SO4溶液的温度
e.用量筒量取 NaOH 溶液的体积时仰视读数
Ⅱ.铋酸钠(NaBiO3)广泛应用于制药业,其粉末呈浅黄色,不溶于冷水,遇沸水或酸则迅速分解。某同学设计如下实验,利用白色且难溶于水的 Bi(OH)3在 NaOH 溶液中与 Cl2反应制备 NaBiO3, 并探究其应用,请按要求回答下列问题:
NaBiO3的制备,实验装置如下图(加热和夹持仪器已略去)
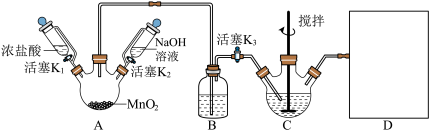
(4)A装置制备的气体是___________ ;B 装置的作用是___________ ;补全上图 D装置图___________ (并标注试剂名称)。
(5)C 中反应的离子方程式为___________ ,当观察到现象为___________ 时,可以初步判断 C 中反应已经完成。
(6)反应完成后,处理装置 A 烧瓶中残留气体需进行的操作:___________ ;为从装置 C中获得尽可能多的产品,需进行的操作:___________ 、过滤、洗涤、干燥。
(7)铋酸钠的应用,检测 Mn2+。向含有 Mn2+的溶液中加入铋酸钠,再加入硫酸酸化,溶液变为紫红色,此反应中铋酸钠的作用是___________ 。
Ⅰ.配制 0.50 mol/L NaOH 溶液用于中和热测定。
(1)若实验中大约要使用 245 mL NaOH 溶液, 至少需要称量 NaOH 固体
(2)从下图中选择称量 NaOH 固体所需要的仪器(填字母):
| 名称 | 托盘天平(带砝码) | 小烧杯 | 坩埚钳 | 玻璃棒 | 药匙 | 量筒 |
| 仪器 | 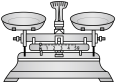 | 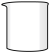 |  |  |  |  |
| 序号 | a | b | c | d | e | f |
a.实验装置保温、隔热效果差
b.配制 0.50 mol/L NaOH 溶液时俯视刻度线读数
c.分多次把 NaOH 溶液倒入盛有硫酸的小烧杯中
d.用温度计测定 NaOH 溶液起始温度后直接测定 H2SO4溶液的温度
e.用量筒量取 NaOH 溶液的体积时仰视读数
Ⅱ.铋酸钠(NaBiO3)广泛应用于制药业,其粉末呈浅黄色,不溶于冷水,遇沸水或酸则迅速分解。某同学设计如下实验,利用白色且难溶于水的 Bi(OH)3在 NaOH 溶液中与 Cl2反应制备 NaBiO3, 并探究其应用,请按要求回答下列问题:
NaBiO3的制备,实验装置如下图(加热和夹持仪器已略去)

(4)A装置制备的气体是
(5)C 中反应的离子方程式为
(6)反应完成后,处理装置 A 烧瓶中残留气体需进行的操作:
(7)铋酸钠的应用,检测 Mn2+。向含有 Mn2+的溶液中加入铋酸钠,再加入硫酸酸化,溶液变为紫红色,此反应中铋酸钠的作用是
您最近一年使用:0次
解题方法
5 . 电解质溶液中存在着多种平衡,请回答下列问题:
(1)常温下,相同pH的氢氧化钠和醋酸钠溶液分别加水稀释,pH随溶液体积变化的曲线如图所示。
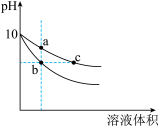
①b、c两点溶液的导电能力比较:b_______ c(填“<”“>”或“=”)
②a、b、c三点溶液中水的电离程度由大到小的顺序:_______ 。
(2)AgCl能溶于氨水,发生反应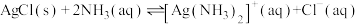 ,其平衡常数
,其平衡常数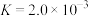 ,现用1L某浓度氨水(溶质视为NH3)完全溶解0.1molAgCl,所需氨水浓度至少为
,现用1L某浓度氨水(溶质视为NH3)完全溶解0.1molAgCl,所需氨水浓度至少为_______ mol/L(已知 =2.24)。
=2.24)。
(3)25℃时,有如下两个反应:
①CH3COOH+NaCN=CH3COONa+HCN
②HNO2+CH3COONa=NaNO2+CH3COOH
该温度下CH3COOH、HCN和HNO2三种弱酸的电离常数由大到小的顺序是:_______ 。
(4)25℃时,0.1mol/L的CH3COOH溶液加适量水稀释的过程中,下列表达式的数值保持不变的是_______ 。
a.c(H+) b.c(H+)•c(OH-) c. d.
d.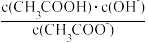
(5)已知铷(Rb)是制造光电管的材料,它与锂同主族。常温下,将amolCH3COORb固体溶于水配成溶液,向该溶液中滴加bLcmol/L醋酸溶液后,溶液呈中性,则c=_______ (用含a、b的式子表示;已知常温下,CH3COOH电离平衡常数Ka=1.75×10-5)。
(1)常温下,相同pH的氢氧化钠和醋酸钠溶液分别加水稀释,pH随溶液体积变化的曲线如图所示。

①b、c两点溶液的导电能力比较:b
②a、b、c三点溶液中水的电离程度由大到小的顺序:
(2)AgCl能溶于氨水,发生反应
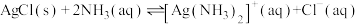 ,其平衡常数
,其平衡常数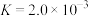 ,现用1L某浓度氨水(溶质视为NH3)完全溶解0.1molAgCl,所需氨水浓度至少为
,现用1L某浓度氨水(溶质视为NH3)完全溶解0.1molAgCl,所需氨水浓度至少为 =2.24)。
=2.24)。(3)25℃时,有如下两个反应:
①CH3COOH+NaCN=CH3COONa+HCN
②HNO2+CH3COONa=NaNO2+CH3COOH
该温度下CH3COOH、HCN和HNO2三种弱酸的电离常数由大到小的顺序是:
(4)25℃时,0.1mol/L的CH3COOH溶液加适量水稀释的过程中,下列表达式的数值保持不变的是
a.c(H+) b.c(H+)•c(OH-) c.
 d.
d.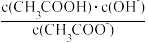
(5)已知铷(Rb)是制造光电管的材料,它与锂同主族。常温下,将amolCH3COORb固体溶于水配成溶液,向该溶液中滴加bLcmol/L醋酸溶液后,溶液呈中性,则c=
您最近一年使用:0次
名校
解题方法
6 . 已知MgO、MgCl2的熔点分别为2800 ℃、714 ℃,将MgO、MgCl2加热熔融后通电电解,都可得到金属镁。海水中含有MgCl2,工业上从海水中提取镁,正确的方法是
A.海水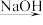 Mg(OH)2 Mg(OH)2 Mg Mg |
B.海水 MgCl2溶液 MgCl2溶液 MgCl2(熔融) MgCl2(熔融)  Mg Mg |
C.海水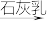 Mg(OH)2 Mg(OH)2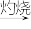 MgO MgO Mg Mg |
D.海水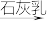 Mg(OH)2 Mg(OH)2 MgCl2溶液 MgCl2溶液 MgCl2(熔融) MgCl2(熔融) Mg Mg |
您最近一年使用:0次
2022-12-02更新
|
434次组卷
|
5卷引用:天津市实验中学滨海学校黄南民族班2021-2022学年高三上学期期中质量监测化学试题
天津市实验中学滨海学校黄南民族班2021-2022学年高三上学期期中质量监测化学试题(已下线)8.1.2 海水资源的开发利用(能力提升)-2020-2021学年高一化学新教材新理念新设计同步课堂(人教2019必修第二册)四川省成都市蒲江县蒲江中学2020-2021学年高二上学期开学考试化学试题课中-8.1.1 金属矿物 海水资源的开发利用-人教2019必修第二册黑龙江省勃利县高级中学2022-2023学年高一下学期5月月考化学试题
名校
解题方法
7 . 以CO和 为原料合成甲醇是工业上的成熟方法,直接以
为原料合成甲醇是工业上的成熟方法,直接以 为原料生产甲醇是目前的研究热点。我国科学家用
为原料生产甲醇是目前的研究热点。我国科学家用 人工合成淀粉时,第一步就需要将
人工合成淀粉时,第一步就需要将 转化为甲醇。
转化为甲醇。
已知:①
 kJ·mol
kJ·mol
②
 kJ·mol
kJ·mol
③
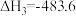 kJ·mol
kJ·mol
下列说法不正确 的是
 为原料合成甲醇是工业上的成熟方法,直接以
为原料合成甲醇是工业上的成熟方法,直接以 为原料生产甲醇是目前的研究热点。我国科学家用
为原料生产甲醇是目前的研究热点。我国科学家用 人工合成淀粉时,第一步就需要将
人工合成淀粉时,第一步就需要将 转化为甲醇。
转化为甲醇。已知:①

 kJ·mol
kJ·mol
②

 kJ·mol
kJ·mol
③

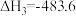 kJ·mol
kJ·mol
下列说法
A.若温度不变,反应①中生成1 mol  时,放出的热量大于90.5 kJ 时,放出的热量大于90.5 kJ |
B. 与 与 合成甲醇的热化学方程式为: 合成甲醇的热化学方程式为:  kJ·mol kJ·mol |
C.通过电解制 和选用高效催化剂,可降低 和选用高效催化剂,可降低 与 与 合成甲醇反应的焓变 合成甲醇反应的焓变 |
D.以 和 和 为原料合成甲醇,同时生成 为原料合成甲醇,同时生成 ,该反应需要吸收能量 ,该反应需要吸收能量 |
您最近一年使用:0次
2022-11-27更新
|
953次组卷
|
7卷引用:天津市静海区第一中学2021-2022学年高三上学期12月调研考试化学试题
天津市静海区第一中学2021-2022学年高三上学期12月调研考试化学试题北京市海淀区2021-2022学年高三上学期期中考试化学试题北京市第二十二中学2021-2022学年高三上学期12月阶段性测试理科化学试题北京市东城区一六六中学2022-2023学年高三上学期期中考试化学试题(已下线)2023年北京卷高考真题变式题(选择题11-14)(已下线)考点17 化学反应的热效应(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)化学反应的热效应
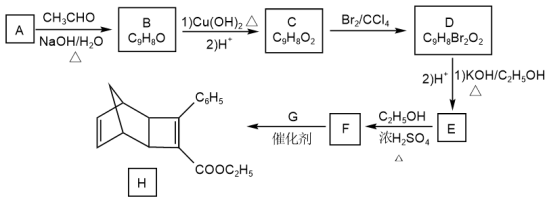
8 . 化合物H是一种有机光电材料中间体。实验由芳香化合物A制备H的一种合的一种合成路线如下:成路线如下:
已知:①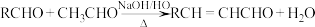
②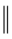 +
+ 

回答下列问题:
(1)A的化学名称是_______ 。
(2)由C生成D和E生成F的反应类型分别是_______ 、_______ 。
(3)E的结构简式为_______ 。
(4)G为甲苯的同分异构体,由F生成H的化学方程式为_______ 。
(5)芳香化合物X是F的同分异构体,X能与饱和碳酸氢钠溶液反应放出 ,其核磁共振氢谱显示有4种不同化学环境的氢,个数比为6︰2︰1︰1,写出2种符合要求的X的结构简式:
,其核磁共振氢谱显示有4种不同化学环境的氢,个数比为6︰2︰1︰1,写出2种符合要求的X的结构简式:_______ 。
(6)写出用环戊烷和2—丁炔为原料制备化合物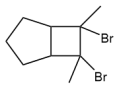 的合成路线。(其他试剂任选)
的合成路线。(其他试剂任选)_______ 。

已知:①
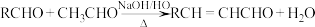
②
 +
+ 

回答下列问题:
(1)A的化学名称是
(2)由C生成D和E生成F的反应类型分别是
(3)E的结构简式为
(4)G为甲苯的同分异构体,由F生成H的化学方程式为
(5)芳香化合物X是F的同分异构体,X能与饱和碳酸氢钠溶液反应放出
 ,其核磁共振氢谱显示有4种不同化学环境的氢,个数比为6︰2︰1︰1,写出2种符合要求的X的结构简式:
,其核磁共振氢谱显示有4种不同化学环境的氢,个数比为6︰2︰1︰1,写出2种符合要求的X的结构简式:(6)写出用环戊烷和2—丁炔为原料制备化合物
 的合成路线。(其他试剂任选)
的合成路线。(其他试剂任选)
您最近一年使用:0次
2022-07-08更新
|
773次组卷
|
35卷引用:天津市第一中学2022届高三第一次月考化学试题
天津市第一中学2022届高三第一次月考化学试题(已下线)一轮巩固卷2-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(天津专用)吉林省实验中学2016-2017学年高二下学期期末考试化学试题甘肃省兰州市第一中学2016-2017学年高二下学期期末考试化学试题2017年全国普通高等学校招生统一考试理综化学(新课标Ⅰ卷精编版)山东省寿光市第一中学2017-2018学年高二12月月考化学试题湖南省长沙市麓山国际实验学校2017-2018学年高二下学期第一次月考化学试题陕西省西安市长安区第一中学2017-2018学年高二下学期期中考试化学试题云南省文山州2018届高三毕业生复习统一检测理综化学试题(已下线)2018年5月20日 每周一测——《每日一题》2017-2018学年高二化学人教选修5(已下线)《考前20天终极攻略》5月31日 有机化学基础(已下线)解密22 有机化学基础(教师版)——备战2018年高考化学之高频考点解密【全国百强校】海南省海南中学2018届高三第五次月考化学试题甘肃省酒泉市敦煌中学2019届高三一诊化学试题高二人教版选修5 第三章 烃的含氧衍生物 月考测评卷(三)(已下线)2019年5月5日 《每日一题》选修5-每周一测2020届高三化学二轮冲刺新题专练——有机化学基础选做题第三章 烃的含氧衍生物——C 挑战区 模拟高考(人教版选修5)广东省梅州市五华县2018-2019学年高二上学期第三次质量监测化学试题广东省深圳中学2020届高三4月份教学质量监测理综化学试题2020届四川省成都市第七中学高三二月份网络教学质量监测卷化学试题2020届浙江省杭州学军中学高三教学质量监测卷化学试题河北省衡水中学2020届高三下学期二月份网络教学质量监测理科综合化学试题广东省佛山市三水区三水中学2019-2020学年高二下学期第二次统考化学试题(已下线)第33讲 有机推断与合成-2021年高考化学一轮复习名师精讲练广西钦州市第一中学2021届高三8月月考理科综合化学试题江苏省镇江市大港中学2020-2021学年度高二上学期10月学情检测化学试题江苏省扬州中学2020-2021学年高二上学期12月月考化学试题西藏自治区林芝市第二高级中学2021届高三上学期第二次月考理综化学试题上海市曹杨第二中学2021-2022学年高二下学期期末考试化学试题内蒙古包头市2022-2023学年高三上学期开学调研考试化学试题北京市中国人民大学附属中学2017-2018学年高三上学期统练化学试题河南省南阳市镇平县第一高级中学2022-2023学年高二下学期5月月考化学试题(已下线)第37讲有机合成及推断(已下线)考点5 有机合成及推断(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)
名校
9 . 化合物H是一种合成药物中间体,一种合成化合物H的人工合成路线如下:

(1)B的化学名称为___________ ,G中不含N原子的官能团的名称为___________ ,H的分子式为___________ 。
(2) 的过程经历两步反应。反应类型依次为加成反应、
的过程经历两步反应。反应类型依次为加成反应、___________ 。
(3) 的化学方程式为
的化学方程式为___________ 。
(4) 的所需的化学试剂及反应条件为
的所需的化学试剂及反应条件为___________ 。
(5)F与足量稀盐酸反应,所得生成物的结构简式为___________ 。
(6)E满足下列条件的同分异构体有___________ 种。
①苯环上有两个对位的取代基,其中一个取代基为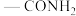
②能使溴水褪色
写出其中分子含有5种不同化学环境的氢原子的结构简式:___________ 。
(7)写出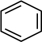 和2-丙醇(
和2-丙醇(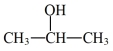 )为原料制备
)为原料制备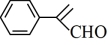 的合成路线流程图。(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)
的合成路线流程图。(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)___________

(1)B的化学名称为
(2)
 的过程经历两步反应。反应类型依次为加成反应、
的过程经历两步反应。反应类型依次为加成反应、(3)
 的化学方程式为
的化学方程式为(4)
 的所需的化学试剂及反应条件为
的所需的化学试剂及反应条件为(5)F与足量稀盐酸反应,所得生成物的结构简式为
(6)E满足下列条件的同分异构体有
①苯环上有两个对位的取代基,其中一个取代基为
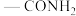
②能使溴水褪色
写出其中分子含有5种不同化学环境的氢原子的结构简式:
(7)写出
 和2-丙醇(
和2-丙醇( )为原料制备
)为原料制备 的合成路线流程图。(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)
的合成路线流程图。(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)
您最近一年使用:0次
2022-05-30更新
|
350次组卷
|
2卷引用:天津市静海区第一中学2020-2021学年高三下学期第三次模拟考试化学试题
10 . 氢气作为清洁能源有着广泛的应用前景,请回答下列问题:
Ⅰ.转化脱硫:将天然气压入吸收塔,30 ℃时,在T.F菌作用下,酸性环境中脱硫过程示意图如下。
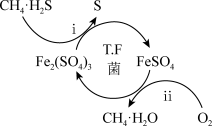
(1)过程ⅰ中H2S发生了_______ (填“氧化”或“还原”)反应。
(2)过程ⅱ的离子方程式是_______ 。
(3)已知:①Fe3+在pH为1.9时开始沉淀,3.2时沉淀完全。②30 ℃时,在T.F菌作用下,不同pH的FeSO4溶液中Fe2+的氧化速率如表。
请结合以上信息,判断工业脱硫应选择的最佳pH范围为_______ ,并说明原因:_______ 。
Ⅱ.蒸气转化:在催化剂的作用下,水蒸气将CH4氧化。结合图回答问题。
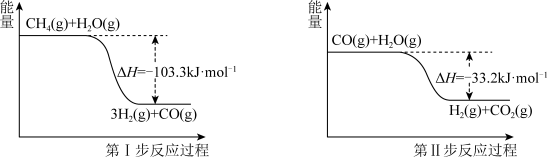
(4)写出甲烷和水蒸气反应生成二氧化碳和氢气的热化学方程式:_______ 。
(5)第Ⅱ步为可逆反应。在800 ℃时,恒容密闭容器中CO的起始浓度为a mol/L,水蒸气的起始浓度为1.5a mol/L,达到化学平衡状态后,CO平衡转化率为60%,则此反应的平衡常数为_______ 。
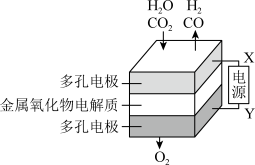
(6)在固态金属氧化物电解池中,高温共电解H2O—CO2混合气体制备H2和CO,基本原理如图所示,阴极的反应式是_______ 和CO2+2e—=CO+O2—。
Ⅰ.转化脱硫:将天然气压入吸收塔,30 ℃时,在T.F菌作用下,酸性环境中脱硫过程示意图如下。

(1)过程ⅰ中H2S发生了
(2)过程ⅱ的离子方程式是
(3)已知:①Fe3+在pH为1.9时开始沉淀,3.2时沉淀完全。②30 ℃时,在T.F菌作用下,不同pH的FeSO4溶液中Fe2+的氧化速率如表。
| pH | 0.9 | 1.2 | 1.5 | 1.8 | 2.1 | 2.4 | 2.7 | 3.0 |
| Fe2+氧化速率/(g·L-1·h-1) | 4.5 | 5.3 | 6.2 | 6.8 | 7.0 | 6.6 | 6.2 | 5.6 |
Ⅱ.蒸气转化:在催化剂的作用下,水蒸气将CH4氧化。结合图回答问题。

(4)写出甲烷和水蒸气反应生成二氧化碳和氢气的热化学方程式:
(5)第Ⅱ步为可逆反应。在800 ℃时,恒容密闭容器中CO的起始浓度为a mol/L,水蒸气的起始浓度为1.5a mol/L,达到化学平衡状态后,CO平衡转化率为60%,则此反应的平衡常数为
(6)在固态金属氧化物电解池中,高温共电解H2O—CO2混合气体制备H2和CO,基本原理如图所示,阴极的反应式是

您最近一年使用:0次



