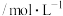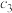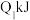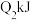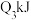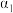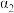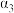1 . 下列几组微粒互为等电子体的有
①N2和CO②NO+和CN-③CO2和CS2④N2O和CO2⑤BF3和SO3
①N2和CO②NO+和CN-③CO2和CS2④N2O和CO2⑤BF3和SO3
| A.仅①②③ | B.仅④⑤ | C.仅①③④ | D.①②③④⑤ |
您最近一年使用:0次
2023-10-03更新
|
101次组卷
|
8卷引用:宁夏银川市贺兰县景博高中2020-2021学年高二下学期期中考试化学试题
名校
解题方法
2 . 下列叙述中不正确的是
A.一定浓度的醋酸钠溶液可使酚酞溶液变红,其原因是发生了如下反应: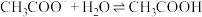 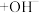 ,使溶液中 ,使溶液中 |
B.常温下,10 0.02 0.02 盐酸与10 盐酸与10 0.02 0.02  溶液混合,若混合后溶液的体积为20 溶液混合,若混合后溶液的体积为20 ,则溶液的 ,则溶液的 |
C.0.1  溶液中: 溶液中: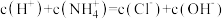 |
D.浓度均为1 的 的 溶液与盐酸等体积混合,混合溶液中: 溶液与盐酸等体积混合,混合溶液中: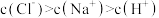  |
您最近一年使用:0次
2023-02-15更新
|
182次组卷
|
6卷引用:宁夏银川市长庆高级中学2020-2021学年高二上学期期末考试化学试题
解题方法
3 . 回答下列问题
(1)实验室在配制AlCl3的溶液时,为了抑制AlCl3的水解可加入少量的_______ (填写物质的名称)。把FeSO4溶液蒸干,灼烧,最后得到的主要固体产物是_______ (填化学式)
(2)常温下,pH=5的盐酸和pH=9的氢氧化钠溶液等体积混合,则混合液的pH=_______
(3)常温下,物质的量浓度相同的下列溶液:①NH4Cl、②(NH4)2SO4、③NH3·H2O、④(NH4)2CO3、⑤NH4HSO4.溶液中c( )从小到大顺序为
)从小到大顺序为_______ (填序号)。
(4)已知NaHA水溶液呈碱性。
①用离子方程式表示NaHA水溶液呈碱性的原因_______ (用离子方程式和相应的文字叙述)。
②在Na2A水溶液中各离子浓度的大小关系是_______
(1)实验室在配制AlCl3的溶液时,为了抑制AlCl3的水解可加入少量的
(2)常温下,pH=5的盐酸和pH=9的氢氧化钠溶液等体积混合,则混合液的pH=
(3)常温下,物质的量浓度相同的下列溶液:①NH4Cl、②(NH4)2SO4、③NH3·H2O、④(NH4)2CO3、⑤NH4HSO4.溶液中c(
 )从小到大顺序为
)从小到大顺序为(4)已知NaHA水溶液呈碱性。
①用离子方程式表示NaHA水溶液呈碱性的原因
②在Na2A水溶液中各离子浓度的大小关系是
您最近一年使用:0次
解题方法
4 . I、目前我国主要使用肼(N2H4)作为卫星发射所用燃料。
(1)N2H4可作为火箭发动机的燃料,与氧化剂N2O4反应生成N2和H2O。
已知:
①N2(g)+2O2(g)=N2O4(l) ΔH=-19.5kJ·mol−1K1
②N2H4(l)+O2(g)=N2(g)+2H2O(g) ΔH=-534.2kJ·mol−1K2
写出反应③液体燃料N2H4与液态N2O4反应生成N2和H2O的热化学方程式:___________ ,K1、K2、K3之间的关系:___________
(2)若已知下列数据:
试根据表中数据计算出N-H的键能:___________ kJ·mol−1
Ⅱ、在体积为2L的密闭容器中,进行如下化学反应:CO2(g)+H2(g) CO(g)+H2O(g)。其化学平衡常数K和温度T的关系如下表所示:
CO(g)+H2O(g)。其化学平衡常数K和温度T的关系如下表所示:
(3)该反应为___________ 反应(填“吸热”、“放热”),原因为___________
(4)830℃下,若向容器中分别加入2molH2和2molCO2,10s后达到平衡,则这段时间内 (H2)=
(H2)=___________ ,转化率α(CO2)=___________
(5)1200℃时,在某时刻体系中CO2、H2、CO、H2O的物质的量分别为4mol、4mol、8mol、8mol,则此时上述反应的平衡向___________ 移动(填“正向”、“逆向”或“不”)
Ⅲ、已知在不同温度下,甲烷隔绝空气有可能发生如下两个裂解反应:①CH4(g)→C(s)+2H2(g),②2CH4(g)→C2H4(g)+3H2(g)。某同学为了得到用天然气制取炭黑的允许温度范围和最佳温度,查阅资料,得到如下热力学数据:
反应①的ΔH(298K)=+74.848kJ/mol,ΔS(298K)=+80.674J/(mol·K)
反应②的ΔH(298K)=+376.426kJ/mol,ΔS(298K)=+220.211J/(mol·K)
已知,上述反应的焓变和熵变随温度变化很小。请帮助这位同学回答下列问题:
(6)反应①在___________ (填“高温”或“低温”)下能自发进行
(7)为了提高甲烷的炭化程度,下列温度最合适的是___________
(1)N2H4可作为火箭发动机的燃料,与氧化剂N2O4反应生成N2和H2O。
已知:
①N2(g)+2O2(g)=N2O4(l) ΔH=-19.5kJ·mol−1K1
②N2H4(l)+O2(g)=N2(g)+2H2O(g) ΔH=-534.2kJ·mol−1K2
写出反应③液体燃料N2H4与液态N2O4反应生成N2和H2O的热化学方程式:
(2)若已知下列数据:
| 化学键 | N-N | N≡N | H-O | O=O |
| 键能/kJ·mol-1 | 190 | 946 | 462.8 | 498.8 |
试根据表中数据计算出N-H的键能:
Ⅱ、在体积为2L的密闭容器中,进行如下化学反应:CO2(g)+H2(g)
 CO(g)+H2O(g)。其化学平衡常数K和温度T的关系如下表所示:
CO(g)+H2O(g)。其化学平衡常数K和温度T的关系如下表所示:| T/℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
(4)830℃下,若向容器中分别加入2molH2和2molCO2,10s后达到平衡,则这段时间内
 (H2)=
(H2)=(5)1200℃时,在某时刻体系中CO2、H2、CO、H2O的物质的量分别为4mol、4mol、8mol、8mol,则此时上述反应的平衡向
Ⅲ、已知在不同温度下,甲烷隔绝空气有可能发生如下两个裂解反应:①CH4(g)→C(s)+2H2(g),②2CH4(g)→C2H4(g)+3H2(g)。某同学为了得到用天然气制取炭黑的允许温度范围和最佳温度,查阅资料,得到如下热力学数据:
反应①的ΔH(298K)=+74.848kJ/mol,ΔS(298K)=+80.674J/(mol·K)
反应②的ΔH(298K)=+376.426kJ/mol,ΔS(298K)=+220.211J/(mol·K)
已知,上述反应的焓变和熵变随温度变化很小。请帮助这位同学回答下列问题:
(6)反应①在
(7)为了提高甲烷的炭化程度,下列温度最合适的是___________
| A.905.2K | B.927K | C.1273K | D.2000K |
您最近一年使用:0次
名校
5 . 人们应用原电池原理制作多种电池,以满足不同的需要。请根据题中提供的信息,填写空格。
(1)如图利用氧化还原反应设计而成的原电池:
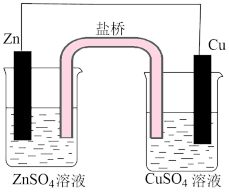
①左边烧杯内发生___________ (填“氧化”或“还原”)反应。
②右边烧杯内的电极反应式是___________ 。
③外电路中电子的流向是___________ 。
④电池总反应离子方程式是_______ 。盐桥M中装有 溶液和琼脂,其作用是
溶液和琼脂,其作用是_______ 。
(2)HCOOH燃料电池。研究HCOOH燃料电池性能的装置如图-2所示,两电极区间用允许K+、H+通过的半透膜隔开。
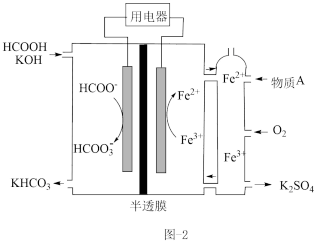
①电池负极电极反应式为_______ ;放电过程中需补充的物质A为______ (填化学式)。
②图-2所示的HCOOH燃料电池放电的本质是通过HCOOH与O2的反应,将化学能转化为电能,其反应的离子方程式为_____ 。
(3)CO无色无味有毒,世界各国每年均有不少人因CO中毒而失去生命。一种CO分析仪的工作原理如图所示,该装置中电解质为氧化钇—氧化钠(NASICON),其中O2-可以在固体介质NASICON中自由移动。传感器中通过的电流越大,充入气体中CO的含量越高,请回答:

①a极电极反应式为_______ 。
②工作时,O2-由电极_______ (填“a”或“b”,下同)向电极_______ 移动。
(4)利用电化学原理,将CO、O2和熔融K2CO3制成燃料电池,模拟工业电解法处理含 的废水,如图。电解过程中溶液中发生如下反应:
的废水,如图。电解过程中溶液中发生如下反应: +6Fe2++14H+=2Cr3++6Fe3++7H2O。
+6Fe2++14H+=2Cr3++6Fe3++7H2O。

①如图,CO在石墨Ⅰ电极放电生成Y,Y可循环使用。甲池工作时,石墨II附近发生的电极反应式为_______ 。
②甲中消耗0.12molCO,最多可以处理含
_______ mol的废水。
(1)如图利用氧化还原反应设计而成的原电池:

①左边烧杯内发生
②右边烧杯内的电极反应式是
③外电路中电子的流向是
④电池总反应离子方程式是
 溶液和琼脂,其作用是
溶液和琼脂,其作用是(2)HCOOH燃料电池。研究HCOOH燃料电池性能的装置如图-2所示,两电极区间用允许K+、H+通过的半透膜隔开。

①电池负极电极反应式为
②图-2所示的HCOOH燃料电池放电的本质是通过HCOOH与O2的反应,将化学能转化为电能,其反应的离子方程式为
(3)CO无色无味有毒,世界各国每年均有不少人因CO中毒而失去生命。一种CO分析仪的工作原理如图所示,该装置中电解质为氧化钇—氧化钠(NASICON),其中O2-可以在固体介质NASICON中自由移动。传感器中通过的电流越大,充入气体中CO的含量越高,请回答:

①a极电极反应式为
②工作时,O2-由电极
(4)利用电化学原理,将CO、O2和熔融K2CO3制成燃料电池,模拟工业电解法处理含
 的废水,如图。电解过程中溶液中发生如下反应:
的废水,如图。电解过程中溶液中发生如下反应: +6Fe2++14H+=2Cr3++6Fe3++7H2O。
+6Fe2++14H+=2Cr3++6Fe3++7H2O。
①如图,CO在石墨Ⅰ电极放电生成Y,Y可循环使用。甲池工作时,石墨II附近发生的电极反应式为
②甲中消耗0.12molCO,最多可以处理含

您最近一年使用:0次
名校
解题方法
6 . 完成下列问题。
(1)若将50mL4mol·L-1稀硝酸和200mL0.5mol·L-1稀硫酸混合后,加入19.2g铜粉,微热,充分反应。若忽略溶液体积变化,溶液中铜离子物质的量浓度为___________ mol·L-1。
(2)处理某废水时,反应过程中部分离子浓度与反应进程关系如图,反应过程中主要存在N2、 、ClO-、CNO-(C为+4价)、Cl-等微粒。写出处理该废水时发生反应的离子方程式
、ClO-、CNO-(C为+4价)、Cl-等微粒。写出处理该废水时发生反应的离子方程式_______ 。

(3)Na2SX(X=2,4,6,8等)在碱性溶液中可被NaClO氧化为Na2SO4。Na2SX中含有的化学键类型有___________ 。
(4)足量铜与一定量浓硝酸反应,得到硝酸铜溶液和NO2、N2O4、NO的混合气体,将这些气体与1.12LO2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入4mol•L-1NaOH溶液至Cu2+恰好完全沉淀,则消耗NaOH溶液的体积是___________ mL。
(5)次磷酸(H3PO2)是一种精细化工产品,具有较强还原性,回答下列问题:
①H3PO2与足量NaOH溶液反应生成NaH2PO2。已知:NaH2PO2的水溶液呈碱性,则H3PO2是___________ 酸(填“强”或“弱”);写出H3PO2的电离方程式:___________ 。
②H3PO2及NaH2PO2均可将溶液中的银离子还原为银单质,从而可用于化学镀银,利用H3PO2进行化学镀银反应中,氧化剂与还原剂的物质的量之比为4:1,写出化学镀银反应的离子方程式_______ 。
(1)若将50mL4mol·L-1稀硝酸和200mL0.5mol·L-1稀硫酸混合后,加入19.2g铜粉,微热,充分反应。若忽略溶液体积变化,溶液中铜离子物质的量浓度为
(2)处理某废水时,反应过程中部分离子浓度与反应进程关系如图,反应过程中主要存在N2、
 、ClO-、CNO-(C为+4价)、Cl-等微粒。写出处理该废水时发生反应的离子方程式
、ClO-、CNO-(C为+4价)、Cl-等微粒。写出处理该废水时发生反应的离子方程式
(3)Na2SX(X=2,4,6,8等)在碱性溶液中可被NaClO氧化为Na2SO4。Na2SX中含有的化学键类型有
(4)足量铜与一定量浓硝酸反应,得到硝酸铜溶液和NO2、N2O4、NO的混合气体,将这些气体与1.12LO2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入4mol•L-1NaOH溶液至Cu2+恰好完全沉淀,则消耗NaOH溶液的体积是
(5)次磷酸(H3PO2)是一种精细化工产品,具有较强还原性,回答下列问题:
①H3PO2与足量NaOH溶液反应生成NaH2PO2。已知:NaH2PO2的水溶液呈碱性,则H3PO2是
②H3PO2及NaH2PO2均可将溶液中的银离子还原为银单质,从而可用于化学镀银,利用H3PO2进行化学镀银反应中,氧化剂与还原剂的物质的量之比为4:1,写出化学镀银反应的离子方程式
您最近一年使用:0次
名校
解题方法
7 . 甲醇是一种重要的有机化工原料,在工业上有着重要的用途。
(1)用CO和H2可以合成甲醇,其反应为CO(g)+2H2(g) CH3OH(g) △H=akJ/mol。相同条件下,向容积相同的a、b、c、d、e五个密闭容器中分别充入等量的物质的量之比为1:2的CO和H2的混合气体,改变温度进行实验,测得反应进行到tmin时甲醇的体积分数如图1所示。
CH3OH(g) △H=akJ/mol。相同条件下,向容积相同的a、b、c、d、e五个密闭容器中分别充入等量的物质的量之比为1:2的CO和H2的混合气体,改变温度进行实验,测得反应进行到tmin时甲醇的体积分数如图1所示。
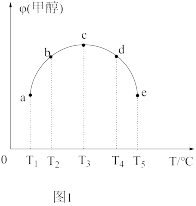
①从a点到c点,温度升高甲醇的体积分数增大的原因是___________ 。
②根据图象判断a___________ 0;(填“>”“<”或“=”)
③下列说法能说明反应达到平衡状态的是___________ (填字母)。
A.容器中气体压强不再变化 B.用H2和CH3OH表示的反应速率之比为2:1
C.混合气体的密度不变 D.单位时间内生成1molCH3OH的同时生成2molH2
(2)若在T1℃、10MPa条件下,往一密闭刚性容器通入CO和H2合成甲醇[n(CO):n(H2)=1:2],测得容器内总压强与反应时间的关系如图2所示。

①图中A点时,CO的转化率为___________ 。
②在其他条件不变的情况下,测得T2℃时压强的变化曲线如图所示,则C点的正反应速率Vc(正)与A点VA(逆)的逆反应速率的大小关系为Vc(正)___________ VA(逆)(填“>”“<”或“=”)。
③B点加入一定量的CH3OH(g),则再次平衡后CO的体积分数___________ (填“增大”“减小”或“不变”),B点和C点的平衡常数的大小关系为KB___________ KC(填“>”“<”或“=”)。
④图中B点的压强平衡常数Kp=___________ (Kp为压强平衡常数,用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)(只需要列出计算式即可)
(1)用CO和H2可以合成甲醇,其反应为CO(g)+2H2(g)
 CH3OH(g) △H=akJ/mol。相同条件下,向容积相同的a、b、c、d、e五个密闭容器中分别充入等量的物质的量之比为1:2的CO和H2的混合气体,改变温度进行实验,测得反应进行到tmin时甲醇的体积分数如图1所示。
CH3OH(g) △H=akJ/mol。相同条件下,向容积相同的a、b、c、d、e五个密闭容器中分别充入等量的物质的量之比为1:2的CO和H2的混合气体,改变温度进行实验,测得反应进行到tmin时甲醇的体积分数如图1所示。
①从a点到c点,温度升高甲醇的体积分数增大的原因是
②根据图象判断a
③下列说法能说明反应达到平衡状态的是
A.容器中气体压强不再变化 B.用H2和CH3OH表示的反应速率之比为2:1
C.混合气体的密度不变 D.单位时间内生成1molCH3OH的同时生成2molH2
(2)若在T1℃、10MPa条件下,往一密闭刚性容器通入CO和H2合成甲醇[n(CO):n(H2)=1:2],测得容器内总压强与反应时间的关系如图2所示。

①图中A点时,CO的转化率为
②在其他条件不变的情况下,测得T2℃时压强的变化曲线如图所示,则C点的正反应速率Vc(正)与A点VA(逆)的逆反应速率的大小关系为Vc(正)
③B点加入一定量的CH3OH(g),则再次平衡后CO的体积分数
④图中B点的压强平衡常数Kp=
您最近一年使用:0次
名校
解题方法
8 . 将6.4g铜投入30mL一定浓度的硝酸中,恰好完全反应,产生标准状况下的NO和NO2混合气体共2.24L。则下列叙述正确的是
| A.NO体积为0.56L | B.原硝酸浓度10.0mol/L |
| C.NO和NO2物质的量之比为2∶1 | D.体现酸性的硝酸为0.1mol |
您最近一年使用:0次
2021-12-18更新
|
2638次组卷
|
13卷引用:宁夏石嘴山市第三中学2021-2022学年高三上学期期中考试化学(理)试题
宁夏石嘴山市第三中学2021-2022学年高三上学期期中考试化学(理)试题(已下线)第07讲 硝酸(word讲义)-【帮课堂】2021-2022学年高一化学同步精品讲义(人教版2019必修第二册)辽宁省沈阳市三十一中学2021-2022学年高一下学期4月月考化学试题江西省赣州市九校协作体2021-2022学年高一下学期期中考试化学试题上海市徐汇区2021-2022学年高一下学期6月自评化学试题上海市同济大学第一附属中学2021-2022学年高一下学期等级阶段性测试2化学试题河南省宋基信阳实验中学2021-2022学年高一下学期第二次月考化学试题江西省抚州市金溪县第一中学2021-2022学年高一下学期第一次月考化学试题广东省汕头市潮南区陈店实验学校2021-2022学年高一下学期3月第一次月考化学试题陕西省西安市第六中学2022-2023学年高一下学期第一次月考化学试题辽宁省沈阳市第九中学2022-2023学年高一下学期第一次月考化学试题陕西省西安市第八十五中学2022-2023学年高一下学期期中考试化学试题江西省南昌市第十九中学2021-2022学年高一下学期第一次月考化学试卷
名校
解题方法
9 . 下列有关物质的量浓度和质量分数的计算正确的是
| A.98%的浓硫酸的物质的量浓度是49%的硫酸的物质的量浓度的二倍 |
| B.20%的氢氧化钠溶液和30%的氢氧化钠溶液等体积混合,混合后溶液的溶质质量分数为25% |
C.c1 mol/L,ρ1 g/cm3的硫酸溶液与c2 mol/L,ρ2 g/cm3的硫酸溶液等体积混合,得到ρ3 g/cm3的硫酸溶液的浓度为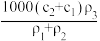 mol/L mol/L |
| D.25℃时NaCl饱和溶液(密度为1.17g/cm3)的物质的量浓度约为5.3mol/L(已知25℃时氯化钠在水中的溶解度为36克) |
您最近一年使用:0次
2021-12-04更新
|
1122次组卷
|
5卷引用:宁夏银川一中2021-2022学年高一上学期期中考试化学试题
宁夏银川一中2021-2022学年高一上学期期中考试化学试题(已下线)解密02 物质的量(分层训练)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)解密02 物质的量(分层训练)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)浙江省杭州第十四中学2022-2023学年高一上学期期末考试化学试题(已下线)高二上期末考化学194
名校
10 . 在温度相同、容积均为2L的3个恒容密闭容器中,按不同方式投入反应物,保持恒温,测得反应达到平衡时的有关数据如下。下列说法正确的是
已知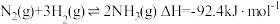
已知
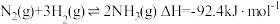
容器 | 甲 | 乙 | 丙 |
反应物投入量 |
|
|
|
|
|
|
|
反应的能量变化 | 放出 | 放出 | 吸收 |
体系压强/Pa | P1 | P2 | P3 |
反应物转化率 |
|
|
|
A.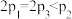 |
B.达到平衡时丙容器中 的体积分数最大 的体积分数最大 |
C.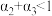 |
D.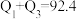 |
您最近一年使用:0次
2021-12-02更新
|
891次组卷
|
9卷引用:宁夏六盘山高级中学2021-2022学年高二上学期期中考试化学试题
宁夏六盘山高级中学2021-2022学年高二上学期期中考试化学试题选择性必修1(SJ)专题2易错疑难集训(二)山东省滕州第一中学2021-2022学年高二上学期第一学段模块考试(期中)化学试题山东省济南市商河县第一中学2021-2022学年高三上学期11月期中考试化学试题吉林省长春汽车经济开发区第六中学2018-2019学年高二上学期第一次月考化学试题【全国百强校】福建省厦门市双十中学2018-2019学年高二下学期第一次月考化学试题湖南省娄底市双峰县第一中学2020-2021学年高二上学期9月入学考试化学试题浙江省宁波市余姚中学2020-2021学年高二上学期期中考试化学试题山东省威海乳山市第一中学2022-2023学年高二下学期开学考试化学试题

 、
、
 、
、