名校
解题方法
1 . 向 和
和 混合溶液中滴加稀盐酸,
混合溶液中滴加稀盐酸, 的生成量与加入
的生成量与加入 盐酸的体积的关系如图所示。下列判断正确的是
盐酸的体积的关系如图所示。下列判断正确的是
 和
和 混合溶液中滴加稀盐酸,
混合溶液中滴加稀盐酸, 的生成量与加入
的生成量与加入 盐酸的体积的关系如图所示。下列判断正确的是
盐酸的体积的关系如图所示。下列判断正确的是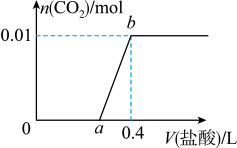
| A.在0-a范围内,只发生中和反应 |
B.ab段发生反应的离子方程式为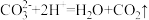 |
C. |
D.原混合溶液中 与Na2CO3的物质的量之比为 与Na2CO3的物质的量之比为 |
您最近一年使用:0次
2024-01-27更新
|
217次组卷
|
34卷引用:黑龙江省哈尔滨市第七十三中学校2020-2021学年高二下学期期中考试化学试题
黑龙江省哈尔滨市第七十三中学校2020-2021学年高二下学期期中考试化学试题青海省湟川中学2020-2021学年高一下学期开学考试化学试题新疆巴音郭楞蒙古自治州第二中学2021届高三上学期开学摸底考试化学试题浙江省宁波市效实中学2020-2021学年高一下学期期中考试化学(学考)试题重庆市秀山高级中学校2021-2022学年高三上学期9月月考化学试题山东省滨州市惠民县第二中学致远高中部2021-2022学年高三10月月考化学试题内蒙古自治区包钢第一中学2021-2022学年高三上学期10月月考化学试题(已下线)专题06 常见金属及其化合物-备战2022年高考化学学霸纠错(全国通用)黑龙江省鹤岗市第一中学2021-2022学年高一上学期期末考试化学试题浙江省当湖高级中学2021-2022学年高一上学期12月阶段性测试化学试题浙江省绍兴鲁迅高级中学2021-2022学年高一上学期期中考试化学试题浙江省丽水外国语实验学校2020-2021学年高一上学期第三次月考化学试题福建省莆田二中2019-2020学年高一上学期期末检测化学试题浙江省诸暨市2016-2017学年高一上学期期末考试化学试题 浙江省诸暨市2017-2018学年高二下学期期末考试化学试题 江西省新余市2021-2022学年高一上学期期末考试化学试题江西省抚州市临川区第一中学2021-2022学年高一下学期第一次月考化学试题浙江省宁波市六校2021-2022学年高一下学期期中联考化学试题(已下线)第06讲 钠及其化合物(练)-2023年高考化学一轮复习讲练测(新教材新高考)浙江省部分重点中学普通高中2022届高三学业水平模拟考试化学试题山东省枣庄市滕州市第一中学2022-2023学年高三上学期10月考试化学试题浙江省温州市瑞安市第六中学2021-2022学年高一下学期5月月考化学试题浙江省温州新力量联盟2022-2023学年高一上学期期中联考 化学试题上海市复兴高级中学2022-2023学年高三上学期10月月考化学试题浙江省湖州市2022-2023学年高一上学期期末检测化学试题(已下线)第三章 金属及其化合物 第12练 Na2CO3、NaHCO3碱金属(已下线)浙江省柯桥中学2023-2024学年高一上学期期中检测化学试题 河北省石家庄市第四十二中学2023-2024学年高一上学期第二次月考化学试题 安徽省合肥市第一中学2023-2024学年高一上学期素质拓展训练(四)化学试题浙江省杭州第十一中学2023-2024学年高一上学期期中考试化学试题15-2023新东方高一上期中考化学12-2023新东方高二上期中考化学12陕西省西安市周至县第六中学2023-2024学年高三上学期11月期中化学试题浙江省湖州市南浔高级中学2023-2024学年高一上学期十二月月考化学试题
解题方法
2 . 碳酸锂是制取各种精细锂化合物、金属锂等的基础锂盐。一种用锂辉矿烧渣(主要成分为β-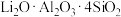 ,还含有少量MgO、Fe2O3及FeO等杂质)制备Li2CO3的工艺流程如下:
,还含有少量MgO、Fe2O3及FeO等杂质)制备Li2CO3的工艺流程如下:

回答下列问题:
(1)步骤II加CaCO3粉末的作用是_______ 。
(2)步骤IV加入H2O2发生反应的离子方程式_______ ;步骤V“过滤”前需调整溶液的pH范围为_______ 。(已知Fe3+开始沉淀的pH为2.2,沉淀完全的pH为3.5;Al3+开始沉淀的pH为4.1,沉淀完全的pH为5.4,pH大于7.8时沉淀开始溶解)。
(3)步骤VII“过滤”时得到的滤渣的主要成分是_______ (填化学式)。
(4)步骤X“洗涤”时,为检验是否洗涤完全,可选用的试剂是_______ 。
(5)LiBF4可用作锂离子电池的电解质,可用HBF4(氟硼酸)与Li2CO3在水溶液中制取,该反应的化学方程式为_______ 。
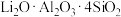 ,还含有少量MgO、Fe2O3及FeO等杂质)制备Li2CO3的工艺流程如下:
,还含有少量MgO、Fe2O3及FeO等杂质)制备Li2CO3的工艺流程如下:
回答下列问题:
(1)步骤II加CaCO3粉末的作用是
(2)步骤IV加入H2O2发生反应的离子方程式
(3)步骤VII“过滤”时得到的滤渣的主要成分是
(4)步骤X“洗涤”时,为检验是否洗涤完全,可选用的试剂是
(5)LiBF4可用作锂离子电池的电解质,可用HBF4(氟硼酸)与Li2CO3在水溶液中制取,该反应的化学方程式为
您最近一年使用:0次
解题方法
3 . 肼(N2H4)作为火箭发动机的燃料,可通过反应NaClO+2NH3=N2H4+NaCl+H2O制取。某化学兴趣小组尝试在实验室制取N2H4,设计了如图实验:
(1)制备NaClO溶液,装置如图所示。(已知:3Cl2+6NaOH 5NaCl+NaClO3+3H2O)
5NaCl+NaClO3+3H2O)
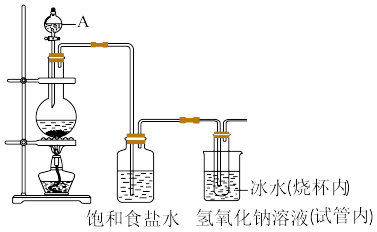
①仪器A的名称是_____ 。
②连接好装置,装药品之前,必须进行的一项操作是_____ 。
③圆底烧瓶内发生反应的化学方程式为_____ ;当生成71g氯气时,被氧化的HCl为_____ mol,试管内发生反应的离子方程式为______ 。
④饱和食盐水的作用是_____ ,冰水的作用是_____ 。
(2)将NaClO溶液倒入烧杯中,持续通入NH3制取N2H4。通常情况下,1体积水能溶解700体积的氨气,则图装置中漏斗的作用是_____ 。

(3)火箭发射时用N2H4作燃料,用N2O4助燃,燃烧生成两种可参与大气循环的物质,写出该反应的化学方程式_____ 。
(1)制备NaClO溶液,装置如图所示。(已知:3Cl2+6NaOH
 5NaCl+NaClO3+3H2O)
5NaCl+NaClO3+3H2O)
①仪器A的名称是
②连接好装置,装药品之前,必须进行的一项操作是
③圆底烧瓶内发生反应的化学方程式为
④饱和食盐水的作用是
(2)将NaClO溶液倒入烧杯中,持续通入NH3制取N2H4。通常情况下,1体积水能溶解700体积的氨气,则图装置中漏斗的作用是

(3)火箭发射时用N2H4作燃料,用N2O4助燃,燃烧生成两种可参与大气循环的物质,写出该反应的化学方程式
您最近一年使用:0次
解题方法
4 . 下列离子方程式正确的是
A.NaHCO3溶液中加入少量的石灰水HCO +Ca2++OH-=CaCO3↓+H2O +Ca2++OH-=CaCO3↓+H2O |
| B.FeCl2溶液中通入Cl2:2Fe2++Cl2=2Fe3++2Cl- |
| C.次氯酸钙溶液中通入二氧化硫:Ca2++2ClO-+H2O+SO2=CaSO3↓+2HClO |
D.氯气与水反应:Cl2+H2O 2H++Cl-+ClO- 2H++Cl-+ClO- |
您最近一年使用:0次
解题方法
5 . 硫代硫酸钠晶体(Na2S2O3·5H2O,M=248 g·mol-1)是重要的化工原料,易溶于水,不溶于乙醇,具有较强的还原性和配位能力,在中性或碱性环境中稳定。某兴趣小组用如图装置制备 。
。
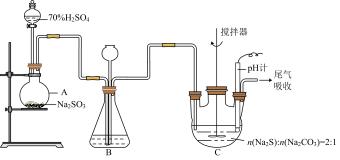
I.制备Na2S2O3•5H2O
合成反应: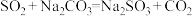 ;
; ;
; 。
。
实验步骤:装置A制备的 通入装置C中的混合溶液,加热、搅拌,至溶液
通入装置C中的混合溶液,加热、搅拌,至溶液 约为7时,停止通入
约为7时,停止通入 气体,得产品混合溶液,经过分离提纯得到
气体,得产品混合溶液,经过分离提纯得到 产品。
产品。
(1)仪器A的名称是_______ ,仪器B中长颈漏斗的作用是_______ ,另外可以通过装置B观察SO2的生成速率,其中的液体可以选择_______
a.浓H2SO4 b.饱和Na2SO3溶液 c.饱和NaCl溶液 d.饱和NaHSO3溶液
(2)装置C中的反应混合溶液pH过低将导致产率降低,原因是(离子方程式表示)_______
(3)产品混合溶液经蒸发浓缩、冷却结晶、过滤、洗涤、干燥,得到Na2S2O3·5H2O产品。下列说法正确的是_______。
II.测定产品纯度:准确称取Wg产品,用适量蒸馏水溶解,以淀粉作指示剂,用0.1000 mol•L-1碘的标准溶液滴定。 反应原理为:2S2O +I2=S4O
+I2=S4O +2I-
+2I-
(4)滴定至终点时,滴定终点的现象是_______ 。
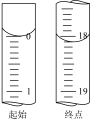
(5)滴定起始和终点的液面位置如图,则消耗碘的标准溶液体积为_______ mL。若滴定终点时仰视凹液面,则测定产品的纯度结果_______ 。(填“偏高”、“偏低”、或“无影响”)
III.Na2S2O3的应用
(6)Na2S2O3溶液常用作定影剂,溶去胶片上未感光的AgBr,生成配位数为2的配离子,请写出该反应的离子方程式_______ 。
 。
。
I.制备Na2S2O3•5H2O
合成反应:
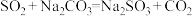 ;
; ;
; 。
。实验步骤:装置A制备的
 通入装置C中的混合溶液,加热、搅拌,至溶液
通入装置C中的混合溶液,加热、搅拌,至溶液 约为7时,停止通入
约为7时,停止通入 气体,得产品混合溶液,经过分离提纯得到
气体,得产品混合溶液,经过分离提纯得到 产品。
产品。(1)仪器A的名称是
a.浓H2SO4 b.饱和Na2SO3溶液 c.饱和NaCl溶液 d.饱和NaHSO3溶液
(2)装置C中的反应混合溶液pH过低将导致产率降低,原因是(离子方程式表示)
(3)产品混合溶液经蒸发浓缩、冷却结晶、过滤、洗涤、干燥,得到Na2S2O3·5H2O产品。下列说法正确的是_______。
| A.蒸发浓缩至有大量晶体析出时,停止加热,用预热蒸干 |
| B.快速蒸发溶液中水分,可得较大晶体颗粒 |
| C.冷却结晶后的固液混合物中加入乙醇可提高产率 |
| D.可选用冷的Na2SO3溶液作洗涤剂 |
II.测定产品纯度:准确称取Wg产品,用适量蒸馏水溶解,以淀粉作指示剂,用0.1000 mol•L-1碘的标准溶液滴定。 反应原理为:2S2O
 +I2=S4O
+I2=S4O +2I-
+2I-(4)滴定至终点时,滴定终点的现象是
(5)滴定起始和终点的液面位置如图,则消耗碘的标准溶液体积为

III.Na2S2O3的应用
(6)Na2S2O3溶液常用作定影剂,溶去胶片上未感光的AgBr,生成配位数为2的配离子,请写出该反应的离子方程式
您最近一年使用:0次
解题方法
6 . 25℃时,物质的量浓度相同的以下溶液:①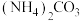 ,②
,② ,③
,③ ,④
,④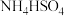 ,⑤
,⑤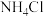 ,
, 大小比较,正确的顺序是
大小比较,正确的顺序是
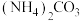 ,②
,② ,③
,③ ,④
,④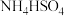 ,⑤
,⑤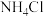 ,
, 大小比较,正确的顺序是
大小比较,正确的顺序是| A.①>②>③>④>⑤ | B.②>③>①>④>⑤ |
| C.③>②>①>④>⑤ | D.③>②>①>⑤>④ |
您最近一年使用:0次
2022-10-01更新
|
669次组卷
|
3卷引用:黑龙江省哈尔滨市宾县第一中学校2021-2022学年高二上学期第二次月考化学试题
7 . Ⅰ.氨的工业合成工艺的成熟推动了人类文明的进步,不少科技工作者为了寻找廉价的氨的制备方法,进行了前赴后继的探索性工作。用氢气和氮气合成氨是一个可逆反应,化学方程式为N2+3H2 2NH3。已知,在常温下,1 g H2完全转化为NH3,放出的热量为15.4 kJ。
2NH3。已知,在常温下,1 g H2完全转化为NH3,放出的热量为15.4 kJ。
(1)请写出该反应的热化学方程式:_______ 。
(2)如果一个反应的ΔH—TΔS<0,则该反应能够自发进行。已知上述氨的合成反应的ΔS=—198.2 J·mol-1·K-1,则其在常温下_______ (填“能”或“不能”)自发进行。
Ⅱ.已知A(g)+B(g) C(g)+D(g)反应的平衡常数和温度的关系如下:
C(g)+D(g)反应的平衡常数和温度的关系如下:
回答下列问题:
(3)该反应的平衡常数表达式K=_______ ,ΔH=_______ (填“<”“>”或“=”)0。
(4)830℃时,向一个5 L的密闭容器中充入0.20 mol A和0.80 mol B,如反应初始6 s内A的平均反应速率v(A)=0.003 mol·L-1·s-1,则6 s时,c(A)=_______ mol·L-1,C的物质的量为_______ mol;若反应经一段时间后,达到平衡时A的转化率为_______ ,如果这时向该密闭容器中再充入1 mol氩气,平衡时A的转化率为_______ 。
(5)判断该反应是否达到平衡的依据为_______ 。
a.压强不随时间改变 b.气体的密度不随时间改变
c.c(A)不随时间改变 d.单位时间里生成C和D的物质的量相等
(6)1200℃时,反应C(g)+D(g) A(g)+B(g)的平衡常数的值为
A(g)+B(g)的平衡常数的值为_______ 。
 2NH3。已知,在常温下,1 g H2完全转化为NH3,放出的热量为15.4 kJ。
2NH3。已知,在常温下,1 g H2完全转化为NH3,放出的热量为15.4 kJ。(1)请写出该反应的热化学方程式:
(2)如果一个反应的ΔH—TΔS<0,则该反应能够自发进行。已知上述氨的合成反应的ΔS=—198.2 J·mol-1·K-1,则其在常温下
Ⅱ.已知A(g)+B(g)
 C(g)+D(g)反应的平衡常数和温度的关系如下:
C(g)+D(g)反应的平衡常数和温度的关系如下:| 温度/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
| 平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
回答下列问题:
(3)该反应的平衡常数表达式K=
(4)830℃时,向一个5 L的密闭容器中充入0.20 mol A和0.80 mol B,如反应初始6 s内A的平均反应速率v(A)=0.003 mol·L-1·s-1,则6 s时,c(A)=
(5)判断该反应是否达到平衡的依据为
a.压强不随时间改变 b.气体的密度不随时间改变
c.c(A)不随时间改变 d.单位时间里生成C和D的物质的量相等
(6)1200℃时,反应C(g)+D(g)
 A(g)+B(g)的平衡常数的值为
A(g)+B(g)的平衡常数的值为
您最近一年使用:0次
解题方法
8 . Ⅰ.研原电池是化学对人类的一项重大贡献。
(1)如图是甲烷燃料电池原理示意图,回答下列问题:
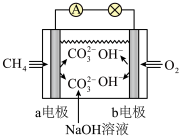
①电池的负极是_______ (填“a”或“b”)电极,该极的电极反应式为_______
②电池工作一段时间后电解质溶液的pH_______ (填 “增大”、“减小”或“不变”)。
(2)熔融盐燃料电池具有很高的发电效率,因而受到重视。可用Li2CO3和Na2CO3的熔融盐混合物作电解质,CO为负极燃气,空气与CO2的混合气为正极助燃气,制得在650℃下工作的燃料电池。请完成有关的电池反应式:
负极反应式:2CO+2 —4e—=4CO2;
—4e—=4CO2;
正极反应式:_______ ,总电池反应式:_______
Ⅱ.“神舟九号”飞船的电源系统共有3种,分别是太阳能电池帆板、镉镍蓄电池和应急电池。
(3)飞船在光照区运行时,太阳能电池帆板将太阳能转化为电能,除供给飞船使用外,多余部分用镉镍蓄电池储存起来。其工作原理为Cd+2NiO(OH)+2H2O Cd(OH)2 +2Ni(OH)2;当飞船运行到阴影区时,镉镍蓄电池开始为飞船供电,此时负极附近溶液的碱性
Cd(OH)2 +2Ni(OH)2;当飞船运行到阴影区时,镉镍蓄电池开始为飞船供电,此时负极附近溶液的碱性 _______ (填“增大”“减小”或“不变”)。
(4)紧急状况下,应急电池会自动启动,工作原理为Zn+Ag2O+H2O 2Ag+ Zn(OH)2,负极的电极反应式为
2Ag+ Zn(OH)2,负极的电极反应式为_______ 。
(1)如图是甲烷燃料电池原理示意图,回答下列问题:

①电池的负极是
②电池工作一段时间后电解质溶液的pH
(2)熔融盐燃料电池具有很高的发电效率,因而受到重视。可用Li2CO3和Na2CO3的熔融盐混合物作电解质,CO为负极燃气,空气与CO2的混合气为正极助燃气,制得在650℃下工作的燃料电池。请完成有关的电池反应式:
负极反应式:2CO+2
 —4e—=4CO2;
—4e—=4CO2;正极反应式:
Ⅱ.“神舟九号”飞船的电源系统共有3种,分别是太阳能电池帆板、镉镍蓄电池和应急电池。
(3)飞船在光照区运行时,太阳能电池帆板将太阳能转化为电能,除供给飞船使用外,多余部分用镉镍蓄电池储存起来。其工作原理为Cd+2NiO(OH)+2H2O
 Cd(OH)2 +2Ni(OH)2;当飞船运行到阴影区时,镉镍蓄电池开始为飞船供电,此时负极附近溶液的碱性
Cd(OH)2 +2Ni(OH)2;当飞船运行到阴影区时,镉镍蓄电池开始为飞船供电,此时负极附近溶液的碱性 (4)紧急状况下,应急电池会自动启动,工作原理为Zn+Ag2O+H2O
 2Ag+ Zn(OH)2,负极的电极反应式为
2Ag+ Zn(OH)2,负极的电极反应式为
您最近一年使用:0次
9-10高二下·北京·期末
名校
9 . 如图所示,三个烧瓶中分别充满NO2气体并分别装在盛有水的三个烧杯中,在①烧杯中加入CaO,在②烧杯中不加其他任何物质,在③烧杯中加入NH4Cl晶体,发现①中红棕色变深,③中红棕色变浅。已知:2NO2(红棕色) N2O4(无色),下列叙述正确的是
N2O4(无色),下列叙述正确的是
 N2O4(无色),下列叙述正确的是
N2O4(无色),下列叙述正确的是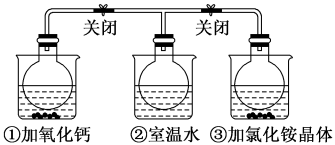
A.2NO2 N2O4是吸热反应 N2O4是吸热反应 |
| B.NH4Cl溶于水时吸收热量 |
| C.①烧瓶中平衡时混合气体的平均相对分子质量增大 |
| D.③烧瓶中气体的压强增大 |
您最近一年使用:0次
2022-08-28更新
|
1138次组卷
|
23卷引用:黑龙江省伊春市伊美区第二中学2021-2022学年高二上学期期中考试化学试题
黑龙江省伊春市伊美区第二中学2021-2022学年高二上学期期中考试化学试题黑龙江省大庆市第四中学2019-2020学年高二上学期第一次检测化学试题江西省上饶市2020-2021学年高二上学期期末教学质量测试化学试题江西省赣州市第一中学2020-2021学年高二下学期开学测试化学试题河南省信阳高级中学2020-2021学年高二下学期回顾测试化学试题福建省三明第一中学2021-2022学年高二上学期第一次月考化学试题福建省莆田市擢英中学2021-2022学年高二上学期第一次月考化学试卷(已下线)2010年北京市八一中学高二第二学期期末考试化学试卷2018版化学(苏教版)高考总复习专题七课时跟踪训练--化学平衡的移动新疆生产建设兵团第二中学2017-2018学年高二上学期第四次月考(期末)化学试题【全国百强校】辽宁省鞍山市第一中学2018-2019学年高二下学期开学考试化学试题新疆自治区生产建设兵团第二中学2018-2019学年高二第一次月考化学试题陕西省延安市第一中学2019-2020学年高二上学期期中考试化学试题(已下线)专题7.2 化学平衡状态 化学平衡移动(练)-《2020年高考一轮复习讲练测》云南省普洱市江城县第一中学2019—2020学年高二上学期期末考试化学试题四川省泸州市泸县第二中学2019-2020学年高二下学期第一次在线月考化学试题(已下线)2.3.2+影响化学平衡状态的因素-2020-2021学年高二化学同步课堂帮帮帮(人教版选修4)安徽省蚌埠田家炳中学2020-2021学年高二10月月考化学试题(已下线)2.2.2 浓度商、温度对化学平衡的影响-【帮课堂】2022-2023学年高二化学同步精品讲义(沪科版2020选择性必修第一册)广东省深圳市宝安区宝安中学2022-2023学年高一上学期期中考试化学试题新疆奇台县第一中学2022-2023学年高二上学期期中考试化学试题山东省淄博市部分学校联考2022-2023学年高一下学期4月期中考试化学试题(已下线)选择题11-15
9-10高二下·浙江温州·期中
名校
10 . Fe2+、Fe3+、Zn2+较完全地形成氢氧化物沉淀的pH分别为6.7、3.7、4.6。某硫酸锌酸性溶液中含有少量Fe2+、Fe3+杂质离子,为除去这些离子制得纯净的ZnSO4,应加入的试剂是
| A.NaOH溶液 | B.氨水 |
| C.KMnO4、ZnCO3 | D.H2O2、ZnO |
您最近一年使用:0次
2022-08-26更新
|
385次组卷
|
17卷引用:黑龙江省哈尔滨市宾县第一中学2021-2022学年高三上学期9月月考化学试题
黑龙江省哈尔滨市宾县第一中学2021-2022学年高三上学期9月月考化学试题黑龙江省宾县一中2020届高三上学期第一次月考化学试题(已下线)2010年浙江温州中学第二学期期中考试高二化学试卷(已下线)2010年海南省嘉积中学高二上学期第二次月考化学试卷(已下线)2011-2012学年辽宁省开原高中高二第三次月考化学试卷2014届河北省衡水中学高三上学期二调考试化学试卷(已下线)2014届湖南省长沙县、攸县、醴陵、浏阳一中高三11月联考化学试卷(已下线)2015届吉林省东北师大附中高三第二次摸底考试化学试卷吉林省长春市东北师范大学附属中学2015届高三上学期二模化学试卷2015-2016学年江苏省射阳县第二中学高二上学期期末选修化学试卷贵州省道真县民族中学2020届高三上学期开学考试理综化学试题2020届高考化学小题狂练(全国通用版)专练18 物质的检验、分离和提纯陕西省西安市第一中学2019-2020学年学高二上学期期末考试化学试题陕西省咸阳市武功县普集高级中学2021-2022学年高二上学期期末化学试题(已下线)第07讲 铁及其化合物(练)-2023年高考化学一轮复习讲练测(新教材新高考)(已下线)第3讲 铁盐及其亚铁盐江苏省南京师范大学附属中学2023-2024学年高二上学期期中考试 化学试卷



