名校
解题方法
1 . 按要求回答问题。
(1)NaH能与水剧烈反应生成氢气,生成的 标准状况下体积为2.24L时,转移电子的数目
标准状况下体积为2.24L时,转移电子的数目___________ 。
(2)AlN用于电子仪器。AlN中常混有少量碳,将一定量含杂质碳的AlN样品置于密闭反应器中,通入0.18mol的 ,在高温下充分反应后测得气体的密度为
,在高温下充分反应后测得气体的密度为 (已折算成标准状况,AlN不跟
(已折算成标准状况,AlN不跟 反应),则所得气体的摩尔质量为
反应),则所得气体的摩尔质量为___________  ,该样品中含杂质碳
,该样品中含杂质碳___________ g。
(3)取x g铜镁合金完全溶于10mol/L100mL的浓硝酸中,反应过程中硝酸被还原产生6720mL的 气体和896mL的
气体和896mL的 气体(都已折算到标准状态),在反应后的溶液中加入1mol/L氢氧化钠溶液,生成沉淀质量为18.80g,则x等于
气体(都已折算到标准状态),在反应后的溶液中加入1mol/L氢氧化钠溶液,生成沉淀质量为18.80g,则x等于___________ g,消耗NaOH溶液的体积是___________ mL。
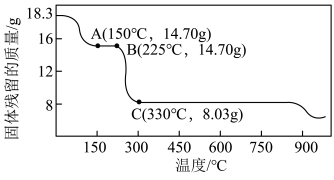
(4)钴及其化合物广泛应用于磁性材料、电池材料及超硬材料等领域。草酸钴是制备钴的氧化物的重要原料,如图为二水合草酸钴( )(M=183g/mol)在空气中受热的质量变化曲线,曲线中300℃及以上所得固体均为钴氧化物,通过计算确定B点剩余固体的化学成分为
)(M=183g/mol)在空气中受热的质量变化曲线,曲线中300℃及以上所得固体均为钴氧化物,通过计算确定B点剩余固体的化学成分为___________ (填化学式),取C点固体用足量的浓盐酸完全溶解可得到黄绿色气体,写出以上反应的离子反应方程式___________ 。
(1)NaH能与水剧烈反应生成氢气,生成的
 标准状况下体积为2.24L时,转移电子的数目
标准状况下体积为2.24L时,转移电子的数目(2)AlN用于电子仪器。AlN中常混有少量碳,将一定量含杂质碳的AlN样品置于密闭反应器中,通入0.18mol的
 ,在高温下充分反应后测得气体的密度为
,在高温下充分反应后测得气体的密度为 (已折算成标准状况,AlN不跟
(已折算成标准状况,AlN不跟 反应),则所得气体的摩尔质量为
反应),则所得气体的摩尔质量为 ,该样品中含杂质碳
,该样品中含杂质碳(3)取x g铜镁合金完全溶于10mol/L100mL的浓硝酸中,反应过程中硝酸被还原产生6720mL的
 气体和896mL的
气体和896mL的 气体(都已折算到标准状态),在反应后的溶液中加入1mol/L氢氧化钠溶液,生成沉淀质量为18.80g,则x等于
气体(都已折算到标准状态),在反应后的溶液中加入1mol/L氢氧化钠溶液,生成沉淀质量为18.80g,则x等于(4)钴及其化合物广泛应用于磁性材料、电池材料及超硬材料等领域。草酸钴是制备钴的氧化物的重要原料,如图为二水合草酸钴(
 )(M=183g/mol)在空气中受热的质量变化曲线,曲线中300℃及以上所得固体均为钴氧化物,通过计算确定B点剩余固体的化学成分为
)(M=183g/mol)在空气中受热的质量变化曲线,曲线中300℃及以上所得固体均为钴氧化物,通过计算确定B点剩余固体的化学成分为
您最近一年使用:0次
解题方法
2 . 非金属元素及其化合物在生产、生活和科研中应用广泛。回答下列问题:
(1)As4S4俗称雄黄,其中基态砷原子外围电子排布式为___________ 。
(2)HOCH2CN分子中含有的σ键与π键数目之比为___________ ,该化合物中处于同周期的元素中第一电离能由大到小的顺序为:___________
(3)三硝基胺N(NO2)3(其结构为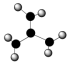 )是一种新型的火箭燃料,因硝基吸电子能力强,中心N原子上无孤电子对,则中心N原子的杂化方式为
)是一种新型的火箭燃料,因硝基吸电子能力强,中心N原子上无孤电子对,则中心N原子的杂化方式为___________ ,并且与三个硝基中的N构成___________ 形。
(4)甘氨酸(H2NCH2COOH)是最简单的一种氨基酸,其相对分子质量为75,而戊烷相对分子质量为72,与甘氨酸相差不大,但甘氨酸易溶解于水,戊烷却难溶解于水,出现这种差异的原因是___________ 。
(5)NH3易与Cu2+形成[Cu(NH3)4]2+配离子,在该配离子中H-N-H键角比NH3分子中H-N-H键角大的原因是___________ 。[Cu(NH3)4]2+中2个NH3被2个H2O取代,得到两种结构的配离子,则[Cu(NH3)4]2+的空间构型是___________ 。
(6)某立方磷青铜晶体的晶胞结构如图所示。
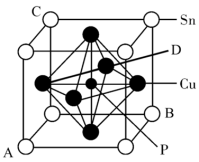
①原子分数坐标可表示晶胞内部各原子的相对位置,图中各原子分数坐标:A为(0,0,0),B为(1,1,0),C为(0,1,1),则D原子的分数坐标为___________ 。
②若晶体密度为ρg/cm-3,最近的Cu原子核间距为___________ pm(用含ρ、NA的代数式表示)。
(1)As4S4俗称雄黄,其中基态砷原子外围电子排布式为
(2)HOCH2CN分子中含有的σ键与π键数目之比为
(3)三硝基胺N(NO2)3(其结构为
 )是一种新型的火箭燃料,因硝基吸电子能力强,中心N原子上无孤电子对,则中心N原子的杂化方式为
)是一种新型的火箭燃料,因硝基吸电子能力强,中心N原子上无孤电子对,则中心N原子的杂化方式为(4)甘氨酸(H2NCH2COOH)是最简单的一种氨基酸,其相对分子质量为75,而戊烷相对分子质量为72,与甘氨酸相差不大,但甘氨酸易溶解于水,戊烷却难溶解于水,出现这种差异的原因是
(5)NH3易与Cu2+形成[Cu(NH3)4]2+配离子,在该配离子中H-N-H键角比NH3分子中H-N-H键角大的原因是
(6)某立方磷青铜晶体的晶胞结构如图所示。

①原子分数坐标可表示晶胞内部各原子的相对位置,图中各原子分数坐标:A为(0,0,0),B为(1,1,0),C为(0,1,1),则D原子的分数坐标为
②若晶体密度为ρg/cm-3,最近的Cu原子核间距为
您最近一年使用:0次
解题方法
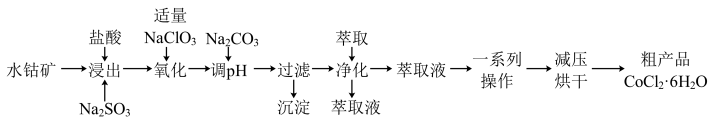
3 . CoCl2·6H2O是一种饲料营养强化剂。一种利用水钴矿(主要成分为Co2O3、Co(OH)3,还含少量Fe2O3、Al2O3、MnO等)制取CoCl2·6H2O的工艺流程如下:
已知:①CoCl2·6H2O熔点为86℃,加热至110~120℃时,易分解。
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:(金属离子浓度为0.01mol/L)
(1)已知氧化性Co3+ >Fe3+,浸出液中含有的阳离子主要有H+、___________ 、Na+、Fe2+、Mn2+、Al3+等。
(2)在“氧化”步骤中,发生的主要离子反应方程式为___________ 。
(3)加Na2CO3调pH可得到两种沉淀,则pH最佳范围是___________ 。
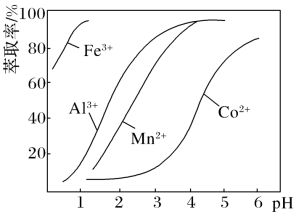
(4)已知萃取剂对金属离子的萃取率与pH的关系如图。控制溶液pH为3.0~3.5,则加入萃取剂的目的是除去___________ 。
(5)制得的CoCl2·6H2O在烘干时需减压烘干的原因是___________ 。为测定粗产品中CoCl2·6H2O含量,称取3.00 g的粗产品溶于水,加入足量AgNO3溶液,过滤、洗涤,将沉淀烘干后称其质量为2.87g,则粗产品中CoCl2·6H2O的质量分数为___________ (结果保留三位有效数字)。
(6)某同学用标准硝酸银溶液滴定未知浓度的CoCl2溶液,下列可作为指示剂的是___________(填选项,忽略亚钴离子的颜色干扰)。已知几种物质在20℃时的颜色及Ksp值如下表:

已知:①CoCl2·6H2O熔点为86℃,加热至110~120℃时,易分解。
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:(金属离子浓度为0.01mol/L)
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(2)在“氧化”步骤中,发生的主要离子反应方程式为
(3)加Na2CO3调pH可得到两种沉淀,则pH最佳范围是
(4)已知萃取剂对金属离子的萃取率与pH的关系如图。控制溶液pH为3.0~3.5,则加入萃取剂的目的是除去

(5)制得的CoCl2·6H2O在烘干时需减压烘干的原因是
(6)某同学用标准硝酸银溶液滴定未知浓度的CoCl2溶液,下列可作为指示剂的是___________(填选项,忽略亚钴离子的颜色干扰)。已知几种物质在20℃时的颜色及Ksp值如下表:
| 化学式 | AgCl | AgSCN | Ag2S | Ag2CrO4 |
| 颜色 | 白色 | 浅黄色 | 黑色 | 红色 |
| Ksp | 2.0×10-10 | 1.0×10-12 | 2.0 ×10-48 | 2.0×10-12 |
| A.KCl | B.KSCN | C.K2CrO4 | D.K2S |
您最近一年使用:0次
名校
4 . 2022年1月24日,习近平总书记在十九届中共中央政治局第三十六次集中学习时强调,实现碳达峰碳中和是贯彻新发展理念、构建新发展格局、推动高质量发展的内在要求。因此,二氧化碳的合理利用成为研究热点。
研究证明,CO2可作为合成低碳烯烃的原料,目前利用CO2合成乙烯相关的热化学方程式如下:
反应i:CO2(g)+3H2(g)═CH3OH(g)+H2O(g) △H1═﹣49.0kJ•mol﹣1
反应ii:2CH3OH═CH3OCH3(g)+H2O(g) △H2=﹣24.52kJ•mol﹣1
反应iii:CH3OCH3═C2H4(g)+H2O(g) △H3=﹣5.46kJ•mol﹣1
反应iv:2CO2(g)+6H2(g)═C2H4(g)+4H2O(g) △H4
(1)反应i为反应_______ (填“放热”或“吸热”),能正确表示该反应的图示是_______ (填标号)。

(2)二甲醚(CH3OCH3)被誉为“21世纪的清洁燃料,以CO2、H2为原料制备二甲醚涉及的主要反应如下:
I.2CO2(g)+6H2(g)⇌CH3OCH3(g)+3H2O(g) ΔH1=﹣122.5kJ/mol
II.CO2(g)+H2(g)⇌CO(g)+H2O(g) ΔH2=+41.1kJ/mol
①在压强、CO2和H2的起始投料一定的条件下,发生反应I、II,实验测得CO2平衡转化率和平衡时CH3OCH3的选择性随温度的变化如图所示。(已知:CH3OCH3的选择性=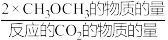 ×100%)
×100%)

其中表示平衡时CH3OCH3的选择性的曲线是_______ (填“①”或“②”);温度高于300℃时,曲线②随温度升高而升高的原因是_______ 。
②对于反应II的反应速率v=v正﹣v逆=k正p(CO2)•p(H2)﹣k逆p(CO)•p(H2O),其中k正、k逆分别为正、逆反应速率常数,p为气体的分压(分压=总压×物质的量分数)。
a.降低温度,k正﹣k逆_______ (填“增大”、“减小”或”不变”);
b.在一定温度和压强下的反应II,按照n(H2):n(CO2)=1:1投料,CO2转化率为50%时,v(正):v(逆)=3:4,用气体分压表示的平衡常数Kp=_______ 。
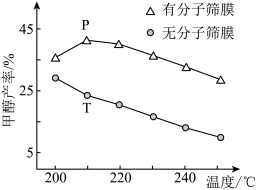
(3)用H2还原CO2可以合成CH3OH:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)。恒压下,CO2和H2的起始物质的量之比为1:3时,该反应在无分子筛膜时甲醇的平衡产率和有分子筛膜(能选择性分离出H2O)时甲醇的产率随温度的变化如图所示。P点甲醇产率高于T点的原因为_______ 。
研究证明,CO2可作为合成低碳烯烃的原料,目前利用CO2合成乙烯相关的热化学方程式如下:
反应i:CO2(g)+3H2(g)═CH3OH(g)+H2O(g) △H1═﹣49.0kJ•mol﹣1
反应ii:2CH3OH═CH3OCH3(g)+H2O(g) △H2=﹣24.52kJ•mol﹣1
反应iii:CH3OCH3═C2H4(g)+H2O(g) △H3=﹣5.46kJ•mol﹣1
反应iv:2CO2(g)+6H2(g)═C2H4(g)+4H2O(g) △H4
(1)反应i为反应

(2)二甲醚(CH3OCH3)被誉为“21世纪的清洁燃料,以CO2、H2为原料制备二甲醚涉及的主要反应如下:
I.2CO2(g)+6H2(g)⇌CH3OCH3(g)+3H2O(g) ΔH1=﹣122.5kJ/mol
II.CO2(g)+H2(g)⇌CO(g)+H2O(g) ΔH2=+41.1kJ/mol
①在压强、CO2和H2的起始投料一定的条件下,发生反应I、II,实验测得CO2平衡转化率和平衡时CH3OCH3的选择性随温度的变化如图所示。(已知:CH3OCH3的选择性=
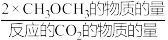 ×100%)
×100%)
其中表示平衡时CH3OCH3的选择性的曲线是
②对于反应II的反应速率v=v正﹣v逆=k正p(CO2)•p(H2)﹣k逆p(CO)•p(H2O),其中k正、k逆分别为正、逆反应速率常数,p为气体的分压(分压=总压×物质的量分数)。
a.降低温度,k正﹣k逆
b.在一定温度和压强下的反应II,按照n(H2):n(CO2)=1:1投料,CO2转化率为50%时,v(正):v(逆)=3:4,用气体分压表示的平衡常数Kp=
(3)用H2还原CO2可以合成CH3OH:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)。恒压下,CO2和H2的起始物质的量之比为1:3时,该反应在无分子筛膜时甲醇的平衡产率和有分子筛膜(能选择性分离出H2O)时甲醇的产率随温度的变化如图所示。P点甲醇产率高于T点的原因为

您最近一年使用:0次
名校
解题方法
5 . I.图中甲装置为CH3OCH3碱性燃料电池,其电极均为Pt电极。装置乙中,C、D电极为Pb电极,其表面均覆盖着PbSO4,其电解液为稀H2SO4溶液。

(1)写出甲装置中B极的电极反应式_______ 。
(2)写出乙装置中D极的电极反应式_______ 。
(3)当有46g二甲醚参加反应时,电路中通过的电子的物质的量为_______ mol。
Ⅱ.实验室常利用甲醛法测定(NH4)2SO4样品中氮的质量分数,其反应原理为4NH +6HCHO=6H2O+3H++(CH2)6N4H+[滴定时,1mol(CH2)6N4H+与1molH+相当],然后用NaOH标准溶液滴定反应生成的酸。
+6HCHO=6H2O+3H++(CH2)6N4H+[滴定时,1mol(CH2)6N4H+与1molH+相当],然后用NaOH标准溶液滴定反应生成的酸。
某兴趣小组用甲醛法进行了如下实验:
步骤I:称取样品1.400g。
步骤Ⅱ:将样品溶解后,完全转移到250mL容量瓶中,定容,充分摇匀。
步骤Ⅲ:移取25.00nL样品溶液于250mL锥形瓶中,加入10mL20%的中性甲醛溶液,摇匀、静置5min后,加入1~2滴酚酞试液,用NaOH标准溶液滴定至终点。按上述操作方法再重复2次。
(4)根据步骤Ⅲ填空:判断滴定终点的现象是锥形瓶中溶液_______ 。
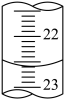
(5)如图是某次滴定时的滴定管中的液面,其读数为_______ mL。
(6)某实验小组的实验数据如下表所示,根据表中数据计算:
若NaOH标准溶液的浓度为0.100mol∙L-1,则该样品中氮的质量分数为_______ 。

(1)写出甲装置中B极的电极反应式
(2)写出乙装置中D极的电极反应式
(3)当有46g二甲醚参加反应时,电路中通过的电子的物质的量为
Ⅱ.实验室常利用甲醛法测定(NH4)2SO4样品中氮的质量分数,其反应原理为4NH
 +6HCHO=6H2O+3H++(CH2)6N4H+[滴定时,1mol(CH2)6N4H+与1molH+相当],然后用NaOH标准溶液滴定反应生成的酸。
+6HCHO=6H2O+3H++(CH2)6N4H+[滴定时,1mol(CH2)6N4H+与1molH+相当],然后用NaOH标准溶液滴定反应生成的酸。某兴趣小组用甲醛法进行了如下实验:
步骤I:称取样品1.400g。
步骤Ⅱ:将样品溶解后,完全转移到250mL容量瓶中,定容,充分摇匀。
步骤Ⅲ:移取25.00nL样品溶液于250mL锥形瓶中,加入10mL20%的中性甲醛溶液,摇匀、静置5min后,加入1~2滴酚酞试液,用NaOH标准溶液滴定至终点。按上述操作方法再重复2次。
(4)根据步骤Ⅲ填空:判断滴定终点的现象是锥形瓶中溶液
(5)如图是某次滴定时的滴定管中的液面,其读数为

(6)某实验小组的实验数据如下表所示,根据表中数据计算:
| 滴定次数 | 待测溶液的体积/mL | 标准溶液的体积 | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 25.00 | 1.02 | 21.03 |
| 2 | 25.00 | 2.00 | 21.99 |
| 3 | 25.00 | 0.20 | 20.20 |
您最近一年使用:0次
名校
解题方法
6 . 下列叙述中不正确的是
A.一定浓度的醋酸钠溶液可使酚酞溶液变红,其原因是发生了如下反应: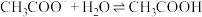 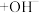 ,使溶液中 ,使溶液中 |
B.常温下,10 0.02 0.02 盐酸与10 盐酸与10 0.02 0.02  溶液混合,若混合后溶液的体积为20 溶液混合,若混合后溶液的体积为20 ,则溶液的 ,则溶液的 |
C.0.1  溶液中: 溶液中: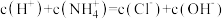 |
D.浓度均为1 的 的 溶液与盐酸等体积混合,混合溶液中: 溶液与盐酸等体积混合,混合溶液中: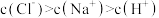  |
您最近一年使用:0次
2023-02-15更新
|
182次组卷
|
6卷引用:宁夏贺兰县景博中学2022-2023学年高二上学期第二次月考化学试题
名校
解题方法
7 . 回答下列问题:
(1)甲醇气相脱水制甲醚的反应为:2CH3OH(g) CH3OCH3(g)+H2O(g),200℃时,向恒容密闭容器中充入一定量的CH3OH(g)发生上述反应,测得CH3OH(g)的浓度随时间(t)的变化如表:
CH3OCH3(g)+H2O(g),200℃时,向恒容密闭容器中充入一定量的CH3OH(g)发生上述反应,测得CH3OH(g)的浓度随时间(t)的变化如表:
①10~30min内,用CH3OCH3(g)表示该反应的平均速率为_______ 。
②该反应在200℃时的平衡常数Kp=_______ (以分压表示,分压=总压×物质的量分数)。
③200℃时,向该容器中投入三种成分的浓度如表:
该时刻,正、逆反应速率的大小关系为:v正(CH3OH)_______ v逆(CH3OH)(填“>”“<”或“=”)
(2)室温下,探究 NH4HCO3溶液的性质。
①室温时,NH4HCO3溶液显_______ (填“酸性”、“碱性”或“中性”)。
②将浓度均为0.1mol/L的NH4HCO3溶液与Ba(OH)2溶液等体积混合,产生白色沉淀和刺激性气味的气体,则白色沉淀的化学式为_______ 。
③向1mol/L的NH4HCO3溶液中加入0.1mol/L的AlCl3溶液,发生剧烈的反应,则反应的现象为_______ 。
(3)由重晶石矿 (主要成分是 , 还含有
, 还含有  等杂质)可制得氯化钡晶体,某兴趣小组设计实验流程如下。
等杂质)可制得氯化钡晶体,某兴趣小组设计实验流程如下。

①浸取将固体由块状变为粉末状,可以加快浸取的速率。将固体由块状变为粉末状的仪器名称为:_______ 。
②为提高产品产率, 结晶得到的氯化钡晶体常用_______ 进行洗涤。
(1)甲醇气相脱水制甲醚的反应为:2CH3OH(g)
 CH3OCH3(g)+H2O(g),200℃时,向恒容密闭容器中充入一定量的CH3OH(g)发生上述反应,测得CH3OH(g)的浓度随时间(t)的变化如表:
CH3OCH3(g)+H2O(g),200℃时,向恒容密闭容器中充入一定量的CH3OH(g)发生上述反应,测得CH3OH(g)的浓度随时间(t)的变化如表:| t/min | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
| c(CH3OH)/(mol•L-1) | 1.00 | 0.65 | 0.50 | 0.36 | 0.27 | 0.20 | 0.20 |
②该反应在200℃时的平衡常数Kp=
③200℃时,向该容器中投入三种成分的浓度如表:
| 物质 | CH3OH(g) | CH3OCH3(g) | H2O(g) |
| c/(mol•L-1) | 0.54 | 0.68 | 0.68 |
(2)室温下,探究 NH4HCO3溶液的性质。
| NH3•H2O | H2CO3 |
| Kb=1.8×10-5 | Ka1=4.4×10-7 Ka2=4.7×10-11 |
②将浓度均为0.1mol/L的NH4HCO3溶液与Ba(OH)2溶液等体积混合,产生白色沉淀和刺激性气味的气体,则白色沉淀的化学式为
③向1mol/L的NH4HCO3溶液中加入0.1mol/L的AlCl3溶液,发生剧烈的反应,则反应的现象为
(3)由重晶石矿 (主要成分是
 , 还含有
, 还含有  等杂质)可制得氯化钡晶体,某兴趣小组设计实验流程如下。
等杂质)可制得氯化钡晶体,某兴趣小组设计实验流程如下。
①浸取将固体由块状变为粉末状,可以加快浸取的速率。将固体由块状变为粉末状的仪器名称为:
②为提高产品产率, 结晶得到的氯化钡晶体常用
您最近一年使用:0次
解题方法
8 . 用中和滴定法测定某烧碱样品的纯度,试根据实验回答下列问题:
(1)准确称量8.2 g 含有少量中性易溶杂质的样品,配成500 mL 待测溶液。称量时,样品可放在_______ (填编号字母)称量。
A.小烧杯中 B.洁净纸片上 C.托盘上
(2)滴定时,用0.2000 mol·L-1的盐酸来滴定待测溶液,不可选用_______ (填编号字母)作指示剂。
A.甲基橙 B.石蕊 C.酚酞
(3)滴定过程中,眼睛应注视_______ ;在铁架台上垫一张白纸,其目的是_______
(4)根据下表数据,计算被测烧碱溶液的物质的量浓度是_______ mol·L-1,烧碱样品的纯度是_______ 。
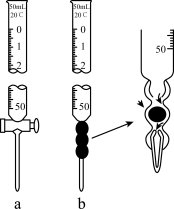
(5)如下图所示仪器a是_______ 滴定管、仪器b是_______ 滴定管,滴定时除上述两种滴定管、铁架台、滴定管夹外,还需要_______ 、_______ 。
(6)已知草酸是二元弱酸,常温下测得0.1 mol·L-1的KHC2O4的pH为4.8,则此KHC2O4溶液中c( )
)_______ c(H2C2O4)(填“大于”“小于”或“等于”)。
(7)常温下pH=11的CH3COONa溶液中由水电离产生的c(OH—)=_______ ,将此溶液加水稀释,则pH_______ (填“增大”或“减小”)。
(1)准确称量8.2 g 含有少量中性易溶杂质的样品,配成500 mL 待测溶液。称量时,样品可放在
A.小烧杯中 B.洁净纸片上 C.托盘上
(2)滴定时,用0.2000 mol·L-1的盐酸来滴定待测溶液,不可选用
A.甲基橙 B.石蕊 C.酚酞
(3)滴定过程中,眼睛应注视
(4)根据下表数据,计算被测烧碱溶液的物质的量浓度是
| 滴定次数 | 待测溶液体积(mL) | 标准酸体积 | |
| 滴定前的刻度(mL) | 滴定后的刻度(mL) | ||
| 第一次 | 10.00 | 0.40 | 20.50 |
| 第二次 | 10.00 | 4.10 | 24.00 |

(6)已知草酸是二元弱酸,常温下测得0.1 mol·L-1的KHC2O4的pH为4.8,则此KHC2O4溶液中c(
 )
)(7)常温下pH=11的CH3COONa溶液中由水电离产生的c(OH—)=
您最近一年使用:0次
解题方法
9 . 某无色溶液500mL,仅仅由Na+、Cu2+、Ba2+、Mg2+、OH-、HCO 、SO
、SO 、Cl-中的若干离子组成,取适量的该溶液进行如下实验:(气体体积均在标况下测得)
、Cl-中的若干离子组成,取适量的该溶液进行如下实验:(气体体积均在标况下测得)

(1)不做任何实验就能确定不存在的离子为:_______ ;气体A的化学式为:_______ ;
(2)实验②涉及的离子反应方程式为:_______ ;
(3)通过实验能确定不存在的离子为:_______ ;
(4)原溶液中一定含有的阳离子为:_______ ;不能确定的离子为:_______ ;
(5)若仅仅存在可确定的离子,则阳离子的物质的量浓度为:_______ ;
(6)如何检验可能存在的离子?请设计实验。_______
 、SO
、SO 、Cl-中的若干离子组成,取适量的该溶液进行如下实验:(气体体积均在标况下测得)
、Cl-中的若干离子组成,取适量的该溶液进行如下实验:(气体体积均在标况下测得)
(1)不做任何实验就能确定不存在的离子为:
(2)实验②涉及的离子反应方程式为:
(3)通过实验能确定不存在的离子为:
(4)原溶液中一定含有的阳离子为:
(5)若仅仅存在可确定的离子,则阳离子的物质的量浓度为:
(6)如何检验可能存在的离子?请设计实验。
您最近一年使用:0次
10 . 根据下列氧化还原反应:
①2I-+Cl2=I2+2Cl-;
②2Fe3++2I-=2Fe2++I2;
③2Fe2++Cl2=2Fe3++2Cl-;
④2MnO +10Cl-+16H+=2Mn2++5Cl2+8H2O。
+10Cl-+16H+=2Mn2++5Cl2+8H2O。
下列结论中正确的是
①2I-+Cl2=I2+2Cl-;
②2Fe3++2I-=2Fe2++I2;
③2Fe2++Cl2=2Fe3++2Cl-;
④2MnO
 +10Cl-+16H+=2Mn2++5Cl2+8H2O。
+10Cl-+16H+=2Mn2++5Cl2+8H2O。下列结论中正确的是
A.Mn2+是MnO 的氧化产物,I2是I-的还原产物 的氧化产物,I2是I-的还原产物 |
B.氧化性强弱顺序为:MnO >Cl2>Fe3+>I2 >Cl2>Fe3+>I2 |
| C.反应②中Fe3+被氧化,I-被还原 |
D.在溶液中不可能发生反应:MnO +5Fe2++8H+=Mn2++5Fe3++4H2O +5Fe2++8H+=Mn2++5Fe3++4H2O |
您最近一年使用:0次



