11-12高三上·山西·单元测试
名校
解题方法
1 . 向含有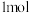
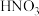 和
和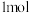
 的混合溶液中逐渐加入铁粉至过量,溶液中金属阳离子a、b与所加铁粉的物质的量的关系如图所示(已知稀硝酸的还原产物只有
的混合溶液中逐渐加入铁粉至过量,溶液中金属阳离子a、b与所加铁粉的物质的量的关系如图所示(已知稀硝酸的还原产物只有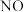 )。下列有关判断不正确的是
)。下列有关判断不正确的是
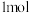
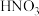 和
和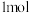
 的混合溶液中逐渐加入铁粉至过量,溶液中金属阳离子a、b与所加铁粉的物质的量的关系如图所示(已知稀硝酸的还原产物只有
的混合溶液中逐渐加入铁粉至过量,溶液中金属阳离子a、b与所加铁粉的物质的量的关系如图所示(已知稀硝酸的还原产物只有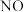 )。下列有关判断不正确的是
)。下列有关判断不正确的是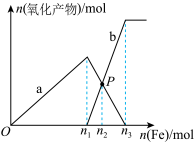
A.a表示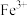 的关系曲线 的关系曲线 |
B. =0.75 =0.75 |
C.P点时,n(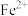 )=0.5625mol )=0.5625mol |
| D.向P点溶液中加入铜粉,最多可溶解14.4g |
您最近一年使用:0次
2024-01-10更新
|
837次组卷
|
16卷引用:辽宁省沈阳市第四十中学2021-2022年高一下学期4月份线上教学效果检测化学试题
辽宁省沈阳市第四十中学2021-2022年高一下学期4月份线上教学效果检测化学试题河南省商丘市第一高级中学2021-2022学年高一下学期期中考试化学试题陕西省西安中学 2023 届高三上学期第二次质量检测化学试题辽宁省重点高中沈阳市郊联体2023-2024学年高一上学期期末考试化学试题(已下线)2011-2012学年山西省高三上学期第二次阶段性测试化学试卷2016届浙江省杭州高级中学高三上学期月考(三)化学试卷【全国百强校】安徽省合肥市第六中学2018-2019学年高一下学期开学考试化学试题(已下线)2019年8月11日《每日一题》2020年高考一轮复习—— 每周一测(已下线)专题3.3 铁及其重要化合物(练)——2020年高考化学一轮复习讲练测人教版2019必修第二册 第五章 本章复习提升湖南省长沙市第一中学2019-2020学年高一上学期第二次阶段性检测(月考)化学试题西安市第八十三中学2022-2023学年高一下学期第一次月考化学试题新疆乌鲁木齐市新疆生产建设兵团第二中学2023-2024学年高一上学期期末考试化学试卷 (已下线)热点02 氮及其化合物浙江省杭州市源清中学2023-2024学年高一上学期期末考试化学试题黑龙江省双鸭山市第一中学2023-2024学年高一下学期4月月考化学试题
2022高三·全国·专题练习
名校
解题方法
2 . 恒温恒容的密闭容器中,某催化剂表面发生氨的分解反应: ,测得不同起始浓度和催化剂表面积下氨的浓度随时间的变化
,测得不同起始浓度和催化剂表面积下氨的浓度随时间的变化
下列说法不正确的是
 ,测得不同起始浓度和催化剂表面积下氨的浓度随时间的变化
,测得不同起始浓度和催化剂表面积下氨的浓度随时间的变化| 编号 | 时间/min 表面积/cm  | 0 | 20 | 40 | 60 | 80 |
| ① | a | 2.40 | 2.00 | 1.60 | 1.20 | 0.80 |
| ② | a | 1.20 | 0.80 | 0.40 | x | |
| ③ | 2a | 2.40 | 1.60 | 0.80 | 0.40 | 0.40 |
A.实验①,0∼40min,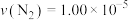 mol⋅L mol⋅L ∙min ∙min |
| B.相同条件下,增加氨气的浓度,反应速率增大 |
| C.相同条件下,增加催化剂的表面积,反应速率增大 |
D.实验②,60min时处于平衡状态, |
您最近一年使用:0次
2023-11-23更新
|
94次组卷
|
31卷引用:辽宁省朝阳市建平县实验中学2022-2023学年高二上学期第一次月考化学试题
辽宁省朝阳市建平县实验中学2022-2023学年高二上学期第一次月考化学试题辽宁省营口市2022-2023学年高三上学期期末考试化学试题(已下线)考点21 化学反应速率-备战2023年高考化学一轮复习考点帮(全国通用)黑龙江省双鸭山市第一中学2021-2022学年高一下学期期末考试化学试题黑龙江省鹤岗市第一中学2021-2022学年高一下学期期末考试化学试题(已下线)第16练 化学反应的速率与限度-2023年高考化学一轮复习小题多维练(全国通用)(已下线)第20讲 化学反应速率(练)-2023年高考化学一轮复习讲练测(全国通用)浙江省浙里卷天下2022-2023学年高三8月开学测试化学试题江西省新余市第一中学2022-2023学年高二上学期开学考试化学试题(已下线)第19讲 化学平衡(讲)-2023年高考化学一轮复习讲练测(新教材新高考)(已下线)易错点21 化学反应速率-备战2023年高考化学考试易错题(已下线)易错点22 化学反应平衡和移动-备战2023年高考化学考试易错题天津市五校(杨村宝坻蓟州芦台静海一中)2022-2023学年高二上学期期中考试化学试题黑龙江省佳木斯市第一中学2022-2023学年高三上学期第三次调研化学试题(已下线)2023年1月浙江省普通高校招生选考科目考试化学仿真模拟试卷A(已下线)化学预测卷(五)-预测卷(浙江专版)安徽省合肥一六八中学2022-2023学年高二上学期化学学科学情调研试题上海市奉贤区2022-2023学年高三上学期一模练习卷化学试题北京师范大学附属中学2022-2023学年高二上学期10月月考化学试题(已下线)专题09 化学反应速率与化学平衡(讲)-2023年高考化学二轮复习讲练测(新高考专用)安徽省六安第一中学2022-2023学年高二上学期期末考试化学试题(已下线)第13练 化学反应速率与化学平衡的综合考查 -2023年【暑假分层作业】高二化学(2024届一轮复习通用)(已下线)考点21 化学反应速率(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)专题11 化学反应速率与化学平衡-2023年高考化学真题题源解密(全国通用)第二章 章末训练(已下线)考点2 化学平衡 (核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)河南省周口恒大中学2023-2024学年高二上学期11月期中考试化学试题吉林省长春市第二实验中学2023-2024学年高二上学期10月月考化学试题(已下线)题型10 反应微观机理分析 速率方程及其应用-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)上海市建平世纪中学2023-2024学年高二上学期阶段练习二 化学(等级)试题安徽省淮北市树人高级中学2023-2024学年高二下学期开学考试化学试题
3 .  催化重整对温室气体的减排具有重要意义,其反应为:
催化重整对温室气体的减排具有重要意义,其反应为: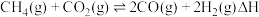 。回答下列问题:
。回答下列问题:
(1)已知相关物质的燃烧热(
 ):
):
则 催化重整反应的
催化重整反应的
_______  。
。
(2)将原料按初始组成
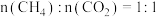 充入密闭容器中,保持体系压强为
充入密闭容器中,保持体系压强为
 发生反应。达到平衡时,
发生反应。达到平衡时,
 体积分数与温度的关系如图所示。
体积分数与温度的关系如图所示。
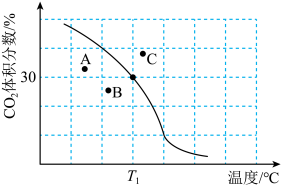
①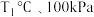 下,n(平衡时气体):n(初始气体)=
下,n(平衡时气体):n(初始气体)=_______ 。该温度下,此反应的平衡常数
_______  (以分压表示,分压=总压强×气体成分的物质的量分数。保留1位小数)。
(以分压表示,分压=总压强×气体成分的物质的量分数。保留1位小数)。
②若A、B、C三点表示不同温度和压强下达到平衡时 的体积分数,则
的体积分数,则_______ 点对应的平衡常数最小,理由是_______ 。
(3)其他条件相同,在不同催化剂(A、B)作用下,反应
 进行相同时间后,
进行相同时间后,
 的产率随反应温度的变化如图所示。
的产率随反应温度的变化如图所示。

①在催化剂A、B作用下,它们正、逆反应活化能差值分别用 表示,则
表示,则
_______  (填“>”“<”或“=”,下同)。
(填“>”“<”或“=”,下同)。
②y点对应的
_______ z点对应的 。
。
(4) 和
和
 都是比较稳定的分子,科学家利用电化学装置实现两种分子的耦合转化,其原理如图所示:
都是比较稳定的分子,科学家利用电化学装置实现两种分子的耦合转化,其原理如图所示:
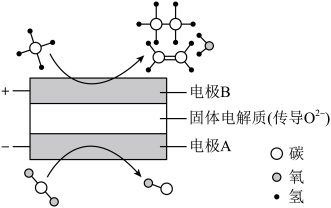
①阴极的电极反应式为_______ 。
②若生成的乙烯和乙烷的体积比为 ,则消耗的
,则消耗的 和
和 的体积比为
的体积比为_______ 。
 催化重整对温室气体的减排具有重要意义,其反应为:
催化重整对温室气体的减排具有重要意义,其反应为: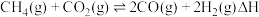 。回答下列问题:
。回答下列问题:(1)已知相关物质的燃烧热(
 ):
):| 物质 |  |  |  |
燃烧热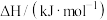 |  |  |  |
 催化重整反应的
催化重整反应的
 。
。(2)将原料按初始组成
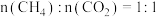 充入密闭容器中,保持体系压强为
充入密闭容器中,保持体系压强为 发生反应。达到平衡时,
发生反应。达到平衡时, 体积分数与温度的关系如图所示。
体积分数与温度的关系如图所示。
①
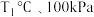 下,n(平衡时气体):n(初始气体)=
下,n(平衡时气体):n(初始气体)=
 (以分压表示,分压=总压强×气体成分的物质的量分数。保留1位小数)。
(以分压表示,分压=总压强×气体成分的物质的量分数。保留1位小数)。②若A、B、C三点表示不同温度和压强下达到平衡时
 的体积分数,则
的体积分数,则(3)其他条件相同,在不同催化剂(A、B)作用下,反应
 进行相同时间后,
进行相同时间后, 的产率随反应温度的变化如图所示。
的产率随反应温度的变化如图所示。
①在催化剂A、B作用下,它们正、逆反应活化能差值分别用
 表示,则
表示,则
 (填“>”“<”或“=”,下同)。
(填“>”“<”或“=”,下同)。②y点对应的

 。
。(4)
 和
和 都是比较稳定的分子,科学家利用电化学装置实现两种分子的耦合转化,其原理如图所示:
都是比较稳定的分子,科学家利用电化学装置实现两种分子的耦合转化,其原理如图所示:
①阴极的电极反应式为
②若生成的乙烯和乙烷的体积比为
 ,则消耗的
,则消耗的 和
和 的体积比为
的体积比为
您最近一年使用:0次
2023-10-29更新
|
681次组卷
|
4卷引用:辽宁省锦州市渤大附中2022-2023学年高三上学期期末考试化学试题
4 . 某研究小组欲从含少量 、
、 、
、 、
、 的
的 溶液中制纯净的无水
溶液中制纯净的无水 固体,设计的流程如下:
固体,设计的流程如下:

常温下,几种金属离子沉淀完全(离子浓度小于 )时的
)时的 如表所示:
如表所示:
回答下列问题:
(1)实验室用 配制
配制 溶液的方法是
溶液的方法是___________
(2)加入 ,发生反应的离子方程式为
,发生反应的离子方程式为___________ ;“过滤2”得到的沉淀是___________ (填化学式)。
(3)常温时,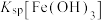 、
、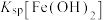 、
、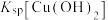 、
、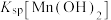 中数值最大的为
中数值最大的为___________ ;第一次“调pH”的最小值为___________ ,第二次“调pH”的最小值为___________ 。已知常温下, 的
的 ,
, 的氨水的pH=
的氨水的pH=___________ (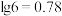 )。
)。
(4)“一系列操作”包括___________ 、洗涤、干燥;由 制无水
制无水 的操作是
的操作是___________ 。
 、
、 、
、 、
、 的
的 溶液中制纯净的无水
溶液中制纯净的无水 固体,设计的流程如下:
固体,设计的流程如下:
常温下,几种金属离子沉淀完全(离子浓度小于
 )时的
)时的 如表所示:
如表所示:| 金属离子 |  |  |  |  |
沉淀完全时的 | 2.8 | 8.3 | 10.1 | 6.7 |
(1)实验室用
 配制
配制 溶液的方法是
溶液的方法是(2)加入
 ,发生反应的离子方程式为
,发生反应的离子方程式为(3)常温时,
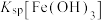 、
、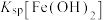 、
、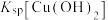 、
、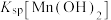 中数值最大的为
中数值最大的为 的
的 ,
, 的氨水的pH=
的氨水的pH=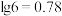 )。
)。(4)“一系列操作”包括
 制无水
制无水 的操作是
的操作是
您最近一年使用:0次
名校
解题方法
5 . 氟铈矿(含CeFCO3、BaO、SiO2等)是稀土元素最主要的来源,其中不仅含有丰富的稀土元素Ce(31.51%,以CeO2计),还含有大量的F资源(8.92%)和其他稀土资源(30.71%,用RE表示),其分离工艺流程如下:

已知:①氧化焙烧时,Ce元素转化成CeO2;
②酸浸后,Ce元素主要以Ce4+形式存在,其他稀土RE主要以RE3+形式存在;
③Ce4+能与F-结合成[CeF2]2+,Al3+能与F-结合成[AlFx]3-x,均易溶于水,难溶于有机溶剂,不能被P204萃取剂萃取。
回答下列问题:
(1)为了提高生产效率,焙烧时可以采取的操作___________ 。
(2)废渣的主要成分是___________ 。
(3)氧化焙烧时及萃取之前,均加入铝盐,其目的是___________ 。
(4)萃取Ce4+时,选用经典的酸性有机萃取剂P204(可用HA表示),萃取的过程可以表示成 ,通过将萃取后的有机相pH值调
,通过将萃取后的有机相pH值调___________ (填“高”或“低”)来将Ce4+从萃取剂中分离出来。
(5)将上述过程中获得Ce4+还原成Ce3+,再加入NH4HCO3溶液,即可获得稀土发光材料Ce2(CO3)3,但实际操作中,通常固体产品中含有少量Ce(OH)3,则当溶液Ce3+恰好完全沉淀时,即 ,
,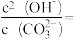
___________ ,为了使该条件下获得的固体产品中不含Ce(OH)3,应控制pH不超过___________ 。(已知常温下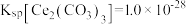 ,
,
(6)水相2中,n(Al):n(F)=1:4,请写出生成Na3AlF6沉淀的离子方程式___________ 。

已知:①氧化焙烧时,Ce元素转化成CeO2;
②酸浸后,Ce元素主要以Ce4+形式存在,其他稀土RE主要以RE3+形式存在;
③Ce4+能与F-结合成[CeF2]2+,Al3+能与F-结合成[AlFx]3-x,均易溶于水,难溶于有机溶剂,不能被P204萃取剂萃取。
回答下列问题:
(1)为了提高生产效率,焙烧时可以采取的操作
(2)废渣的主要成分是
(3)氧化焙烧时及萃取之前,均加入铝盐,其目的是
(4)萃取Ce4+时,选用经典的酸性有机萃取剂P204(可用HA表示),萃取的过程可以表示成
 ,通过将萃取后的有机相pH值调
,通过将萃取后的有机相pH值调(5)将上述过程中获得Ce4+还原成Ce3+,再加入NH4HCO3溶液,即可获得稀土发光材料Ce2(CO3)3,但实际操作中,通常固体产品中含有少量Ce(OH)3,则当溶液Ce3+恰好完全沉淀时,即
 ,
,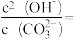
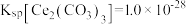 ,
,
(6)水相2中,n(Al):n(F)=1:4,请写出生成Na3AlF6沉淀的离子方程式
您最近一年使用:0次
名校
解题方法
6 . 从猫薄荷植物中分离出来的荆芥内酯,可用来制取具有驱虫效能的二氢荆芥内酯。为研究二氢荆芥内酯的合成和性质,进行了如下反应。
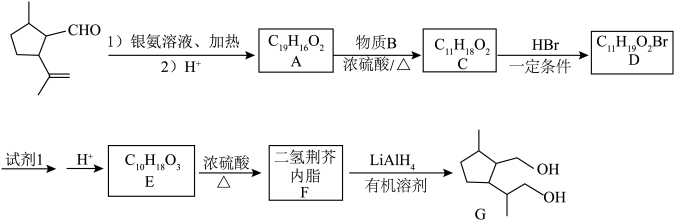
(1)物质B的名称是___________ 。
(2)C中官能团的结构式为___________ 。
(3)D中有3个甲基,则D的结构简式为___________ 。
(4)试剂1为___________ 。
(5)A、F互为同分异构体,则E→F的化学方程式为____________ 。
(6)H是E的同系物,且比E少两个碳原子。满足下列条件的H的同分异构体有___________ 种(不考虑立体异构);其中被氧化后核磁共振氢谱有三组峰,面积比为1:1:4的有机物的结构简式为___________ 。
①有两个取代基的六元碳环;②1mol该同分异构体分别与足量的Na和NaHCO3反应生成气体物质的量相同。

(1)物质B的名称是
(2)C中官能团的结构式为
(3)D中有3个甲基,则D的结构简式为
(4)试剂1为
(5)A、F互为同分异构体,则E→F的化学方程式为_
(6)H是E的同系物,且比E少两个碳原子。满足下列条件的H的同分异构体有
①有两个取代基的六元碳环;②1mol该同分异构体分别与足量的Na和NaHCO3反应生成气体物质的量相同。
您最近一年使用:0次
名校
解题方法
7 . 甲、乙、丙三个容器中起始物质及其物质的量如图所示,三个容器最初的容积、温度相同,反应中甲、丙的容积不变,乙中的压强不变,在一定温度下反应达到平衡。下列说法正确的是


| A.平衡时各容器内c(NO2)的大小顺序为乙>甲>丙 |
| B.平衡时N2O4的百分含量:乙>甲=丙 |
| C.平衡时甲与丙中放出的热量相同 |
D.其它条件不变,向平衡后的丙容器中再加入少量N2O4,新平衡后 的值变大 的值变大 |
您最近一年使用:0次
2023-09-04更新
|
695次组卷
|
3卷引用:辽宁省大连市第八中学2021-2022学年高一下学期期中考试化学试题
名校
8 . 有机物A常用于食品加工和有机合成。以A为原料制备阴离子树脂M和新型聚酯材料N等的合成路线如下∶
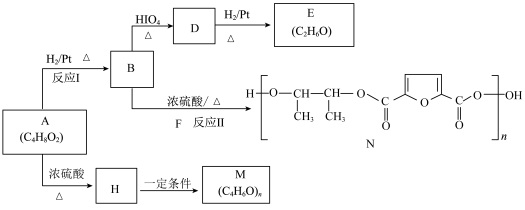
已知:Ⅰ.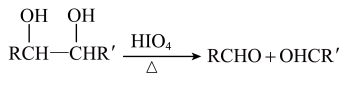
Ⅱ.R-CH=CHO不稳定,很快转化为HR-CH2-CHO
(1)A中官能团的结构简式为___________ ;
(2)反应Ⅱ的方程式是___________ ;
(3)反应A→H的反应类型为___________ ;
(4)下列关于D的说法正确的是___________ ;
a.具有还原性 b.不能与H2发生加成反应
c.能与Na单质反应 d.与NaOH醇溶液共热发生消去反应
(5)F的分子式是___________ ;
(6)请运用题中已知信息,设计由2-丁烯制备乙醛的合成线路流程图(无机试剂任选)∶_____ 。

已知:Ⅰ.

Ⅱ.R-CH=CHO不稳定,很快转化为HR-CH2-CHO
(1)A中官能团的结构简式为
(2)反应Ⅱ的方程式是
(3)反应A→H的反应类型为
(4)下列关于D的说法正确的是
a.具有还原性 b.不能与H2发生加成反应
c.能与Na单质反应 d.与NaOH醇溶液共热发生消去反应
(5)F的分子式是
(6)请运用题中已知信息,设计由2-丁烯制备乙醛的合成线路流程图(无机试剂任选)∶
您最近一年使用:0次
名校
解题方法
9 . 我国已经形成对全球稀土产业链的统治力,在稀土开采技术方面,我国遥遥领先。同时也是最早研究稀土—钴化合物结构的国家。请回答下列问题:
(1)钴原子的价层电子排布图为___________ ,其M层上有___________ 种不同的空间运动状态,Fe和Co的第四电离能I4(Fe)___________ I4(Co)(填“>”、“<”或“=”)。
(2)为某含钴配合物的组成为CoCl3·5NH3·H2O,是该配合物中钴离子的配位数是6,1mol该配合物可以与足量的硝酸银反应生成3molAgCl沉淀,则该配合物的配体是___________ ,试判断NH3分子与钴离子形成配合物后,H—N—H键角会___________ (填“变大”、“变小”或“不变”)。
(3)具有双钙钛矿型结构的晶体通过掺杂改性可用作固体电解质材料。双钙钛矿型晶体的一种典型结构单元如图所示:

①该晶体的一个完整晶胞中含有___________ 个 原子。
原子。
②真实的晶体中存在5%的O原子缺陷,从而能让 在其中传导,已知
在其中传导,已知 为
为 价,
价, 为
为 价,则
价,则 价
价 与
与 价
价 的原子个数比为
的原子个数比为___________ 。
II.下图为石墨和石墨烯的结构示意图,石墨烯是从石墨材料中剥离出来,由碳原子组成的只有一层原子厚度的二维晶体。

(4)下列关于石墨与石墨烯的说法正确的是___________ 。
A.从石墨中剥离石墨烯需要破坏化学键
B.石墨中的碳原子采取 杂化
杂化
C.石墨属于混合型晶体,层与层之间存在分子间作用力
D.层内碳原子间存在共价键
E.石墨烯中平均每个六元碳环含有3个碳原子
(1)钴原子的价层电子排布图为
(2)为某含钴配合物的组成为CoCl3·5NH3·H2O,是该配合物中钴离子的配位数是6,1mol该配合物可以与足量的硝酸银反应生成3molAgCl沉淀,则该配合物的配体是
(3)具有双钙钛矿型结构的晶体通过掺杂改性可用作固体电解质材料。双钙钛矿型晶体的一种典型结构单元如图所示:

①该晶体的一个完整晶胞中含有
 原子。
原子。②真实的晶体中存在5%的O原子缺陷,从而能让
 在其中传导,已知
在其中传导,已知 为
为 价,
价, 为
为 价,则
价,则 价
价 与
与 价
价 的原子个数比为
的原子个数比为II.下图为石墨和石墨烯的结构示意图,石墨烯是从石墨材料中剥离出来,由碳原子组成的只有一层原子厚度的二维晶体。

(4)下列关于石墨与石墨烯的说法正确的是
A.从石墨中剥离石墨烯需要破坏化学键
B.石墨中的碳原子采取
 杂化
杂化C.石墨属于混合型晶体,层与层之间存在分子间作用力
D.层内碳原子间存在共价键
E.石墨烯中平均每个六元碳环含有3个碳原子
您最近一年使用:0次
名校
解题方法
10 . 2020年9月22日,中国政府在联合国大会上提出:“二氧化碳排放力争于2030年前达到峰值,努力争取2060年前实现碳中和。”为了早日实现碳中和,CO2的综合利用也成为了我国科研的研究热点。
Ⅰ. 目前工业上有一种方法是用CO2加氢合成低碳烯烃。现以合成乙烯(C2H4)为例、该过程分两步进行:
第一步: ΔH>0
ΔH>0
第二步: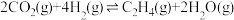 ΔH<0
ΔH<0
(1)定义:在热力学标准状态下,由指定单质生成1mol化合物的反应焓称为该化合物的标准摩尔生成焓,简称生成焓,符号为 。已知:
。已知: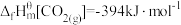 ;
;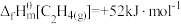 ;
; 。在热力学标准状态下,CO2加氢合成乙烯的热化学方程式为
。在热力学标准状态下,CO2加氢合成乙烯的热化学方程式为___________ 。
(2)有利于提高乙烯平衡产率的条件是___________(填标号)。
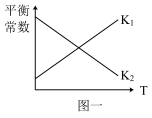
(3)已知上述两步反应的平衡常数与T的关系如图一所示,则第二步反应的平衡常数为___________ (填“K1”或“K2”)
Ⅱ. CO2加氢合成甲醇也是化学固碳的一种有效途径,不仅可以有效减少空气中的CO2排放,而且还能制备出甲醇清洁能源。反应如下:
主反应: ΔH1=-49 kJ⋅mol-1
ΔH1=-49 kJ⋅mol-1
副反应: ΔH2=+41kJ⋅mol-1
ΔH2=+41kJ⋅mol-1
向刚性容器中充入投料比为1:3的CO2和H2,图二中横坐标为在催化剂TiO2条件下反应相同的时间,CO2转化率随温度升高而升高。纵坐标为在该时间内CH3OH选择性和CO选择性(CH3OH的选择性 、CO的选择性
、CO的选择性 )随CO2转化率的变化。
)随CO2转化率的变化。

(4)图二中CO2的转化率是否为对应温度下的平衡转化率___________ (填“是”或“否”或“不一定”)。
(5)若图二中CO2的转化率为对应温度下的平衡转化率,则CH3OH选择性降低的原因是___________ 。
(6)若图二中M点时[初始投料n(CO2)=1mol,n(H2)=3mol,容器体积为1L],整个体系已经达到平衡,此时CO2的转化率为50%,CH3OH的选择性为15%,则氢气的转化率α(H2)=___________ (计算结果保留一位小数)。
(7)已知速率方程v正=k正·c(CO2)·c3(H2),v逆=k逆·c(CH3OH)·c(H2O),k正、k逆是速率常数,只受温度影响,其对数lgk与温度 的关系如图三所示,直线
的关系如图三所示,直线___________ (填“A”或“B”)表示的是lgk正与温度 的关系。
的关系。

Ⅰ. 目前工业上有一种方法是用CO2加氢合成低碳烯烃。现以合成乙烯(C2H4)为例、该过程分两步进行:
第一步:
 ΔH>0
ΔH>0第二步:
 ΔH<0
ΔH<0(1)定义:在热力学标准状态下,由指定单质生成1mol化合物的反应焓称为该化合物的标准摩尔生成焓,简称生成焓,符号为
 。已知:
。已知: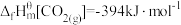 ;
;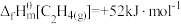 ;
; 。在热力学标准状态下,CO2加氢合成乙烯的热化学方程式为
。在热力学标准状态下,CO2加氢合成乙烯的热化学方程式为(2)有利于提高乙烯平衡产率的条件是___________(填标号)。
| A.高温高压 | B.低温高压 | C.高温低压 | D.低温低压 |

Ⅱ. CO2加氢合成甲醇也是化学固碳的一种有效途径,不仅可以有效减少空气中的CO2排放,而且还能制备出甲醇清洁能源。反应如下:
主反应:
 ΔH1=-49 kJ⋅mol-1
ΔH1=-49 kJ⋅mol-1副反应:
 ΔH2=+41kJ⋅mol-1
ΔH2=+41kJ⋅mol-1向刚性容器中充入投料比为1:3的CO2和H2,图二中横坐标为在催化剂TiO2条件下反应相同的时间,CO2转化率随温度升高而升高。纵坐标为在该时间内CH3OH选择性和CO选择性(CH3OH的选择性
 、CO的选择性
、CO的选择性 )随CO2转化率的变化。
)随CO2转化率的变化。
(4)图二中CO2的转化率是否为对应温度下的平衡转化率
(5)若图二中CO2的转化率为对应温度下的平衡转化率,则CH3OH选择性降低的原因是
(6)若图二中M点时[初始投料n(CO2)=1mol,n(H2)=3mol,容器体积为1L],整个体系已经达到平衡,此时CO2的转化率为50%,CH3OH的选择性为15%,则氢气的转化率α(H2)=
(7)已知速率方程v正=k正·c(CO2)·c3(H2),v逆=k逆·c(CH3OH)·c(H2O),k正、k逆是速率常数,只受温度影响,其对数lgk与温度
 的关系如图三所示,直线
的关系如图三所示,直线 的关系。
的关系。
您最近一年使用:0次
2023-08-29更新
|
304次组卷
|
2卷引用:辽宁省大连市第八中学2022-2023学年高三上学期12月月考化学试题



