名校
1 . 结晶玫瑰和高分子树脂M的合成路线如下图所示:
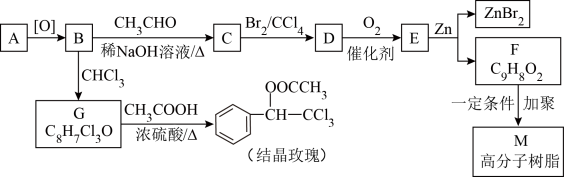
已知:①A是苯的同系物,在相同条件下,其蒸气相对于氢气的密度为46
② (-R表示烃基)
(-R表示烃基)
③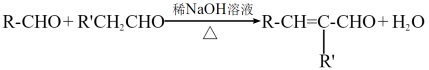 (R、R′表示烃基或氢)
(R、R′表示烃基或氢)
④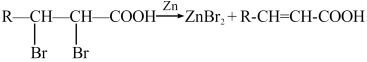
(1)C中官能团的名称为_______ ,E的结构简式为_______ 。
(2)写出由G生成结晶玫瑰的化学方程式:_______ 。
(3)上述流程中“C→D”在M的合成过程中的作用是_______ 。
(4)已知G在一定条件下水解生成H(C8H8O3),与H有相同官能团且与氯化铁溶液发生显色反应的同分异构体的数目有_______ 种。
(5)E的同分异构体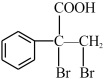 是一种重要的药物中间体,其合成路线与E相似,请以
是一种重要的药物中间体,其合成路线与E相似,请以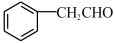 为原料设计它的合成路线
为原料设计它的合成路线_______ (其他所需原料自选)。

已知:①A是苯的同系物,在相同条件下,其蒸气相对于氢气的密度为46
②
 (-R表示烃基)
(-R表示烃基)③
 (R、R′表示烃基或氢)
(R、R′表示烃基或氢)④
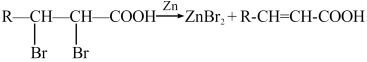
(1)C中官能团的名称为
(2)写出由G生成结晶玫瑰的化学方程式:
(3)上述流程中“C→D”在M的合成过程中的作用是
(4)已知G在一定条件下水解生成H(C8H8O3),与H有相同官能团且与氯化铁溶液发生显色反应的同分异构体的数目有
(5)E的同分异构体
 是一种重要的药物中间体,其合成路线与E相似,请以
是一种重要的药物中间体,其合成路线与E相似,请以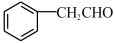 为原料设计它的合成路线
为原料设计它的合成路线
您最近一年使用:0次
名校
解题方法
2 . 有机物X完全燃烧的产物只有二氧化碳和水,元素组成分析发现,该物质中碳元素的质量分数为64.86%,氢元素的质量分数为13.51%,它的核磁共振氢谱有5组明显的吸收峰,且只含有两个甲基。下列关于有机物X的说法正确的是
A.分子式为 | B.X只可能催化氧化成醛 |
| C.与X互为官能团异构的同分异构体有3种 | D.X可能消去生成两种结构的烯烃 |
您最近一年使用:0次
3 . 研究含氮元素物质的反应对生产、生活、科研等方面具有重要的意义。
(1)发射“神舟十三”号的火箭推进剂为液态四氧化二氮和液态偏二甲肼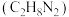 ,
, 与偏二甲肼燃烧产物只有
与偏二甲肼燃烧产物只有 、
、 、
、 ,并放出大量热。
,并放出大量热。
已知:①

②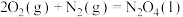

③

请写出上述反应的热化学方程式:______ 。
(2)碘蒸气存在能大幅度提高 的分解速率,反应历程为:
的分解速率,反应历程为:
第一步: (快反应)
(快反应)
第二步: (慢反应)
(慢反应)
第三步: (快反应)
(快反应)
实验表明,含碘时 分解速率方程
分解速率方程 (k为速率常数)。
(k为速率常数)。
下列表述正确的是______。
(3)为避免汽车尾气中的氮氧化合物对大气的污染,需给汽车安装尾气净化装置。在净化装置中 和
和 发生反应
发生反应

 。实验测得:
。实验测得: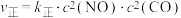 ,
, (
( 、
、 为速率常数,只与温度有关)。
为速率常数,只与温度有关)。
①达到平衡后,仅升高温度, 增大的倍数
增大的倍数______ (填“大于”“小于”或“等于”) 增大的倍数
增大的倍数
②若在 的密闭容器中充入
的密闭容器中充入 和
和 ,在一定温度下达到平衡时,达平衡时总压为起始时的0.9倍,则
,在一定温度下达到平衡时,达平衡时总压为起始时的0.9倍,则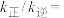
______ 。(保留小数点后两位)
(4)实验室用 溶液处理
溶液处理 ,已知
,已知 ,某吸收液中溶质只含
,某吸收液中溶质只含 ,溶液中
,溶液中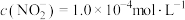 ,取该溶液
,取该溶液 ,加1滴
,加1滴 的
的 溶液混合均匀(20滴约为
溶液混合均匀(20滴约为 ),估算
),估算______ (填“能”或“不能”)产生 沉淀。
沉淀。
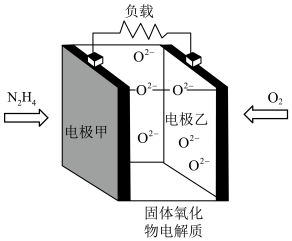
(5)一种以液态肼 为燃料,氧气为氧化剂,某固体氧化物为电解质的新型燃料电池。该固体氧化物电解质的工作温度高达
为燃料,氧气为氧化剂,某固体氧化物为电解质的新型燃料电池。该固体氧化物电解质的工作温度高达 时,
时, 可在该固体氧化物电解质中自由移动,反应生成物均为无毒无害的物质。请写出负极电极反应式:
可在该固体氧化物电解质中自由移动,反应生成物均为无毒无害的物质。请写出负极电极反应式:______ 。
(1)发射“神舟十三”号的火箭推进剂为液态四氧化二氮和液态偏二甲肼
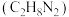 ,
, 与偏二甲肼燃烧产物只有
与偏二甲肼燃烧产物只有 、
、 、
、 ,并放出大量热。
,并放出大量热。已知:①


②
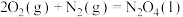

③


请写出上述反应的热化学方程式:
(2)碘蒸气存在能大幅度提高
 的分解速率,反应历程为:
的分解速率,反应历程为:第一步:
 (快反应)
(快反应)第二步:
 (慢反应)
(慢反应)第三步:
 (快反应)
(快反应)实验表明,含碘时
 分解速率方程
分解速率方程 (k为速率常数)。
(k为速率常数)。下列表述正确的是______。
A. 分解反应中,k值与碘蒸气浓度大小有关 分解反应中,k值与碘蒸气浓度大小有关 |
| B.第二步对总反应速率起决定作用 |
| C.第二步活化能比第三步大 |
| D.IO为反应的催化剂 |
(3)为避免汽车尾气中的氮氧化合物对大气的污染,需给汽车安装尾气净化装置。在净化装置中
 和
和 发生反应
发生反应

 。实验测得:
。实验测得: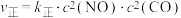 ,
, (
( 、
、 为速率常数,只与温度有关)。
为速率常数,只与温度有关)。①达到平衡后,仅升高温度,
 增大的倍数
增大的倍数 增大的倍数
增大的倍数②若在
 的密闭容器中充入
的密闭容器中充入 和
和 ,在一定温度下达到平衡时,达平衡时总压为起始时的0.9倍,则
,在一定温度下达到平衡时,达平衡时总压为起始时的0.9倍,则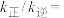
(4)实验室用
 溶液处理
溶液处理 ,已知
,已知 ,某吸收液中溶质只含
,某吸收液中溶质只含 ,溶液中
,溶液中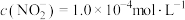 ,取该溶液
,取该溶液 ,加1滴
,加1滴 的
的 溶液混合均匀(20滴约为
溶液混合均匀(20滴约为 ),估算
),估算 沉淀。
沉淀。(5)一种以液态肼
 为燃料,氧气为氧化剂,某固体氧化物为电解质的新型燃料电池。该固体氧化物电解质的工作温度高达
为燃料,氧气为氧化剂,某固体氧化物为电解质的新型燃料电池。该固体氧化物电解质的工作温度高达 时,
时, 可在该固体氧化物电解质中自由移动,反应生成物均为无毒无害的物质。请写出负极电极反应式:
可在该固体氧化物电解质中自由移动,反应生成物均为无毒无害的物质。请写出负极电极反应式:
您最近一年使用:0次
4 . 电解质在水溶液中存在各种行为,如电离、水解、沉淀溶解等,据所学知识回答下列问题:
(1)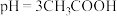 溶液中水电离出来的
溶液中水电离出来的 和溶液中的
和溶液中的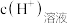 之比是
之比是___________ 。
(2)25℃时,将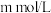 的醋酸和
的醋酸和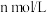 的氢氧化钠溶液等体积混合后,溶液的
的氢氧化钠溶液等体积混合后,溶液的 ,则溶液中
,则溶液中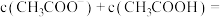
___________ ,m与n的大小关系是m___________ n(填“>”“=”或“<”)。
(3)将 分别放入:①
分别放入:① 水②
水② 溶液③
溶液③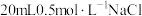 溶液④
溶液④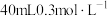 盐酸,各溶液中
盐酸,各溶液中 的浓度由大到小的排列顺序是
的浓度由大到小的排列顺序是___________ (用字母表示)。
(4)氯化铁溶液蒸干并灼烧的产物是___________ ,原因是___________ 。
(5)25℃时,醋酸的电离常数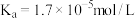 ,则该温度下
,则该温度下 的水解平衡常数
的水解平衡常数
___________  (保留到小数点后一位)。
(保留到小数点后一位)。
(1)
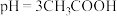 溶液中水电离出来的
溶液中水电离出来的 和溶液中的
和溶液中的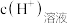 之比是
之比是(2)25℃时,将
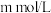 的醋酸和
的醋酸和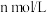 的氢氧化钠溶液等体积混合后,溶液的
的氢氧化钠溶液等体积混合后,溶液的 ,则溶液中
,则溶液中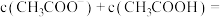
(3)将
 分别放入:①
分别放入:① 水②
水② 溶液③
溶液③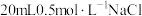 溶液④
溶液④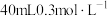 盐酸,各溶液中
盐酸,各溶液中 的浓度由大到小的排列顺序是
的浓度由大到小的排列顺序是(4)氯化铁溶液蒸干并灼烧的产物是
(5)25℃时,醋酸的电离常数
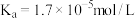 ,则该温度下
,则该温度下 的水解平衡常数
的水解平衡常数
 (保留到小数点后一位)。
(保留到小数点后一位)。
您最近一年使用:0次
名校
5 . I.已知:①4NH3(g)+5O2(g)=4NO(g)+6H2O(g) ΔH1=-907kJ/mol;
②4NH3(g)+3O2(g)=2N2(g)+6H2O(g) ΔH2=-1269kJ/mol。
氨气是常见的烟气脱硝剂之一,其脱硝原理是与NO(g)反应生成两种无毒物质。
(1)写出该反应的热化学反应方程式:_______ 。该反应能在_______ (选项“高温”、“低温”或“任何温度”)下自发进行。
II.臭氧也是理想的烟气脱硝剂,其脱硝的反应之一为2NO2(g)+O3(g) N2O5(g)+O2(g),不同温度下,在两个恒容容器中发生上述反应,相关信息如表及如图所示,回答下列问题:
N2O5(g)+O2(g),不同温度下,在两个恒容容器中发生上述反应,相关信息如表及如图所示,回答下列问题:

(2)温度为T1,0~25分钟NO2(g)的平均反应速率为_______ mol•L-1•min-1。
(3)该反应的ΔH_______ 0(填“大于”或“小于”)。
(4)下列措施能提高容器乙中NO2转化率的是_______ (填字母)。
(5)温度为T1时,若起始时向容器甲中充入2molNO2、1molO3、2molN2O5和2molO2,则脱硝反应达到平衡前,v(正)_______ v(逆)(填“>”“<”或“=”)。
III.活性炭还原法也是消除氮氧化物污染的有效方法,其原理为:2C(s)+2NO2(g) N2(g)+2CO2(g) ΔH<0。
N2(g)+2CO2(g) ΔH<0。
(6)①某实验室模拟该反应,在恒容密闭容器中加入足量的C(碳)和一定量NO2气体,维持温度为T1,反应开始时压强为800kPa,平衡时容器内气体总压强增加25%。则用平衡分压代替其平衡浓度表示化学平衡常数Kp=_______ kPa。[已知:气体分压(P分)=气体总E(P总)×体积分数]
②已知该反应的正反应速率方程v正=k正 p2(NO2),逆反应速率方程为v逆=k逆
p2(NO2),逆反应速率方程为v逆=k逆 p(N2)
p(N2)  p2(CO2),其中k正、k逆分别为正逆反应速率常数。若将一定量的C和NO2投入到密闭容器中,保持温度为T1、恒定在压强800kPa发生该反应,则当NO2的转化率为40%时,v正∶v逆=
p2(CO2),其中k正、k逆分别为正逆反应速率常数。若将一定量的C和NO2投入到密闭容器中,保持温度为T1、恒定在压强800kPa发生该反应,则当NO2的转化率为40%时,v正∶v逆=_______ 。(结果保留一位小数)
②4NH3(g)+3O2(g)=2N2(g)+6H2O(g) ΔH2=-1269kJ/mol。
氨气是常见的烟气脱硝剂之一,其脱硝原理是与NO(g)反应生成两种无毒物质。
(1)写出该反应的热化学反应方程式:
II.臭氧也是理想的烟气脱硝剂,其脱硝的反应之一为2NO2(g)+O3(g)
 N2O5(g)+O2(g),不同温度下,在两个恒容容器中发生上述反应,相关信息如表及如图所示,回答下列问题:
N2O5(g)+O2(g),不同温度下,在两个恒容容器中发生上述反应,相关信息如表及如图所示,回答下列问题:| 容器 | 甲 | 乙 |
| 容积/L | 1 | 1 |
| 温度/K | T1 | T2 |
| 起始充入量 | 2molNO2、1molO3 | 2molNO2、1molO3 |

(2)温度为T1,0~25分钟NO2(g)的平均反应速率为
(3)该反应的ΔH
(4)下列措施能提高容器乙中NO2转化率的是
| A.向容器中充入He,增大容器的压强 |
| B.升高容器的温度 |
| C.向容器中再充入一定量的NO2 |
| D.向容器中再充入1molO3和2molNO2 |
III.活性炭还原法也是消除氮氧化物污染的有效方法,其原理为:2C(s)+2NO2(g)
 N2(g)+2CO2(g) ΔH<0。
N2(g)+2CO2(g) ΔH<0。(6)①某实验室模拟该反应,在恒容密闭容器中加入足量的C(碳)和一定量NO2气体,维持温度为T1,反应开始时压强为800kPa,平衡时容器内气体总压强增加25%。则用平衡分压代替其平衡浓度表示化学平衡常数Kp=
②已知该反应的正反应速率方程v正=k正
 p2(NO2),逆反应速率方程为v逆=k逆
p2(NO2),逆反应速率方程为v逆=k逆 p(N2)
p(N2)  p2(CO2),其中k正、k逆分别为正逆反应速率常数。若将一定量的C和NO2投入到密闭容器中,保持温度为T1、恒定在压强800kPa发生该反应,则当NO2的转化率为40%时,v正∶v逆=
p2(CO2),其中k正、k逆分别为正逆反应速率常数。若将一定量的C和NO2投入到密闭容器中,保持温度为T1、恒定在压强800kPa发生该反应,则当NO2的转化率为40%时,v正∶v逆=
您最近一年使用:0次
名校
6 . 下列离子方程式书写正确的是
A.K2HPO4溶液呈弱碱性的主要原因:HPO +H2O +H2O H3O++PO H3O++PO |
B.向NH4HCO3溶液加入过量NaOH溶液:HCO +OH-=CO +OH-=CO +H2O +H2O |
C.在NaAlO2溶液中滴入足量Ca(HCO3)2溶液:AlO +HCO +HCO +H2O+Ca2+=Al(OH)3↓+CaCO3↓ +H2O+Ca2+=Al(OH)3↓+CaCO3↓ |
D.在10mL0.1mol/L(NH4)2Fe(SO4)2溶液中滴加10mL0.1mol/L的Ba(OH)2溶液:2NH +SO +SO +Ba2++2OH-═BaSO4↓+2NH3+H2O +Ba2++2OH-═BaSO4↓+2NH3+H2O |
您最近一年使用:0次
解题方法
7 . 工业合成氨是人类科学技术的一项重大突破。其合成原理为:N2(g)+3H2(g) 2NH3(g) ΔH<0.
2NH3(g) ΔH<0.
(1)在恒温恒容密闭容器中进行合成氨的反应,下列能说明该反应已达到平衡状态的___________。
(2)恒温下,往一个4 L的密闭容器中充入2 mol N2和5.2 mol H2,反应过程中对NH3的浓度进行检测,得到的数据如表所示:
①10 min时用N2表示的平均反应速率为___________ mol·L-1·min-1.此条件下该反应的化学平衡常数K=___________ 。
②已知:N2(g)+3H2(g) 2NH3(g) ΔH=-92 kJ·mol-1
2NH3(g) ΔH=-92 kJ·mol-1
N2(g)+O2(g)=2NO(g) ΔH=+181 kJ·mol-1
2H2(g)+O2(g)=2H2O(g) ΔH=-484 kJ·mol-1
写出氨气催化氧化生成NO和水蒸气的热化学方程式___________ 。
(3)甲醚(CH3OCH3)是重要的化工原料,可用CO和H2制得,总反应的热化学方程式如为2CO(g)+4H2(g) CH3OCH3(g)+H2O(g) ΔH=-206.0 kJ·mol-1①。
CH3OCH3(g)+H2O(g) ΔH=-206.0 kJ·mol-1①。
该过程可分为以下两步反应完成:
ⅰ.甲醇合成反应:
ⅱ.甲醇脱水反应:2CH3OH(g) CH3OCH3(g)+H2O(g) ΔH=-24.0 kJ·mol-1
CH3OCH3(g)+H2O(g) ΔH=-24.0 kJ·mol-1
起始时向容器中投入2 mol CO和4 mol H2,测得某时刻上述总反应中放出的热量为51.5 kJ,此时CO的转化率为___________ 。
(4)请写出甲醇合成反应的热化学方程式:___________ 。
(5)在一定条件下,将CO和H2按体积比1∶2充入恒容 密闭容器中,反应生成CH3OCH3(g)和H2O(g)。下列能说明该反应达到平衡状态的是___________(填字母)。
 2NH3(g) ΔH<0.
2NH3(g) ΔH<0.(1)在恒温恒容密闭容器中进行合成氨的反应,下列能说明该反应已达到平衡状态的___________。
| A.容器内N2、H2、NH3的浓度之比为1∶3∶2 |
| B.N2百分含量保持不变 |
| C.容器内压强保持不变 |
| D.混合气体的密度保持不变 |
| 时间/min | 5 | 10 | 15 | 20 | 25 | 30 |
| c(NH3)/mol·L-1 | 0.08 | 0.14 | 0.18 | 0.20 | 0.20 | 0.20 |
②已知:N2(g)+3H2(g)
 2NH3(g) ΔH=-92 kJ·mol-1
2NH3(g) ΔH=-92 kJ·mol-1N2(g)+O2(g)=2NO(g) ΔH=+181 kJ·mol-1
2H2(g)+O2(g)=2H2O(g) ΔH=-484 kJ·mol-1
写出氨气催化氧化生成NO和水蒸气的热化学方程式
(3)甲醚(CH3OCH3)是重要的化工原料,可用CO和H2制得,总反应的热化学方程式如为2CO(g)+4H2(g)
 CH3OCH3(g)+H2O(g) ΔH=-206.0 kJ·mol-1①。
CH3OCH3(g)+H2O(g) ΔH=-206.0 kJ·mol-1①。该过程可分为以下两步反应完成:
ⅰ.甲醇合成反应:
ⅱ.甲醇脱水反应:2CH3OH(g)
 CH3OCH3(g)+H2O(g) ΔH=-24.0 kJ·mol-1
CH3OCH3(g)+H2O(g) ΔH=-24.0 kJ·mol-1起始时向容器中投入2 mol CO和4 mol H2,测得某时刻上述总反应中放出的热量为51.5 kJ,此时CO的转化率为
(4)请写出甲醇合成反应的热化学方程式:
(5)在一定条件下,将CO和H2按体积比1∶2充入
| A.混合气体的总物质的量保持不变 |
| B.混合气体的密度保持不变 |
| C.CH3OCH3(g)和H2O(g)的物质的量之比保持不变 |
| D.每生成1 mol CH3OCH3(g),同时生成2 mol CO |
您最近一年使用:0次
名校
解题方法
8 . Ⅰ.甲醇是一种可再生能源,具有广泛的开发和应用前景。工业上一般采用下列两种反应合成甲醇
反应①:CO(g)+2H2(g)⇌CH3OH(g) △H1
反应②:CO2(g)+3H2(g)⇌CH3OH(g)+ H2O(g) △H2
下表所列数据是反应①在不同温度下的化学平衡常数(K):
温度 | 250℃ | 300℃ | 350℃ |
K | 2.0 | 0.27 | 0.012 |
(1)由表中数据判断△H1
(2)反应CO2(g)+H2(g)⇌CO(g)+H2O(g) △H3=
Ⅱ.合成氨工业对国民经济和社会发展具有重要的意义。其原理为:N2(g)+3H2(g)⇌2NH3(g) △H=-92.4kJ/mol。据此回答以下问题:
(3)某温度下,若把2molN2与6molH2
 置于体积为2L的密闭容器内,反应1min达到平衡状态时,能说明该反应达到化学平衡状态的是
置于体积为2L的密闭容器内,反应1min达到平衡状态时,能说明该反应达到化学平衡状态的是a. 容器内的密度保持不变 b. 容器内压强保持不变
c. 3υ正(H2)=2υ逆(NH3) d.混合气体的平均摩尔质量不变
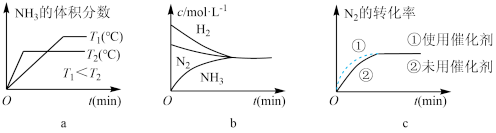
(4)对于合成氨反应而言,下列有关图像一定正确的是(选填序号)
(5)相同温度下,有恒容密闭容器
 和恒压密闭容器
和恒压密闭容器 ,两容器中均充入
,两容器中均充入 和
和 ,此时两容器的体积相等。在一定条件下反应达到平衡状态,
,此时两容器的体积相等。在一定条件下反应达到平衡状态, 中
中 的体积分数为
的体积分数为 ,放出热量为Q1,B中
,放出热量为Q1,B中 的体积分数为
的体积分数为 ,放出热量为Q2。则:a
,放出热量为Q2。则:a ”或“<”,下同)Q1
”或“<”,下同)Q1
您最近一年使用:0次
2023-03-07更新
|
248次组卷
|
2卷引用:广西壮族自治区玉林市第一中学2022-2023学年高二上学期期末考试化学试题
解题方法
9 . 向 的
的 溶液中加入
溶液中加入 的
的 溶液,生成沉淀的质量为
溶液,生成沉淀的质量为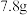 ,加入溶液的体积可能为
,加入溶液的体积可能为
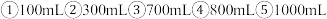
 的
的 溶液中加入
溶液中加入 的
的 溶液,生成沉淀的质量为
溶液,生成沉淀的质量为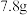 ,加入溶液的体积可能为
,加入溶液的体积可能为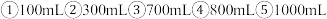
A. 或 或 | B. 或 或 | C. 或 或 | D. 或 或 |
您最近一年使用:0次
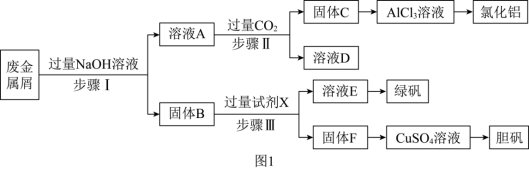
10 . 某工厂的废金属屑中主要成分为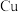 、
、 和
和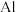 ,此外还含有少量
,此外还含有少量 和
和 ,为探索工业废料的再利用,某化学兴趣小组设计了如图
,为探索工业废料的再利用,某化学兴趣小组设计了如图 所示实验流程,用该工厂的合金废料制取氯化铝、绿矾晶体
所示实验流程,用该工厂的合金废料制取氯化铝、绿矾晶体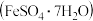 和胆矾晶体。
和胆矾晶体。
请回答下列问题:
(1)步骤Ⅰ反应的离子方程式为___________ 、___________ 。
(2)试剂 是
是___________ 。
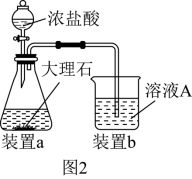
(3)在步骤Ⅱ时,用如图 装置制取
装置制取 并通入溶液
并通入溶液 中,一段时间后,观察到烧杯中产生的白色沉淀会逐渐减少。为避免沉淀减少,可采取的改进措施是
中,一段时间后,观察到烧杯中产生的白色沉淀会逐渐减少。为避免沉淀减少,可采取的改进措施是___________ 。
(4)检验溶液 中的金属阳离子时,应先滴加
中的金属阳离子时,应先滴加___________ ,再滴加新制的氯水,该过程中发生非氧化还原反应的化学方程式为___________ 。
(5)由固体 制取硫酸铜溶液,有以下两种方案:
制取硫酸铜溶液,有以下两种方案:
方案一:将固体 在加热条件下与浓硫酸反应。
在加热条件下与浓硫酸反应。
方案二:将固体 投入热的稀硫酸中,然后通入氧气。
投入热的稀硫酸中,然后通入氧气。
你认为合理的方案是___________ ,该方案发生反应的化学方程式为___________ ,你认为该方案合理的原因是___________ (写出两条)。
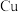 、
、 和
和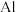 ,此外还含有少量
,此外还含有少量 和
和 ,为探索工业废料的再利用,某化学兴趣小组设计了如图
,为探索工业废料的再利用,某化学兴趣小组设计了如图 所示实验流程,用该工厂的合金废料制取氯化铝、绿矾晶体
所示实验流程,用该工厂的合金废料制取氯化铝、绿矾晶体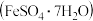 和胆矾晶体。
和胆矾晶体。

请回答下列问题:
(1)步骤Ⅰ反应的离子方程式为
(2)试剂
 是
是(3)在步骤Ⅱ时,用如图
 装置制取
装置制取 并通入溶液
并通入溶液 中,一段时间后,观察到烧杯中产生的白色沉淀会逐渐减少。为避免沉淀减少,可采取的改进措施是
中,一段时间后,观察到烧杯中产生的白色沉淀会逐渐减少。为避免沉淀减少,可采取的改进措施是(4)检验溶液
 中的金属阳离子时,应先滴加
中的金属阳离子时,应先滴加(5)由固体
 制取硫酸铜溶液,有以下两种方案:
制取硫酸铜溶液,有以下两种方案:方案一:将固体
 在加热条件下与浓硫酸反应。
在加热条件下与浓硫酸反应。方案二:将固体
 投入热的稀硫酸中,然后通入氧气。
投入热的稀硫酸中,然后通入氧气。你认为合理的方案是
您最近一年使用:0次



