解题方法
1 .  是合成荧光粉、光导体等的重要原料,
是合成荧光粉、光导体等的重要原料, 的开发与利用是科学界研究的热点。回答下列问题:
的开发与利用是科学界研究的热点。回答下列问题:
(1)已知: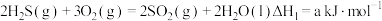 ,
,  ,则空气氧化脱除
,则空气氧化脱除 反应
反应 的
的
___________  。
。
(2)工业上可通过羰基硫(COS)与水蒸气在一定条件下反应制备 ,反应的原理为
,反应的原理为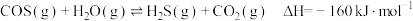 。
。
①T℃时,采用适当的催化剂在密闭容器中将等物质的量的 和
和 混合发生反应,已知该条件下该反应的平衡常数
混合发生反应,已知该条件下该反应的平衡常数 ,则平衡时体系中
,则平衡时体系中 的物质的量分数可能为
的物质的量分数可能为___________ (填字母)
A.0.52 B.0.40 C.0.30 D.0.20
②图甲表示在两个相同的密闭容器中,反应物起始浓度相同,在相同质量不同型号的催化剂催化下,反应相同时间段时 的转化率与温度的关系,则
的转化率与温度的关系,则 的平衡转化率
的平衡转化率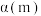
___________ 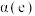 (填“
(填“ ”“
”“ ”或“
”或“ ”);q点时,
”);q点时, 转化率出现突变的原因可能是
转化率出现突变的原因可能是___________ 。

③一定条件下进行该反应,测得 的平衡转化率与起始投料比
的平衡转化率与起始投料比 的关系如图所示,图中各点对应的反应温度可能相同,也可能不相同,图中c点时反应的平衡常数
的关系如图所示,图中各点对应的反应温度可能相同,也可能不相同,图中c点时反应的平衡常数
___________ ,图中与c点的反应温度相同的点有___________ (填字母),若图中a、e两点对应的反应温度分别为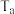 和
和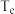 ,则
,则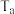
___________ 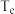 (填“
(填“ ”“
”“ ”或“
”或“ ”)。
”)。

(3)如图所示,质子固体电解质膜 燃料电池可对
燃料电池可对 废气进行资源化利用。
废气进行资源化利用。

电极a的电极反应式为___________ 。
 是合成荧光粉、光导体等的重要原料,
是合成荧光粉、光导体等的重要原料, 的开发与利用是科学界研究的热点。回答下列问题:
的开发与利用是科学界研究的热点。回答下列问题:(1)已知:
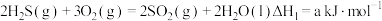 ,
,  ,则空气氧化脱除
,则空气氧化脱除 反应
反应 的
的
 。
。(2)工业上可通过羰基硫(COS)与水蒸气在一定条件下反应制备
 ,反应的原理为
,反应的原理为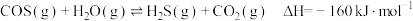 。
。①T℃时,采用适当的催化剂在密闭容器中将等物质的量的
 和
和 混合发生反应,已知该条件下该反应的平衡常数
混合发生反应,已知该条件下该反应的平衡常数 ,则平衡时体系中
,则平衡时体系中 的物质的量分数可能为
的物质的量分数可能为A.0.52 B.0.40 C.0.30 D.0.20
②图甲表示在两个相同的密闭容器中,反应物起始浓度相同,在相同质量不同型号的催化剂催化下,反应相同时间段时
 的转化率与温度的关系,则
的转化率与温度的关系,则 的平衡转化率
的平衡转化率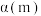
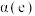 (填“
(填“ ”“
”“ ”或“
”或“ ”);q点时,
”);q点时, 转化率出现突变的原因可能是
转化率出现突变的原因可能是
③一定条件下进行该反应,测得
 的平衡转化率与起始投料比
的平衡转化率与起始投料比 的关系如图所示,图中各点对应的反应温度可能相同,也可能不相同,图中c点时反应的平衡常数
的关系如图所示,图中各点对应的反应温度可能相同,也可能不相同,图中c点时反应的平衡常数
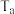 和
和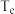 ,则
,则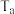
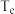 (填“
(填“ ”“
”“ ”或“
”或“ ”)。
”)。
(3)如图所示,质子固体电解质膜
 燃料电池可对
燃料电池可对 废气进行资源化利用。
废气进行资源化利用。
电极a的电极反应式为
您最近一年使用:0次
2 . 金属铍是一种有着“超级金属”之称的新型材料。绿柱石主要成分有BeO、 、
、 、
、 ,和FeO等。采用以下工艺流程可由绿柱石制备单质铍。
,和FeO等。采用以下工艺流程可由绿柱石制备单质铍。

已知:i.铍和铝的化学性质相似。
ii.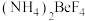 易溶于水,且在水中的溶解度随温度升高显著增大。
易溶于水,且在水中的溶解度随温度升高显著增大。
iii. 在
在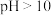 时会溶解。
时会溶解。
(1)滤渣1的主要成分是___________ (填化学式);“氧化”时的离子方程式是___________ 。
(2)滤渣2的主要成分是___________ (填化学式)。
(3)常温下,“沉铍”时加入氨水调节pH至8.0,列式计算说明此时溶液中的 是否沉淀完全:
是否沉淀完全:___________ (已知:常温下当溶液中的离子浓度小于 时,可认为该离子沉淀完全,
时,可认为该离子沉淀完全,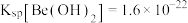 )。
)。
(4)若在“沉铍”时加入过量的NaOH溶液,则铍的存在形式是___________ (填离子符号)。
(5)从溶液中得到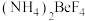 晶体需经过
晶体需经过___________ 、___________ 、过滤、洗涤、干燥等操作
(6)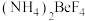 在高温下会发生分解,分解过程中产生的
在高温下会发生分解,分解过程中产生的 烟气会发生反应:
烟气会发生反应: ,可用
,可用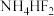 代替HF用于雕刻玻璃,反应过程中有
代替HF用于雕刻玻璃,反应过程中有 生成,请写出此反应的化学方程式:
生成,请写出此反应的化学方程式:___________ 。
 、
、 、
、 ,和FeO等。采用以下工艺流程可由绿柱石制备单质铍。
,和FeO等。采用以下工艺流程可由绿柱石制备单质铍。
已知:i.铍和铝的化学性质相似。
ii.
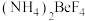 易溶于水,且在水中的溶解度随温度升高显著增大。
易溶于水,且在水中的溶解度随温度升高显著增大。iii.
 在
在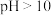 时会溶解。
时会溶解。(1)滤渣1的主要成分是
(2)滤渣2的主要成分是
(3)常温下,“沉铍”时加入氨水调节pH至8.0,列式计算说明此时溶液中的
 是否沉淀完全:
是否沉淀完全: 时,可认为该离子沉淀完全,
时,可认为该离子沉淀完全,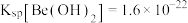 )。
)。(4)若在“沉铍”时加入过量的NaOH溶液,则铍的存在形式是
(5)从溶液中得到
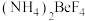 晶体需经过
晶体需经过(6)
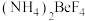 在高温下会发生分解,分解过程中产生的
在高温下会发生分解,分解过程中产生的 烟气会发生反应:
烟气会发生反应: ,可用
,可用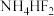 代替HF用于雕刻玻璃,反应过程中有
代替HF用于雕刻玻璃,反应过程中有 生成,请写出此反应的化学方程式:
生成,请写出此反应的化学方程式:
您最近一年使用:0次
名校
3 .  时,将
时,将 气体缓慢通入
气体缓慢通入 的氨水中,溶液的
的氨水中,溶液的 、体系中粒子浓度的对数值(lgc)与反应物的物质的量之比 [
、体系中粒子浓度的对数值(lgc)与反应物的物质的量之比 [ ]的关系如下图所示。若忽略溶液体积变化,下列错误的是
]的关系如下图所示。若忽略溶液体积变化,下列错误的是
 时,将
时,将 气体缓慢通入
气体缓慢通入 的氨水中,溶液的
的氨水中,溶液的 、体系中粒子浓度的对数值(lgc)与反应物的物质的量之比 [
、体系中粒子浓度的对数值(lgc)与反应物的物质的量之比 [ ]的关系如下图所示。若忽略溶液体积变化,下列错误的是
]的关系如下图所示。若忽略溶液体积变化,下列错误的是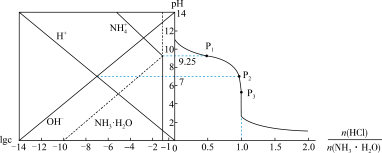
A. 时, 时, 的电离平衡常数为 的电离平衡常数为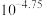 |
B. 时, 时,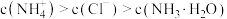 |
C. 所示溶液: 所示溶液: |
D.水的电离程度: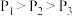 |
您最近一年使用:0次
2023-10-04更新
|
130次组卷
|
2卷引用:山西大学附属中学校2022-2023学年高二上学期12月月考化学试题
名校
4 . I.HI分解曲线和液相法制备HI反应曲线分别如图1和图2所示:
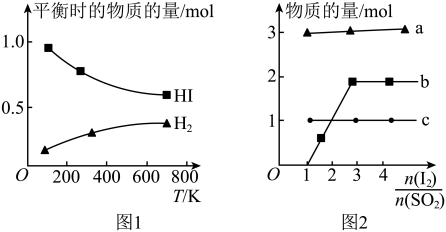
(1)反应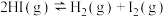 的
的
___________ (填“大于”或“小于”)0。
(2)Bodensteins研究了该反应在 时,气体混合物中碘化氢的物质的量分数
时,气体混合物中碘化氢的物质的量分数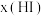 与反应时间t的关系如下表:
与反应时间t的关系如下表:
上述反应中,正反应速率为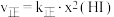 ,逆反应速率为
,逆反应速率为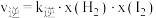 ,其中
,其中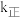 、k逆为速率常数,则k逆为
、k逆为速率常数,则k逆为___________ (以K和k正表示)。若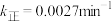 ,在t=40min时
,在t=40min时
___________ 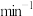 (保留三位有效数字)。
(保留三位有效数字)。
(3)将二氧化硫通入碘水中会发生反应: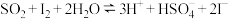 ,
, ,图2中曲线a、b分别代表的产物微粒是
,图2中曲线a、b分别代表的产物微粒是___________ (填微粒符号);由图2知要提高碘的还原率,除控制温度外,还可以采取的措施是___________ 。
II. 的排放主要来自于汽车尾气,包含
的排放主要来自于汽车尾气,包含 和
和 ,有人提出用活性炭对
,有人提出用活性炭对 进行吸附,发生反应如下:
进行吸附,发生反应如下:
反应a: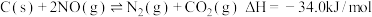
反应b: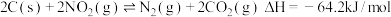
(4)对于密闭容器中反应a,在T1℃时,借助传感器测得反应在不同时间点上各物质的浓度如下:
30min后,只改变某一条件,反应重新达到平衡;根据上表中的数据判断改变的条件可能是___________(填字母代号)。
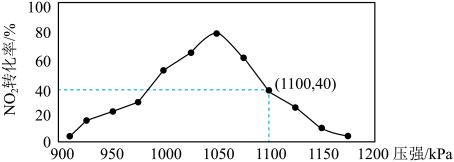
(5)某实验室模拟反应b,在密用容器中加入足量的C和一定量的 气体,维持温度为T2℃,如图为不同压强下反应b经过相同时间
气体,维持温度为T2℃,如图为不同压强下反应b经过相同时间 的转化率随着压强变化的示意图。请分析,
的转化率随着压强变化的示意图。请分析,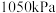 前,反应b中
前,反应b中 转化率随着压强增大而增大的原因是
转化率随着压强增大而增大的原因是___________ 。
用某物质的平衡分压代替其物质的量浓度也可以表示化学平衡常数(记作 );在T2℃、
);在T2℃、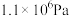 时,该反应的化学平衡常数
时,该反应的化学平衡常数
___________ Pa;已知:气体分压(p分)气体总压(p总)×体积分数。

(1)反应
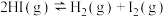 的
的
(2)Bodensteins研究了该反应在
 时,气体混合物中碘化氢的物质的量分数
时,气体混合物中碘化氢的物质的量分数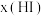 与反应时间t的关系如下表:
与反应时间t的关系如下表:| t/min | 0 | 20 | 40 | 60 | 80 | 120 |
 | 1 | 0.91 | 0.85 | 0.815 | 0.795 | 0.784 |
 | 0 | 0.60 | 0.73 | 0.773 | 0.780 | 0.784 |
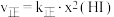 ,逆反应速率为
,逆反应速率为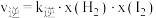 ,其中
,其中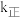 、k逆为速率常数,则k逆为
、k逆为速率常数,则k逆为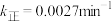 ,在t=40min时
,在t=40min时
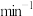 (保留三位有效数字)。
(保留三位有效数字)。(3)将二氧化硫通入碘水中会发生反应:
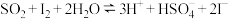 ,
, ,图2中曲线a、b分别代表的产物微粒是
,图2中曲线a、b分别代表的产物微粒是II.
 的排放主要来自于汽车尾气,包含
的排放主要来自于汽车尾气,包含 和
和 ,有人提出用活性炭对
,有人提出用活性炭对 进行吸附,发生反应如下:
进行吸附,发生反应如下:反应a:
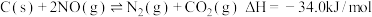
反应b:
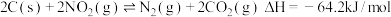
(4)对于密闭容器中反应a,在T1℃时,借助传感器测得反应在不同时间点上各物质的浓度如下:
| 0 | 10 | 20 | 30 | 40 | 50 | |
| NO | 1.00 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
| A.加入一定量的活性炭 | B.通入一定量的NO |
| C.适当缩小容器的体积 | D.加入合适的催化剂 |
 气体,维持温度为T2℃,如图为不同压强下反应b经过相同时间
气体,维持温度为T2℃,如图为不同压强下反应b经过相同时间 的转化率随着压强变化的示意图。请分析,
的转化率随着压强变化的示意图。请分析,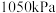 前,反应b中
前,反应b中 转化率随着压强增大而增大的原因是
转化率随着压强增大而增大的原因是
用某物质的平衡分压代替其物质的量浓度也可以表示化学平衡常数(记作
 );在T2℃、
);在T2℃、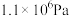 时,该反应的化学平衡常数
时,该反应的化学平衡常数
您最近一年使用:0次
名校
5 . 滴定法在化学研究中有着重要意义。
I.第一化学学习小组同学利用滴定法测定草酸晶体(H2C2O4·xH2O)中的x值,进行如下实验:
①称取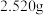 纯草酸晶体,将其制成
纯草酸晶体,将其制成 水溶液为待测液;
水溶液为待测液;
②取 待测液放入锥形瓶中,再加入适量的稀
待测液放入锥形瓶中,再加入适量的稀 ;
;
③用浓度为 的酸性
的酸性 标准溶液进行滴定。
标准溶液进行滴定。
(1)实验中不需要的仪器有___________ (填序号),还缺少的仪器有(填名称)___________ 、___________ 。
a.电子天平 b.滴定管 c.冷凝管 d.铁架台(附滴定管夹) e.烧杯 f.漏斗 g.锥形瓶 h.玻璃棒 i.药匙 j.烧瓶
(2)写出该反应的离子方程式___________ ,滴定时, 溶液应装在
溶液应装在___________ (“酸”或“碱”)式滴定管中,判定滴定终点方法为___________ 。
(3)通过下述数据,求得
___________ 。
表格中记录了实验数据:
(4)若滴定用的 溶液因久置部分变质,则实验结果所测定的x值将
溶液因久置部分变质,则实验结果所测定的x值将___________ (填“偏大”“偏小”或“无影响”后同)。若滴定终点读数时目光俯视,则计算的x值会___________ 。
II.第二化学学习小组用滴定法测定 的质量分数:一定条件下,将
的质量分数:一定条件下,将 溶解并还原为
溶解并还原为 ,用
,用 标准溶液滴定
标准溶液滴定 至全部生成
至全部生成 。请回答下列问题:
。请回答下列问题:
(5) 水解生成
水解生成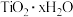 的化学方程式为
的化学方程式为___________ 。
(6)滴定选用的指示剂是___________ 。
(7)滴定分析时,称取 (摩尔质量为
(摩尔质量为 )试样
)试样 ,消耗
,消耗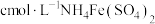 标准溶液
标准溶液 ,则
,则 质量分数表达式为
质量分数表达式为___________ 。
I.第一化学学习小组同学利用滴定法测定草酸晶体(H2C2O4·xH2O)中的x值,进行如下实验:
①称取
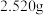 纯草酸晶体,将其制成
纯草酸晶体,将其制成 水溶液为待测液;
水溶液为待测液;②取
 待测液放入锥形瓶中,再加入适量的稀
待测液放入锥形瓶中,再加入适量的稀 ;
;③用浓度为
 的酸性
的酸性 标准溶液进行滴定。
标准溶液进行滴定。(1)实验中不需要的仪器有
a.电子天平 b.滴定管 c.冷凝管 d.铁架台(附滴定管夹) e.烧杯 f.漏斗 g.锥形瓶 h.玻璃棒 i.药匙 j.烧瓶
(2)写出该反应的离子方程式
 溶液应装在
溶液应装在(3)通过下述数据,求得

表格中记录了实验数据:
| 滴定次数 | 待测液体积(mL) | 标准 溶液(mL) 溶液(mL) | |
| 滴定前读数 | 滴定后读数 | ||
| 第一次 | 25.00 | 0.00 | 20.02 |
| 第二次 | 25.00 | 3.02 | 23.00 |
| 第三次 | 25.00 | 4.00 | 24.80 |
 溶液因久置部分变质,则实验结果所测定的x值将
溶液因久置部分变质,则实验结果所测定的x值将II.第二化学学习小组用滴定法测定
 的质量分数:一定条件下,将
的质量分数:一定条件下,将 溶解并还原为
溶解并还原为 ,用
,用 标准溶液滴定
标准溶液滴定 至全部生成
至全部生成 。请回答下列问题:
。请回答下列问题:(5)
 水解生成
水解生成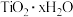 的化学方程式为
的化学方程式为(6)滴定选用的指示剂是
(7)滴定分析时,称取
 (摩尔质量为
(摩尔质量为 )试样
)试样 ,消耗
,消耗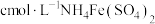 标准溶液
标准溶液 ,则
,则 质量分数表达式为
质量分数表达式为
您最近一年使用:0次
2023-08-28更新
|
220次组卷
|
2卷引用:山西大学附属中学校2022-2023学年高二上学期11月期中考试化学试题
名校
6 . 已知R、W、X、Y、Z均为短周期主族元素,其中R元素所在的周期数是其族序数的一半,且对应的两种常见氧化物均为酸性氧化物,W元素与Z元素在同一主族,X与其同主族另一元素单质形成的合金可用作原子反应堆导热剂,Y元素原子最外层电子数为m,次外层电子数为n,Z元素原子L层电子数为m+n,M层电子数为m-n,下列叙述中错误的是
A.R、X、Y对应的简单离子半径: |
| B.相同温度下,同浓度的R、W、Z的最高价含氧酸的酸性:R>W>Z |
C.将 与 与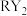 分别通入 分别通入 溶液中,现象不同 溶液中,现象不同 |
| D.因为Y的氢化物比R的氢化物稳定,所以Y的氢化物的熔、沸点比R的氢化物的熔、沸点高 |
您最近一年使用:0次
2023-02-16更新
|
1258次组卷
|
7卷引用:山西省怀仁市第一中学校北校区2022届高三高考预测猜题卷理科综合化学试题
7 . 向200mLcmol/LFeBr2溶液中逐渐通入Cl2,其中n(Fe2+),n(Br-)随通入n(Cl2)的物质的量n(Cl2)变化如图所示(已知:Cl2+2Br-=2Cl-+Br2)。下列说法正确的是


| A.曲线②为Br-,且c=0.15 |
| B.由图可判断还原性:Br->Fe2+>Cl- |
| C.n(Cl2)=0.35mol时,溶液中c(Fe3+)>c(Br-) |
| D.n(Cl2)=0.30mol时,总的离子方程式为2Cl2+2Fe2++2Br-=2Fe3++Br2+4Cl- |
您最近一年使用:0次
2023-01-11更新
|
236次组卷
|
4卷引用:山西省晋城二中2022-2023学年高一上学期12月(第三次)月考化学试题
名校
8 . 设NA为阿伏加德罗常数的值,下列说法正确的是
| A.等体积、等物质的量浓度的NaCl、KCl溶液,两种溶液中阴、阳离子数目之和均为2NA |
| B.100g46%的乙醇(C2H5OH)溶液中含有氧原子的数目为NA |
| C.NO2和N2O4组成的46g混合气体中含有的原子数目为3NA |
| D.1 mol Cl2和1 mol Fe加热充分反应,转移的电子数目为3NA |
您最近一年使用:0次
2023-01-11更新
|
649次组卷
|
5卷引用:山西省晋城二中2022-2023学年高一上学期12月(第三次)月考化学试题
名校
解题方法
9 . 下列离子方程式正确的是
A.过氧化钠和稀盐酸反应: |
B.将1mol  通入含1mol 通入含1mol  溶液中: 溶液中: |
C.工业上制备漂白粉的离子方程式: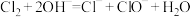 |
D.向 溶液中加入足量的 溶液中加入足量的 溶液: 溶液: |
您最近一年使用:0次
2023-01-03更新
|
398次组卷
|
3卷引用:山西大学附属中学校2022~2023 学年高一上学期模块诊断(总第三次)化学试题
10 . 我国力争于2030年前做到碳达峰。 和
和 催化重整是
催化重整是 利用的研究热点之一、该催化重整反应体系主要涉及以下反应:
利用的研究热点之一、该催化重整反应体系主要涉及以下反应:
反应Ⅰ:主反应


反应Ⅱ:副反应

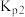
反应Ⅲ:积碳反应

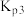
反应Ⅳ:积碳反应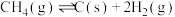

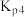
(1)有关化学键键能数据如表:
已知CO中含有的化学键为C≡O,则反应Ⅱ的
_______ kJ/mol。
(2)下列关于该重整反应体系的说法正确的是_______(填字母)。
(3)恒温下,往2L密闭容器中加入2mol 、2mol
、2mol 进行该催化重整反应(不考虑除主反应外的其他反应),2min后测得
进行该催化重整反应(不考虑除主反应外的其他反应),2min后测得 的转化率为40%,则2min内平均反应速率
的转化率为40%,则2min内平均反应速率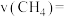
_______  。
。
(4)设 为分压平衡常数(用分压代替浓度,气体分压=总压×该组分的物质的量分数),反应Ⅲ、Ⅳ的
为分压平衡常数(用分压代替浓度,气体分压=总压×该组分的物质的量分数),反应Ⅲ、Ⅳ的 随
随 (T表示温度)的变化如图所示。据图判断,反应Ⅰ的
(T表示温度)的变化如图所示。据图判断,反应Ⅰ的
_______ 0(填“大于”“小于”或“等于”),说明判断的理由_______ 。

(5)在恒温、体系总压恒定为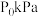 下,往密闭容器中加入
下,往密闭容器中加入 、
、 进行该催化重整反应(不考虑除主反应外的其他反应),达到平衡状态时,
进行该催化重整反应(不考虑除主反应外的其他反应),达到平衡状态时, 的转化率为50%。则该温度下的平衡常数
的转化率为50%。则该温度下的平衡常数
_______  (用含
(用含 的代数式表示)。
的代数式表示)。
 和
和 催化重整是
催化重整是 利用的研究热点之一、该催化重整反应体系主要涉及以下反应:
利用的研究热点之一、该催化重整反应体系主要涉及以下反应:反应Ⅰ:主反应



反应Ⅱ:副反应


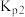
反应Ⅲ:积碳反应


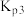
反应Ⅳ:积碳反应
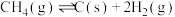

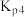
(1)有关化学键键能数据如表:
| 化学键 | H—H | H—O | C=O | C≡O |
键能/ | 436 | 463 | 803 | 1076 |
已知CO中含有的化学键为C≡O,则反应Ⅱ的

(2)下列关于该重整反应体系的说法正确的是_______(填字母)。
A.加入催化剂,可提高 的平衡转化率 的平衡转化率 |
B.增大 的浓度,反应Ⅰ、Ⅱ的正反应速率均增加 的浓度,反应Ⅰ、Ⅱ的正反应速率均增加 |
C.随着投料比 的增大,达到平衡时 的增大,达到平衡时 的转化率增大 的转化率增大 |
| D.在一定条件下建立平衡后,移去部分积碳,反应Ⅲ和反应Ⅳ平衡均向右移动 |
 、2mol
、2mol 进行该催化重整反应(不考虑除主反应外的其他反应),2min后测得
进行该催化重整反应(不考虑除主反应外的其他反应),2min后测得 的转化率为40%,则2min内平均反应速率
的转化率为40%,则2min内平均反应速率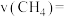
 。
。(4)设
 为分压平衡常数(用分压代替浓度,气体分压=总压×该组分的物质的量分数),反应Ⅲ、Ⅳ的
为分压平衡常数(用分压代替浓度,气体分压=总压×该组分的物质的量分数),反应Ⅲ、Ⅳ的 随
随 (T表示温度)的变化如图所示。据图判断,反应Ⅰ的
(T表示温度)的变化如图所示。据图判断,反应Ⅰ的

(5)在恒温、体系总压恒定为
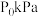 下,往密闭容器中加入
下,往密闭容器中加入 、
、 进行该催化重整反应(不考虑除主反应外的其他反应),达到平衡状态时,
进行该催化重整反应(不考虑除主反应外的其他反应),达到平衡状态时, 的转化率为50%。则该温度下的平衡常数
的转化率为50%。则该温度下的平衡常数
 (用含
(用含 的代数式表示)。
的代数式表示)。
您最近一年使用:0次



