1 . 实验室用 和亚硫酰氯(
和亚硫酰氯( )制备无水
)制备无水 的装置如图所示(加热及夹持装置略)。已知:
的装置如图所示(加热及夹持装置略)。已知: 的沸点为76℃,遇水极易反应生成两种酸性气体。回答下列问题:
的沸点为76℃,遇水极易反应生成两种酸性气体。回答下列问题:

(1)加热装置B的目的是___________ 。
(2) 遇水蒸气发生反应的化学方程式为
遇水蒸气发生反应的化学方程式为___________ 。
(3)有人认为产品可能含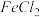 判断理由是
判断理由是___________ 。
(4)实验完毕后,测定产品成分。取一定量产品溶于蒸馏水中,分成甲、乙两等份,进行如下实验:
实验1:在甲中加入足量KI,再滴几滴淀粉溶液,用0.1000
 溶液滴定至终点,消耗
溶液滴定至终点,消耗 溶液
溶液 mL。
mL。
实验2:在乙中滴几滴 溶液作指示剂,用0.1000
溶液作指示剂,用0.1000
 溶液测定氯离子的量,滴定至终点,消耗
溶液测定氯离子的量,滴定至终点,消耗 溶液
溶液 mL。
mL。
已知:实验1中滴定反应为 。
。
①若溶液酸性较强,测得 偏大,其可能原因是
偏大,其可能原因是___________ (用离子方程式表示)。
②若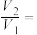
___________ 时,可判断产品中全部是 。
。
 和亚硫酰氯(
和亚硫酰氯( )制备无水
)制备无水 的装置如图所示(加热及夹持装置略)。已知:
的装置如图所示(加热及夹持装置略)。已知: 的沸点为76℃,遇水极易反应生成两种酸性气体。回答下列问题:
的沸点为76℃,遇水极易反应生成两种酸性气体。回答下列问题:
(1)加热装置B的目的是
(2)
 遇水蒸气发生反应的化学方程式为
遇水蒸气发生反应的化学方程式为(3)有人认为产品可能含
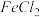 判断理由是
判断理由是(4)实验完毕后,测定产品成分。取一定量产品溶于蒸馏水中,分成甲、乙两等份,进行如下实验:
实验1:在甲中加入足量KI,再滴几滴淀粉溶液,用0.1000

 溶液滴定至终点,消耗
溶液滴定至终点,消耗 溶液
溶液 mL。
mL。实验2:在乙中滴几滴
 溶液作指示剂,用0.1000
溶液作指示剂,用0.1000
 溶液测定氯离子的量,滴定至终点,消耗
溶液测定氯离子的量,滴定至终点,消耗 溶液
溶液 mL。
mL。已知:实验1中滴定反应为
 。
。①若溶液酸性较强,测得
 偏大,其可能原因是
偏大,其可能原因是②若
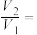
 。
。
您最近一年使用:0次
名校
解题方法
2 . 卤素单质及其化合物在科研和工农业生产中有着广泛的应用。回答下列问题:
(1)氟原子激发态的电子排布式有_______ (填标号)。
A. B.
B. C.
C.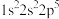
(2)O、F、Cl电负性由大到小的顺序为_______ ; 分子的空间构型为
分子的空间构型为_______ ; 的熔、沸点低于
的熔、沸点低于 ,原因是
,原因是_______ 。
(3)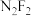 (二氟氮烯)分子中,氮原子的杂化类型为
(二氟氮烯)分子中,氮原子的杂化类型为 ,则
,则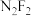 的结构式为
的结构式为_______ 。
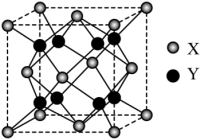
(4)萤石( )是自然界中常见的含氟矿物,其晶胞结构如图所示,X代表的离子是
)是自然界中常见的含氟矿物,其晶胞结构如图所示,X代表的离子是_______ ;若该立方晶胞参数为a pm,正负离子的核间距最小为_______ pm。
(5)NiO晶体与NaCl晶体结构相似。
①设阿伏加德罗常数的值为 ,距离最近的两个
,距离最近的两个 间距为a pm,NiO的摩尔质量为M g/mol,则NiO晶体的密度为
间距为a pm,NiO的摩尔质量为M g/mol,则NiO晶体的密度为_______  (列出计算式)。
(列出计算式)。
②晶体普遍存在各种缺陷。某种NiO晶体中存在如图所示的缺陷:当一个 空缺,会有两个
空缺,会有两个 被两个
被两个 所取代,但晶体仍呈电中性。经测定某氧化镍样品中
所取代,但晶体仍呈电中性。经测定某氧化镍样品中 与
与 的离子数之比为6:91。若该晶体的化学式为
的离子数之比为6:91。若该晶体的化学式为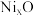 ,则x=
,则x=_______ 。

(1)氟原子激发态的电子排布式有
A.
 B.
B. C.
C.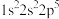
(2)O、F、Cl电负性由大到小的顺序为
 分子的空间构型为
分子的空间构型为 的熔、沸点低于
的熔、沸点低于 ,原因是
,原因是(3)
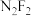 (二氟氮烯)分子中,氮原子的杂化类型为
(二氟氮烯)分子中,氮原子的杂化类型为 ,则
,则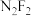 的结构式为
的结构式为(4)萤石(
 )是自然界中常见的含氟矿物,其晶胞结构如图所示,X代表的离子是
)是自然界中常见的含氟矿物,其晶胞结构如图所示,X代表的离子是
(5)NiO晶体与NaCl晶体结构相似。
①设阿伏加德罗常数的值为
 ,距离最近的两个
,距离最近的两个 间距为a pm,NiO的摩尔质量为M g/mol,则NiO晶体的密度为
间距为a pm,NiO的摩尔质量为M g/mol,则NiO晶体的密度为 (列出计算式)。
(列出计算式)。②晶体普遍存在各种缺陷。某种NiO晶体中存在如图所示的缺陷:当一个
 空缺,会有两个
空缺,会有两个 被两个
被两个 所取代,但晶体仍呈电中性。经测定某氧化镍样品中
所取代,但晶体仍呈电中性。经测定某氧化镍样品中 与
与 的离子数之比为6:91。若该晶体的化学式为
的离子数之比为6:91。若该晶体的化学式为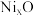 ,则x=
,则x=
您最近一年使用:0次
2022-11-27更新
|
1113次组卷
|
4卷引用:海南省琼海市嘉积中学2022-2023学年高三上学期期中检测化学试题
海南省琼海市嘉积中学2022-2023学年高三上学期期中检测化学试题(已下线)期中模拟预测卷02(测试范围:选择性必修2+选择性必修3第1章)-2022-2023学年高二化学下学期期中期末考点大串讲(人教版2019)(已下线)山东省枣庄市2022-2023学年高三下学期二模考试化学试题变式题(结构与性质)河北省邯郸市磁县第一中学2023-2024学年高二上学期七调月考化学试题
名校
解题方法
3 . 三氯化六氨合钴(III)([Co(NH3)6]Cl3,钴为+3价)在钴化合物的合成中是重要原料。实验室以CoCl2为原料制备[Co(NH3)6]Cl3,步骤如下:
I.CoCl2的制备。
CoCl2可以通过钴和氯气反应制得,实验室制备纯净CoCl2可用如图实验装置实现(已知:钴单质在300℃以上易被氧气氧化,CoCl2易潮解)。

(1)仪器X的名称为_______ 。
(2)X中发生反应的离子方程式为_______ 。
(3)装置的连接顺序为A→_______ →B。
II.[Co(NH3)6]Cl3的制备。
在100mL锥形瓶内加入4.5g研细的二氯化钴CoCl2,3gNH4Cl和5mL水,加热溶解后加入0.3g活性炭作催化剂,冷却后,通入足量NH3,混合均匀;控制温度在10℃以下,缓慢加入10mL10%的H2O2,然后加热至60℃左右,恒温20分钟,适当摇动锥形瓶:在冰水中冷却所得溶液,即有晶体析出(粗产品)。回答下列问题:
(4)该过程中控制温度为60℃的方法是_______ 。
(5)制备[Co(NH3)6]Cl3的总反应化学方程式为_______ 。
III.测定[Co(NH3)6]Cl3中钴的含量。
(6)原理:利用Co3+将KI氧化成I2,Co3+被还原后的产物为Co2+。然后用0.015mol•L-1Na2S2O3标准溶液滴定生成的I2,Na2S2O3所得产物为S4O 。若称取样品的质量为0.27g,滴定I2时,达到终点消耗Na2S2O3标准溶液的平均体积为54.00mL。
。若称取样品的质量为0.27g,滴定I2时,达到终点消耗Na2S2O3标准溶液的平均体积为54.00mL。
则该氧化还原滴定指示剂为_______ ,该样品中钴元素的质量分数为_______ 。
I.CoCl2的制备。
CoCl2可以通过钴和氯气反应制得,实验室制备纯净CoCl2可用如图实验装置实现(已知:钴单质在300℃以上易被氧气氧化,CoCl2易潮解)。

(1)仪器X的名称为
(2)X中发生反应的离子方程式为
(3)装置的连接顺序为A→
II.[Co(NH3)6]Cl3的制备。
在100mL锥形瓶内加入4.5g研细的二氯化钴CoCl2,3gNH4Cl和5mL水,加热溶解后加入0.3g活性炭作催化剂,冷却后,通入足量NH3,混合均匀;控制温度在10℃以下,缓慢加入10mL10%的H2O2,然后加热至60℃左右,恒温20分钟,适当摇动锥形瓶:在冰水中冷却所得溶液,即有晶体析出(粗产品)。回答下列问题:
(4)该过程中控制温度为60℃的方法是
(5)制备[Co(NH3)6]Cl3的总反应化学方程式为
III.测定[Co(NH3)6]Cl3中钴的含量。
(6)原理:利用Co3+将KI氧化成I2,Co3+被还原后的产物为Co2+。然后用0.015mol•L-1Na2S2O3标准溶液滴定生成的I2,Na2S2O3所得产物为S4O
 。若称取样品的质量为0.27g,滴定I2时,达到终点消耗Na2S2O3标准溶液的平均体积为54.00mL。
。若称取样品的质量为0.27g,滴定I2时,达到终点消耗Na2S2O3标准溶液的平均体积为54.00mL。则该氧化还原滴定指示剂为
您最近一年使用:0次
2022-10-31更新
|
332次组卷
|
2卷引用:海南省琼海市嘉积中学2022-2023学年高三上学期期中检测化学试题
解题方法
4 . 斑岩铜矿是重要的铜矿类型之一,一种以斑岩铜矿(含 、
、 、
、 ,少量的
,少量的 等)为原料提取铜等产品的流程如下:
等)为原料提取铜等产品的流程如下:

请回答下列问题:
(1)浸渣的主要成分是_______ (填化学式)。
(2)铜矿在灼烧之前要粉碎,其目的是_______ 。
(3)灼烧中 转化成磁性氧化铁,写出反应的化学方程式:
转化成磁性氧化铁,写出反应的化学方程式:_______ ,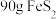 完全反应时转移
完全反应时转移_______ mol电子。
(4)电解硫酸铜溶液的化学方程式为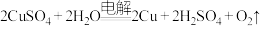 ,电解所得“废液”可用于_______(填字母),实现资源循环利用,提高原料利用率。
,电解所得“废液”可用于_______(填字母),实现资源循环利用,提高原料利用率。
(5)双氧水的作用是_______ (用离子方程式表示)。
(6)工业上,以辉铜矿(主要成分为 )为原料,采用火法治铜,有关反应如下:
)为原料,采用火法治铜,有关反应如下:
①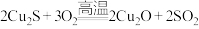 ;
;
② 和
和 高温下反应制备Cu,该反应的化学方程式为
高温下反应制备Cu,该反应的化学方程式为_______ 。
 、
、 、
、 ,少量的
,少量的 等)为原料提取铜等产品的流程如下:
等)为原料提取铜等产品的流程如下:
请回答下列问题:
(1)浸渣的主要成分是
(2)铜矿在灼烧之前要粉碎,其目的是
(3)灼烧中
 转化成磁性氧化铁,写出反应的化学方程式:
转化成磁性氧化铁,写出反应的化学方程式: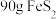 完全反应时转移
完全反应时转移(4)电解硫酸铜溶液的化学方程式为
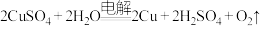 ,电解所得“废液”可用于_______(填字母),实现资源循环利用,提高原料利用率。
,电解所得“废液”可用于_______(填字母),实现资源循环利用,提高原料利用率。| A.灼烧 | B.酸浸 | C.氧化 | D.沉铁 |
(6)工业上,以辉铜矿(主要成分为
 )为原料,采用火法治铜,有关反应如下:
)为原料,采用火法治铜,有关反应如下: ①
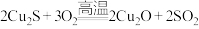 ;
;②
 和
和 高温下反应制备Cu,该反应的化学方程式为
高温下反应制备Cu,该反应的化学方程式为
您最近一年使用:0次
解题方法
5 . 聚乙烯醇肉桂酸酯(M)可用作光刻工艺中的抗腐蚀涂层,其合成路线如下:
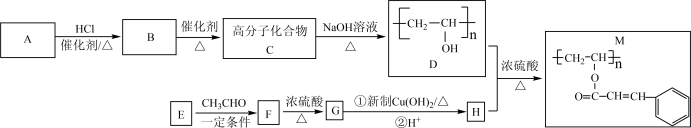
已知:R1-CHO+R2-CH2CHO
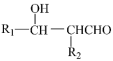
(1)A是一种无色气体,最简式是_______ ,C是一种常用塑料的成分,写出 C→D转化的化学方程式_______ 。
(2)E 的结构简式为_______ ,F →G 的反应类型为_______ 。
(3)M 中的含氧官能团的名称为_______ 。
(4)G与新制氢氧化铜悬浊液在加热条件下反应的化学方程式为_______ 。
(5)满足下列条件的 F 的同分异构体有_______ 种,写出其中核磁共振吸收峰面积之比为 6:2:1:1 的有机物的结构简式_______ (写出一种即可)。
①属于芳香族化合物,苯环上一氯代物只有两种;②能发生水解反应和银镜反应。

已知:R1-CHO+R2-CH2CHO

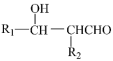
(1)A是一种无色气体,最简式是
(2)E 的结构简式为
(3)M 中的含氧官能团的名称为
(4)G与新制氢氧化铜悬浊液在加热条件下反应的化学方程式为
(5)满足下列条件的 F 的同分异构体有
①属于芳香族化合物,苯环上一氯代物只有两种;②能发生水解反应和银镜反应。
您最近一年使用:0次
解题方法
6 . 在2月17号的国务院新闻发布会上,科技部生物中心副主任孙燕荣介绍:磷酸氯喹是抗疟药,已在临床上用了70多年。临床上它对新冠肺炎有疗效,且未发现和药物相关的严重不良反应。这一消息振奋人心。磷酸氯喹的有效成分为氯喹,合成氯喹的路线如图:

回答下列问题:
(1)B中官能团的名称是_______ 。
(2)反应②、⑥的反应类型分别是_______ 、_______ 。
(3)F的结构简式是_______ 。
(4)请写出反应③的化学反应方程式_______ 。
(5)M是H的一种同分异构体,写出2种满足下列条件的M的结构简式_____ 。(不考虑立体异构)
①分子结构中含有苯环(无其他环),且苯环上有三个取代基;
②能使溴水褪色;
③核磁共振氢谱有4组峰,峰面积之比为2∶1∶1∶1 。

回答下列问题:
(1)B中官能团的名称是
(2)反应②、⑥的反应类型分别是
(3)F的结构简式是
(4)请写出反应③的化学反应方程式
(5)M是H的一种同分异构体,写出2种满足下列条件的M的结构简式
①分子结构中含有苯环(无其他环),且苯环上有三个取代基;
②能使溴水褪色;
③核磁共振氢谱有4组峰,峰面积之比为2∶1∶1∶1 。
您最近一年使用:0次
解题方法
7 . 2019年诺贝尔化学奖由来自美、英、日的三人分获,以表彰他们在锂离子电池研究方面做出的贡献,他们最早发明用LiCoO2作离子电池的正极,用聚乙炔作负极。回答下列问题:
(1)基态Co原子电子排布式为____ 。
(2)Co元素位于元素周期表中第____ 周期、第____ 族。
(3)Li可以在二氧化碳中燃烧,生成白色固体和黑色固体,其方程式是____ 。
(4)锂离子电池的导电盐有LiBF4等,碳酸亚乙酯( )是一种锂离子电池电解液的添加剂。
)是一种锂离子电池电解液的添加剂。
①LiBF4中阴离子的空间构型是____ ;与该阴离子互为等电子体的分子有____ 。(列一种)
②碳酸亚乙酯分子中碳原子的杂化方式有____ 。
(1)基态Co原子电子排布式为
(2)Co元素位于元素周期表中第
(3)Li可以在二氧化碳中燃烧,生成白色固体和黑色固体,其方程式是
(4)锂离子电池的导电盐有LiBF4等,碳酸亚乙酯(
 )是一种锂离子电池电解液的添加剂。
)是一种锂离子电池电解液的添加剂。①LiBF4中阴离子的空间构型是
②碳酸亚乙酯分子中碳原子的杂化方式有
您最近一年使用:0次
2022-10-08更新
|
883次组卷
|
2卷引用:海南省琼海市嘉积第二中学2021-2022学年高二下学期教学质量监测(期末考)化学试题
解题方法
8 . 根据原子核外电子排布规则,回答下列问题:
(1)写出基态S原子的核外电子排布式:_______ ;写出基态24Cr原子的价层电子排布式:_______ ;写出基态Ga原子的价层电子轨道表示式:_______ 。
(2)Ca(CN)2是离子化合物,其中CN-内部均满足各原子均满足8电子稳定结构,Ca(CN)2的电子式是_______ 。
(3)Mg基态原子的核外电子排布图为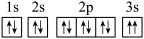 ,该同学所画的电子排布图违背了
,该同学所画的电子排布图违背了_______ 。
(4)常温下,等浓度的氟乙酸比氯乙酸的酸性更_______ (填“强”或“弱”),从物质结构角度说明其原因:_______ 。
(1)写出基态S原子的核外电子排布式:
(2)Ca(CN)2是离子化合物,其中CN-内部均满足各原子均满足8电子稳定结构,Ca(CN)2的电子式是
(3)Mg基态原子的核外电子排布图为
 ,该同学所画的电子排布图违背了
,该同学所画的电子排布图违背了(4)常温下,等浓度的氟乙酸比氯乙酸的酸性更
您最近一年使用:0次
名校
9 . 化合物H(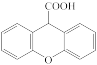 )是一种新药的中间体,可使用邻氯甲苯(
)是一种新药的中间体,可使用邻氯甲苯(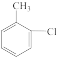 )为原料通过如图所示路线进行合成:
)为原料通过如图所示路线进行合成:
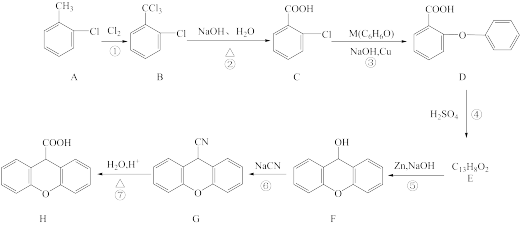
回答下列问题:
(1)已知C的系统命名法名称为2-氯苯甲酸,则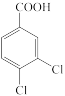 的系统命名法名称为
的系统命名法名称为____ 。
(2)反应③的化学方程式为____ 。
(3)为了区分F和H,有人提出有以下四种方案,其中可行的方案为____ (填字母)。
(4)E的结构简式为____ 。反应⑥的反应类型为____ 。
(5)化合物F的同分异构体中,能同时满足以下三个条件的有____ 种(不考虑立体异构)。
i.为芳香族化合物且两个六元芳环直接相连(除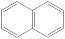 外)
外)
ii.含有两个取代基且不位于同一个六元芳环上
iii.能与FeCl3溶液作用显紫色,也能发生银镜反应
(6)只以CH3CH2OH为有机原料,任选无机试剂,仿照上述合成路线合成CH3CH2COOCH2CH3。____
 )是一种新药的中间体,可使用邻氯甲苯(
)是一种新药的中间体,可使用邻氯甲苯( )为原料通过如图所示路线进行合成:
)为原料通过如图所示路线进行合成:
回答下列问题:
(1)已知C的系统命名法名称为2-氯苯甲酸,则
 的系统命名法名称为
的系统命名法名称为(2)反应③的化学方程式为
(3)为了区分F和H,有人提出有以下四种方案,其中可行的方案为
| A.质谱仪测出最大质荷比 |
| B.观察核磁共振氢谱的峰的组数 |
| C.加入碳酸氢钠溶液,看是否有气泡产生 |
| D.加入Na,看是否有气泡产生 |
(5)化合物F的同分异构体中,能同时满足以下三个条件的有
i.为芳香族化合物且两个六元芳环直接相连(除
 外)
外)ii.含有两个取代基且不位于同一个六元芳环上
iii.能与FeCl3溶液作用显紫色,也能发生银镜反应
(6)只以CH3CH2OH为有机原料,任选无机试剂,仿照上述合成路线合成CH3CH2COOCH2CH3。
您最近一年使用:0次
2022高三·全国·专题练习
10 . 高技术领域常使用高纯试剂。纯磷酸(熔点为 ,易吸潮)可通过市售85%磷酸溶液减压蒸馏除水、结晶除杂得到,纯化过程需要严格控制温度和水分,温度低于
,易吸潮)可通过市售85%磷酸溶液减压蒸馏除水、结晶除杂得到,纯化过程需要严格控制温度和水分,温度低于 易形成
易形成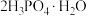 (熔点为
(熔点为 ),高于
),高于 则发生分子间脱水生成焦磷酸等。某兴趣小组为制备磷酸晶体设计的实验装置如下(夹持装置略):
则发生分子间脱水生成焦磷酸等。某兴趣小组为制备磷酸晶体设计的实验装置如下(夹持装置略):

回答下列问题:
(1)A的名称是___________ 。B的进水口为___________ (填“a”或“b”)。
(2) 的作用是
的作用是___________ 。
(3)空气流入毛细管的主要作用是防止___________ ,还具有搅拌和加速水逸出的作用。
(4)升高温度能提高除水速度,实验选用水浴加热的目的是___________ 。
(5)磷酸易形成过饱和溶液,难以结晶,可向过饱和溶液中加入___________ 促进其结晶。
(6)过滤磷酸晶体时,除了需要干燥的环境外,还需要控制温度为___________ (填标号)。
A. B.
B. C.
C.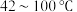
(7)磷酸中少量的水极难除去的原因是___________ 。
 ,易吸潮)可通过市售85%磷酸溶液减压蒸馏除水、结晶除杂得到,纯化过程需要严格控制温度和水分,温度低于
,易吸潮)可通过市售85%磷酸溶液减压蒸馏除水、结晶除杂得到,纯化过程需要严格控制温度和水分,温度低于 易形成
易形成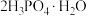 (熔点为
(熔点为 ),高于
),高于 则发生分子间脱水生成焦磷酸等。某兴趣小组为制备磷酸晶体设计的实验装置如下(夹持装置略):
则发生分子间脱水生成焦磷酸等。某兴趣小组为制备磷酸晶体设计的实验装置如下(夹持装置略):
回答下列问题:
(1)A的名称是
(2)
 的作用是
的作用是(3)空气流入毛细管的主要作用是防止
(4)升高温度能提高除水速度,实验选用水浴加热的目的是
(5)磷酸易形成过饱和溶液,难以结晶,可向过饱和溶液中加入
(6)过滤磷酸晶体时,除了需要干燥的环境外,还需要控制温度为
A.
 B.
B. C.
C.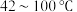
(7)磷酸中少量的水极难除去的原因是
您最近一年使用:0次
2022-07-12更新
|
9560次组卷
|
25卷引用:2022年海南省高考真题变式题15-19
(已下线)2022年海南省高考真题变式题15-19(已下线)专题16 化学实验综合题-2022年高考真题模拟题分项汇编2022年湖北省高考真题化学试题(已下线)2022年湖北省高考真题变式题16-19(已下线)考点53 化学实验方案设计与评价-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)专题16 化学实验综合题-备战2023年高考化学母题题源解密(广东卷)湖北省武汉市第一中学2022-2023学年高三上学期9月开学考试化学试题(已下线)第27讲 物质的制备与性质实验(讲)-2023年高考化学一轮复习讲练测(新教材新高考)(已下线)专题讲座(九) 化学实验中规范答题(讲)-2023年高考化学一轮复习讲练测(全国通用)(已下线)易错点32 物质的分离、提纯与检验-备战2023年高考化学考试易错题(已下线)热点情景汇编-专题十三 实验探究中的新思路江西省南昌市三校(一中、十中、铁一中)2022-2023学年高三上学期11月期中联考化学试题(已下线)第一部分 二轮专题突破 大题突破2 综合实验题题型研究江西省宜春市丰城第九中学重点班2022-2023学年高二下学期开学质量检测化学试题(已下线)专题19 实验综合题(已下线)专题19 实验综合题(已下线)第18练 化学实验综合题 -2023年【暑假分层作业】高二化学(2024届一轮复习通用)(已下线)专题15 化学实验综合题-2023年高考化学真题题源解密(新高考专用)(已下线)专题14 化学实验综合题-2023年高考化学真题题源解密(全国通用)云南省开远市第一中学校2022-2023学年高二下学期5月月考化学试题(已下线)考点48 实验方案设计与评价(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)考点4 化学实验方案设计与探究 (核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)(已下线)第3讲 物质制备实验的设计与评价湖南省衡阳市衡阳县第一中学2024届高三上学期11月月考化学试题(已下线)题型一 实验简答题答题规范-备战2024年高考化学答题技巧与模板构建



