名校
解题方法
1 . 向 和
和 混合溶液中滴加稀盐酸,
混合溶液中滴加稀盐酸, 的生成量与加入
的生成量与加入 盐酸的体积的关系如图所示。下列判断正确的是
盐酸的体积的关系如图所示。下列判断正确的是
 和
和 混合溶液中滴加稀盐酸,
混合溶液中滴加稀盐酸, 的生成量与加入
的生成量与加入 盐酸的体积的关系如图所示。下列判断正确的是
盐酸的体积的关系如图所示。下列判断正确的是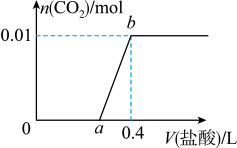
| A.在0-a范围内,只发生中和反应 |
B.ab段发生反应的离子方程式为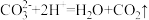 |
C. |
D.原混合溶液中 与Na2CO3的物质的量之比为 与Na2CO3的物质的量之比为 |
您最近一年使用:0次
2024-01-27更新
|
217次组卷
|
34卷引用:山东省枣庄市滕州市第一中学2022-2023学年高三上学期10月考试化学试题
山东省枣庄市滕州市第一中学2022-2023学年高三上学期10月考试化学试题山东省滨州市惠民县第二中学致远高中部2021-2022学年高三10月月考化学试题黑龙江省鹤岗市第一中学2021-2022学年高一上学期期末考试化学试题江西省新余市2021-2022学年高一上学期期末考试化学试题江西省抚州市临川区第一中学2021-2022学年高一下学期第一次月考化学试题浙江省宁波市六校2021-2022学年高一下学期期中联考化学试题(已下线)第06讲 钠及其化合物(练)-2023年高考化学一轮复习讲练测(新教材新高考)浙江省部分重点中学普通高中2022届高三学业水平模拟考试化学试题浙江省温州市瑞安市第六中学2021-2022学年高一下学期5月月考化学试题浙江省温州新力量联盟2022-2023学年高一上学期期中联考 化学试题上海市复兴高级中学2022-2023学年高三上学期10月月考化学试题青海省湟川中学2020-2021学年高一下学期开学考试化学试题新疆巴音郭楞蒙古自治州第二中学2021届高三上学期开学摸底考试化学试题浙江省宁波市效实中学2020-2021学年高一下学期期中考试化学(学考)试题浙江省丽水外国语实验学校2020-2021学年高一上学期第三次月考化学试题重庆市秀山高级中学校2021-2022学年高三上学期9月月考化学试题福建省莆田二中2019-2020学年高一上学期期末检测化学试题内蒙古自治区包钢第一中学2021-2022学年高三上学期10月月考化学试题浙江省诸暨市2016-2017学年高一上学期期末考试化学试题 (已下线)专题06 常见金属及其化合物-备战2022年高考化学学霸纠错(全国通用)浙江省诸暨市2017-2018学年高二下学期期末考试化学试题 浙江省当湖高级中学2021-2022学年高一上学期12月阶段性测试化学试题黑龙江省哈尔滨市第七十三中学校2020-2021学年高二下学期期中考试化学试题浙江省绍兴鲁迅高级中学2021-2022学年高一上学期期中考试化学试题浙江省湖州市2022-2023学年高一上学期期末检测化学试题(已下线)第三章 金属及其化合物 第12练 Na2CO3、NaHCO3碱金属(已下线)浙江省柯桥中学2023-2024学年高一上学期期中检测化学试题 河北省石家庄市第四十二中学2023-2024学年高一上学期第二次月考化学试题 安徽省合肥市第一中学2023-2024学年高一上学期素质拓展训练(四)化学试题浙江省杭州第十一中学2023-2024学年高一上学期期中考试化学试题15-2023新东方高一上期中考化学12-2023新东方高二上期中考化学12陕西省西安市周至县第六中学2023-2024学年高三上学期11月期中化学试题浙江省湖州市南浔高级中学2023-2024学年高一上学期十二月月考化学试题
解题方法
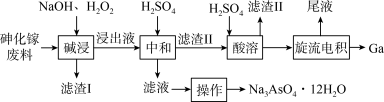
2 . 从砷化镓废料(主要成分为GaAs、Fe2O3、SiO2和CaCO3)中回收镓和砷的工艺流程如图所示,已知:Ga(OH)3是两性氢氧化物,其酸式电离和碱式电离的方程式如下: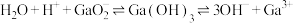 ,
, 时,Ga(OH)3的溶度积
时,Ga(OH)3的溶度积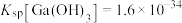 ,电离常数
,电离常数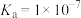 。下列说法
。下列说法不 正确的是
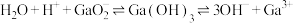 ,
, 时,Ga(OH)3的溶度积
时,Ga(OH)3的溶度积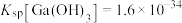 ,电离常数
,电离常数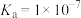 。下列说法
。下列说法
| A.“中和”过程中为提高镓的回收率,加硫酸调pH的最大值约是2 |
| B.“碱浸”时,H2O2既做氧化剂又做还原剂 |
C.“电解”时,阴极电极反应式: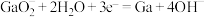 |
| D.电解尾液中溶质主要为H2SO4,可以循环利用,提高经济效益 |
您最近一年使用:0次
名校
3 . i.某温度时,在一个容积为2L的密闭容器中,X、Y、Z三种气态物质的物质的量随时间的变化曲线如图所示。已知:达平衡后,若其他条件不变将容器体积扩大为原来的2倍,其气体平均摩尔质量不变。

(1)反应开始时,容器中加入X的物质的量为___________ 。
(2)下列条件的改变能加快其反应速率的是___________ (填序号)。
①升高温度
②增加X的物质的量
③保持压强不变,充入He使容器的体积增大
④保持容积不变,充入He使体系压强增大
ii.
(3)将CO2转化为乙醇可以实现降碳,过程中发生的反应如下:
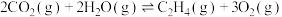

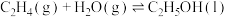



则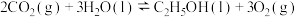

___________ 。
(4)将CO2转化为甲醇也可以实现降碳。
一定条件下,发生反应 。往2L恒容密闭容器中充入1molCO2和3molH2,在甲、乙不同催化剂作用下,反应时间均为tmin时,测得甲醇的物质的量分数随温度变化如图所示:
。往2L恒容密闭容器中充入1molCO2和3molH2,在甲、乙不同催化剂作用下,反应时间均为tmin时,测得甲醇的物质的量分数随温度变化如图所示:

①相同温度下催化剂效果更好的催化剂是___________ (填“甲”或“乙”)。 温度下,b点时甲醇的平均反应速率
温度下,b点时甲醇的平均反应速率
___________ 。
②在甲催化作用下,甲醇的物质的量分数随温度的升高呈现如图变化的原因是___________ 。
③在 和
和 温度下,平衡常数
温度下,平衡常数
___________  (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
④已知气体分压=气体总压×气体的物质的量分数。 温度下,反应开始时容器中的总压为
温度下,反应开始时容器中的总压为 ,该温度下反应的平衡常数
,该温度下反应的平衡常数
___________ 。

(1)反应开始时,容器中加入X的物质的量为
(2)下列条件的改变能加快其反应速率的是
①升高温度
②增加X的物质的量
③保持压强不变,充入He使容器的体积增大
④保持容积不变,充入He使体系压强增大
ii.
(3)将CO2转化为乙醇可以实现降碳,过程中发生的反应如下:
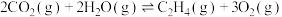

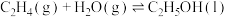



则
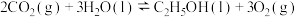

(4)将CO2转化为甲醇也可以实现降碳。
一定条件下,发生反应
 。往2L恒容密闭容器中充入1molCO2和3molH2,在甲、乙不同催化剂作用下,反应时间均为tmin时,测得甲醇的物质的量分数随温度变化如图所示:
。往2L恒容密闭容器中充入1molCO2和3molH2,在甲、乙不同催化剂作用下,反应时间均为tmin时,测得甲醇的物质的量分数随温度变化如图所示:
①相同温度下催化剂效果更好的催化剂是
 温度下,b点时甲醇的平均反应速率
温度下,b点时甲醇的平均反应速率
②在甲催化作用下,甲醇的物质的量分数随温度的升高呈现如图变化的原因是
③在
 和
和 温度下,平衡常数
温度下,平衡常数
 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。④已知气体分压=气体总压×气体的物质的量分数。
 温度下,反应开始时容器中的总压为
温度下,反应开始时容器中的总压为 ,该温度下反应的平衡常数
,该温度下反应的平衡常数
您最近一年使用:0次
名校
4 . 甲醇是重要的化工原料。科技工作者利用CH4、O2按照一定体积比在催化剂表面合成甲醇的反应,部分历程如下图所示(吸附在催化剂表面的物种用*标注,TS代表过渡态,H2O的作用是活化催化剂)。下列说法正确的是


| A.在催化剂表面上更容易被吸附的是H2O |
B.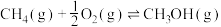  |
C.该反应过程的决速步为 ,加入催化剂可以降低反应的活化能,使 ,加入催化剂可以降低反应的活化能,使 减小 减小 |
| D.适时将甲醇分离出来,以空出催化剂活性中心继续使用 |
您最近一年使用:0次
5 . 我国力争2060年前实现碳中和。CH,与CO2催化重整是实现碳中和的热点研究课题。该催化重整反应体系主要涉及以下反应:
反应I:主反应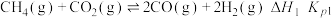
反应II:副反应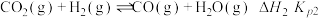
反应III:积碳反应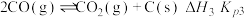
反应IV:积碳反应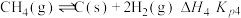
(1)已知H2(g)、CO(g)的燃烧热 分别为-285.8kJ⋅mol-1、﹣283.01kJ⋅mol-1,
分别为-285.8kJ⋅mol-1、﹣283.01kJ⋅mol-1,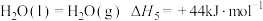 ,则反应II的
,则反应II的
___________  。
。
(2)下列关于该重整反应体系的说法正确的是___________。
(3)对于反应I:主反应 在pMPa时,将CO2和CH4按物质的量之比为1:1充入密闭容器中,分别在无催化剂及ZrO2催化下反应相同时间,测得CO2的转化率与温度的关系如图所示:
在pMPa时,将CO2和CH4按物质的量之比为1:1充入密闭容器中,分别在无催化剂及ZrO2催化下反应相同时间,测得CO2的转化率与温度的关系如图所示:

①a点CO2转化率相等的原因是___________ 。
②在pMPa、900℃、ZrO2催化条件下,将CO2、CH4、H2O按物质的量之比为1:1:n充入催化剂密闭容器,CO2的平衡转化率α大于50%,解释说明原因________ ,此时平衡常数
_________ (以分压表示,分压=总压×物质的量分数:写出含α、n、p的计算表达式)。
(4)以NaCl饱和溶液为电解质溶液,利用如图所示的装置将CO2转化为燃料CO。则电极II接电源的___________ 极,阴极上电极反应式为___________ 。

反应I:主反应
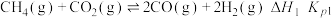
反应II:副反应
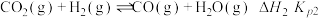
反应III:积碳反应
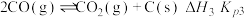
反应IV:积碳反应
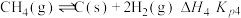
(1)已知H2(g)、CO(g)的燃烧热
 分别为-285.8kJ⋅mol-1、﹣283.01kJ⋅mol-1,
分别为-285.8kJ⋅mol-1、﹣283.01kJ⋅mol-1,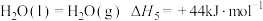 ,则反应II的
,则反应II的
 。
。(2)下列关于该重整反应体系的说法正确的是___________。
A.在投料时适当增大 的值,有利于减少积碳 的值,有利于减少积碳 |
| B.在一定条件下建立平衡后,移去部分积碳,反应Ⅲ和反应Ⅳ平衡均向右移 |
C.随着投料比 的增大,达到平衡时 的增大,达到平衡时 的转化率增大 的转化率增大 |
| D.降低反应温度,反应I、II、IV的正反应速率减小,逆反应速率增大;反应III的正反应速率增大,逆反应速率减小 |
(3)对于反应I:主反应
 在pMPa时,将CO2和CH4按物质的量之比为1:1充入密闭容器中,分别在无催化剂及ZrO2催化下反应相同时间,测得CO2的转化率与温度的关系如图所示:
在pMPa时,将CO2和CH4按物质的量之比为1:1充入密闭容器中,分别在无催化剂及ZrO2催化下反应相同时间,测得CO2的转化率与温度的关系如图所示:
①a点CO2转化率相等的原因是
②在pMPa、900℃、ZrO2催化条件下,将CO2、CH4、H2O按物质的量之比为1:1:n充入催化剂密闭容器,CO2的平衡转化率α大于50%,解释说明原因

(4)以NaCl饱和溶液为电解质溶液,利用如图所示的装置将CO2转化为燃料CO。则电极II接电源的

您最近一年使用:0次
6 . 锂系电池包括锂电池和锂离子电池,锂电池是一类由锂金属或锂合金为正/负极材料、使用非水电解质溶液的电池。1912年锂金属电池最早由GilbertN。Lewis提出并研究。20世纪70年代时,M。S。Whittingham提出并开始研究锂离子电池。
(1)全固态锂离子电池放电时电池发生反应: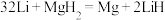 ,写出充电时,阴极反应式为
,写出充电时,阴极反应式为___________ 。
(2)上述锂离子电池可用于电解精炼法提纯镓,具体原理如图所示。
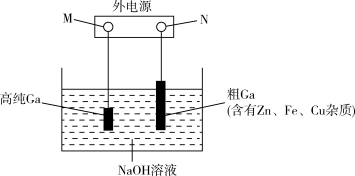
已知:金属活动性强弱顺序为:Zn>Ga>Fe>Cu,镓的化学性质与铝相似。
①M为电源的___________ 极,电解精炼镓时产生的,阳极泥的主要成分是___________ 。
②电解过程中阳极产生的离子迁移到阴极并在NaOH溶液阴极析出高纯镓。请写出电解过程中阴极析出高纯镓的电极反应式___________ 。
③电解过程中需控制合适的电压,若电压太高,阴极会产生H2导致电解效率下降。若外电路通过 ,阴极得到3.5g的镓,则该电解装置的电解效率η=
,阴极得到3.5g的镓,则该电解装置的电解效率η=___________ (η=生成目标产物消耗的电子数÷转移的电子总数)。
(3)上述锂离子电池也可用于氢碘酸“电解法”制备,装置下图所示。其中双极膜(BPM)是阴、阳复合膜,在直流电的作用下,阴、阳膜复合层间的H2O解离成 和
和 ;A、B为离子交换膜。B膜最佳应选择
;A、B为离子交换膜。B膜最佳应选择___________ 。少量的 因浓度差通过BPM膜,若撤去A膜,其缺点是
因浓度差通过BPM膜,若撤去A膜,其缺点是___________ 。

(1)全固态锂离子电池放电时电池发生反应:
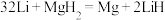 ,写出充电时,阴极反应式为
,写出充电时,阴极反应式为(2)上述锂离子电池可用于电解精炼法提纯镓,具体原理如图所示。

已知:金属活动性强弱顺序为:Zn>Ga>Fe>Cu,镓的化学性质与铝相似。
①M为电源的
②电解过程中阳极产生的离子迁移到阴极并在NaOH溶液阴极析出高纯镓。请写出电解过程中阴极析出高纯镓的电极反应式
③电解过程中需控制合适的电压,若电压太高,阴极会产生H2导致电解效率下降。若外电路通过
 ,阴极得到3.5g的镓,则该电解装置的电解效率η=
,阴极得到3.5g的镓,则该电解装置的电解效率η=(3)上述锂离子电池也可用于氢碘酸“电解法”制备,装置下图所示。其中双极膜(BPM)是阴、阳复合膜,在直流电的作用下,阴、阳膜复合层间的H2O解离成
 和
和 ;A、B为离子交换膜。B膜最佳应选择
;A、B为离子交换膜。B膜最佳应选择 因浓度差通过BPM膜,若撤去A膜,其缺点是
因浓度差通过BPM膜,若撤去A膜,其缺点是
您最近一年使用:0次
名校
解题方法
7 . 根据24 mL浓度为0.05 mol·L-1的Na2SO3溶液恰好与20 mL浓度为0.02 mol·L-1的K2M2O7溶液完全反应。已知Na2SO3被K2M2O7氧化为Na2SO4,则元素M在还原产物中的化合价为
| A.+1 | B.+2 | C.+3 | D.+6 |
您最近一年使用:0次
名校
解题方法
8 . 一定温度和压强下,用质量相等的CH4、CO2、O2、SO2四种气体分别吹出四个体积大小不同的气球,下列说法中不正确的是
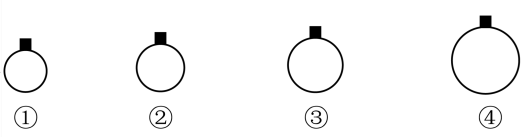

| A.气球②中装的是CO2 |
| B.气球①和气球③中气体分子数相等 |
| C.气球①和气球②中原子数之比为16:11 |
| D.气球③和气球④中气体体积之比为1:2 |
您最近一年使用:0次
2023-09-09更新
|
547次组卷
|
2卷引用:山东省枣庄市第三中学2022-2023学年高一上学期10月月考化学试题
名校
9 . 弱电解质的研究是重要课题。室温下,H2SeO3电离平衡体系中含Se微粒的物质的量分数与溶液PH的关系如图所示,回答下列问题:
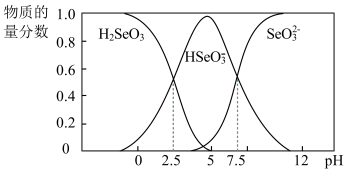
(1)写出NaHSeO3水解常数的表达式___________
(2)写出将将少量氢氧化钠溶液滴入H2SeO3溶液中的离子方程式:___________
(3)NaHSeO3溶液显___________ 性,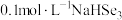 溶液中,离子浓度由大到小的顺序为
溶液中,离子浓度由大到小的顺序为___________ 。
(4)计算,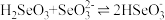 的平衡常数K=
的平衡常数K=___________

(1)写出NaHSeO3水解常数的表达式
(2)写出将将少量氢氧化钠溶液滴入H2SeO3溶液中的离子方程式:
(3)NaHSeO3溶液显
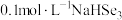 溶液中,离子浓度由大到小的顺序为
溶液中,离子浓度由大到小的顺序为(4)计算,
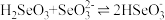 的平衡常数K=
的平衡常数K=
您最近一年使用:0次
2023-09-02更新
|
321次组卷
|
2卷引用:山东省聊城第一中学2022-2023学年高二上学期11月期中考试化学试题
名校
解题方法
10 . 氨性硫代硫酸盐浸金是一种高效的黄金浸取工艺。
(1)金可在硫代硫酸钠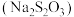 溶液中缓慢溶解:
溶液中缓慢溶解: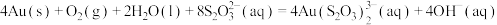 。
。
① 含Au
含Au 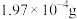 金矿中,加入
金矿中,加入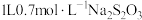 溶液,10小时后,金的浸出率为0.1%,则浸出过程
溶液,10小时后,金的浸出率为0.1%,则浸出过程 的平均消耗速率为
的平均消耗速率为___________  。
。
②为提高金的浸出速率,可采取的措施为___________ 。
(2) 可催化金在
可催化金在 溶液中的溶解,其电化学催化腐蚀过程如图所示。
溶液中的溶解,其电化学催化腐蚀过程如图所示。
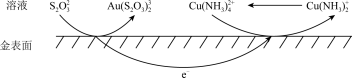
①负极的电极反应式为___________ 。
②正极可能的催化过程如下:
a.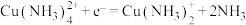
b.___________
③反应温度对金的浸出率影响如图所示。分析50℃时金浸出率最高的原因是___________ 。

(3)为研究浸金过程 与
与 的反应,进行如下实验:向
的反应,进行如下实验:向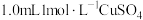 溶液中加入
溶液中加入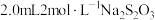 溶液,溶液从蓝色变为绿色,后逐渐变浅至无色。体系中涉及的反应如下:
溶液,溶液从蓝色变为绿色,后逐渐变浅至无色。体系中涉及的反应如下:
ⅰ.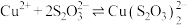 (绿色)
(绿色) 
ⅱ.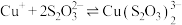 (无色)
(无色) 
ⅲ.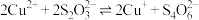

由实验现象可推测:反应ⅰ的速率___________ 反应ⅲ的速率(填“>”或“<”)、
___________  。
。
(4)若采用 催化硫代硫酸盐浸金,催化效果较
催化硫代硫酸盐浸金,催化效果较 差的原因是
差的原因是___________ 。
(1)金可在硫代硫酸钠
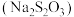 溶液中缓慢溶解:
溶液中缓慢溶解: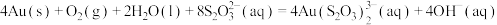 。
。①
 含Au
含Au 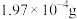 金矿中,加入
金矿中,加入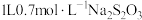 溶液,10小时后,金的浸出率为0.1%,则浸出过程
溶液,10小时后,金的浸出率为0.1%,则浸出过程 的平均消耗速率为
的平均消耗速率为 。
。②为提高金的浸出速率,可采取的措施为
(2)
 可催化金在
可催化金在 溶液中的溶解,其电化学催化腐蚀过程如图所示。
溶液中的溶解,其电化学催化腐蚀过程如图所示。
①负极的电极反应式为
②正极可能的催化过程如下:
a.
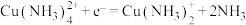
b.
③反应温度对金的浸出率影响如图所示。分析50℃时金浸出率最高的原因是

(3)为研究浸金过程
 与
与 的反应,进行如下实验:向
的反应,进行如下实验:向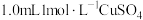 溶液中加入
溶液中加入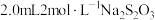 溶液,溶液从蓝色变为绿色,后逐渐变浅至无色。体系中涉及的反应如下:
溶液,溶液从蓝色变为绿色,后逐渐变浅至无色。体系中涉及的反应如下:ⅰ.
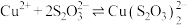 (绿色)
(绿色) 
ⅱ.
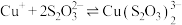 (无色)
(无色) 
ⅲ.
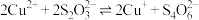

由实验现象可推测:反应ⅰ的速率

 。
。(4)若采用
 催化硫代硫酸盐浸金,催化效果较
催化硫代硫酸盐浸金,催化效果较 差的原因是
差的原因是
您最近一年使用:0次
2023-08-05更新
|
271次组卷
|
5卷引用:山东省泰安市2022-2023学年高二上学期期末考试化学试题



