名校
1 . 化合物H是有机合成重要的中间体,其合成路线如图。________________ 。
(2)B与H的相对分子质量接近,H的沸点高于B的原因为___________________________ 。
(3)E→F所需的条件为_________________________ 。
(4)化合物G的结构简式为_____________________________ 。
(5)B的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式:_______________________ 。
①能与 溶液发生显色反应。
溶液发生显色反应。
②碱性水解后酸化,所得两种有机产物分子均只有2种不同化学环境的氢原子。
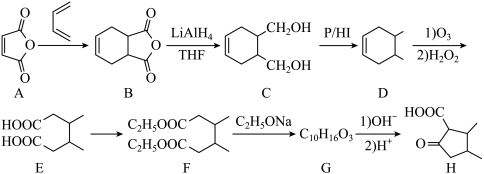
(6)以乙烯和2-丁烯( )为原料,制备
)为原料,制备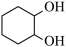 的合成路线流程图
的合成路线流程图________________ 。(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)
已知:
(2)B与H的相对分子质量接近,H的沸点高于B的原因为
(3)E→F所需的条件为
(4)化合物G的结构简式为
(5)B的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式:
①能与
 溶液发生显色反应。
溶液发生显色反应。②碱性水解后酸化,所得两种有机产物分子均只有2种不同化学环境的氢原子。
(6)以乙烯和2-丁烯(
 )为原料,制备
)为原料,制备 的合成路线流程图
的合成路线流程图
您最近一年使用:0次
2024-02-16更新
|
209次组卷
|
5卷引用:甘肃省永昌县第一高级中学2021-2022学年高二下学期期中考试化学试题
甘肃省永昌县第一高级中学2021-2022学年高二下学期期中考试化学试题 江苏省苏州市2020-2021学年高二上学期学业质量阳光指标调研化学试题江苏省溧水高级中学2020-2021学年高二下学期4月调研化学试题江苏省锡东高级中学2023-2024学年高二上学期期末考试化学试卷(已下线)猜想08 有机合成与推断【考题猜想】(7大题型)-2023-2024学年高二化学下学期期末考点大串讲(人教版2019)
名校
解题方法
2 . 某温度下,恒容密闭容器内发生反应:H2(g)+I2 g)  2HI(g) △H<0, 该温度下,K=43,某时刻,测得容器内 H2、I2、HI的浓度依次为0.01 mol/L、0.01 mol/L、0.02 mol/L。一段时间后,下列情况与事实相符的是
2HI(g) △H<0, 该温度下,K=43,某时刻,测得容器内 H2、I2、HI的浓度依次为0.01 mol/L、0.01 mol/L、0.02 mol/L。一段时间后,下列情况与事实相符的是
 2HI(g) △H<0, 该温度下,K=43,某时刻,测得容器内 H2、I2、HI的浓度依次为0.01 mol/L、0.01 mol/L、0.02 mol/L。一段时间后,下列情况与事实相符的是
2HI(g) △H<0, 该温度下,K=43,某时刻,测得容器内 H2、I2、HI的浓度依次为0.01 mol/L、0.01 mol/L、0.02 mol/L。一段时间后,下列情况与事实相符的是| A.混合气体颜色变深 | B.混合气体密度变大 |
| C.容器内压强变小 | D.氢气的体积分数变小 |
您最近一年使用:0次
2023-10-21更新
|
689次组卷
|
25卷引用:甘肃省兰州第一中学2022-2023学年高二上学期期末考试化学试题
甘肃省兰州第一中学2022-2023学年高二上学期期末考试化学试题北京市海淀区2021~2022学年高二上学期期末化学试题(已下线)第04练 化学平衡-2022年【寒假分层作业】高二化学(人教版2019选择性必修1)安徽省舒城中学2021-2022学年高二下学期第一次月考化学试题天津市外国语大学附属外国语学校2021-2022学年高二上学期期末检测化学试题四川省南充市2021-2022学年高二下学期期末考试化学试题北京市铁路第二中学2022-2023学年高二上学期期中检测化学试题湖北省宜昌英杰学校2022-2023学年高二上学期10月测试化学试题北京市第三十五中学2022-2023学年高二上学期10月月考化学试题陕西省洛南中学2022-2023学年高二上学期10月月考化学试题北京市海淀区2020届高三上学期期末考试化学试题天津市河北区2020届高三年级“停课不停学”期间线上测试化学试题吉林省汪清县汪清四中2021-2022学年高二上学期第一次阶段考试化学试题 陕西省咸阳市武功县2021--2022学年高二上学期质量调研化学试题天津市南开区2023届高三下学期质量监测 ( 二 ) 化学试题(已下线)考点2 化学平衡 (核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)天津市第一中学2023-2024学年高二上学期10月月考化学试题北京市海淀区2023-2024学年高二上学期期中考试化学试题北京市和平街第一中学2023-2024学年高二上学期10月阶段性练习化学试题北京市第五十中学2023-2024学年高二上学期期中考试化学试题北京市广渠门中学2023-2024学年高二上学期期中考试化学试题 北京市第一六一中学2023-2024学年高二上学期10月月考化学试题安徽省合肥卓越中学2023-2024学年高二上学期期中考试化学试题北京市北京师范大学附属中学平谷第一分校2023-2024学年高二上学期期中考试化学试题天津市南开中学2023-2024学年高三下学期第四次月考化学试卷
名校
解题方法
3 . I.室温时,向100mL 0.1 HCl溶液中滴加0.1
HCl溶液中滴加0.1 氨水,得到溶液pH与氨水体积的关系曲线如图所示:
氨水,得到溶液pH与氨水体积的关系曲线如图所示:
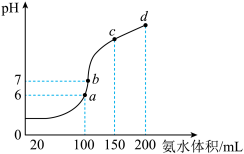
(1)试分析图中a、b、c、d四个点,水的电离程度最大的是______________ ;
(2)在b点,溶液中各离子浓度由大到小的排列顺序是_____________________________ ;
(3)写出a点混合溶液中下列算式的精确结果(不能近似计算):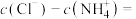
_______________ ;
(4)25℃时,同浓度的下列溶液:①HCl;② ;③
;③ ;④
;④ ,其中pH由大到小的顺序是
,其中pH由大到小的顺序是_________________ 。
II.我国《生活饮用水卫生标准》中规定生活用水中镉的排放量不超过0.005mg/L。处理镉废水可采用化学沉淀法。
(5)一定温度下, 的
的 ,
, 的
的 ,该温度下
,该温度下______________ [填“ ”或“
”或“ ”]的饱和溶液中
”]的饱和溶液中 浓度较大。
浓度较大。
(6)向某含镉废水中加入 ,当
,当 浓度达到
浓度达到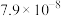 mol/L时,废水中
mol/L时,废水中 的浓度为
的浓度为___________________ mol/L[已知: ,此时
,此时______________ (填“符合”或“不符合”)《生活饮用水卫生标准》。
 HCl溶液中滴加0.1
HCl溶液中滴加0.1 氨水,得到溶液pH与氨水体积的关系曲线如图所示:
氨水,得到溶液pH与氨水体积的关系曲线如图所示:
(1)试分析图中a、b、c、d四个点,水的电离程度最大的是
(2)在b点,溶液中各离子浓度由大到小的排列顺序是
(3)写出a点混合溶液中下列算式的精确结果(不能近似计算):
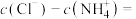
(4)25℃时,同浓度的下列溶液:①HCl;②
 ;③
;③ ;④
;④ ,其中pH由大到小的顺序是
,其中pH由大到小的顺序是II.我国《生活饮用水卫生标准》中规定生活用水中镉的排放量不超过0.005mg/L。处理镉废水可采用化学沉淀法。
(5)一定温度下,
 的
的 ,
, 的
的 ,该温度下
,该温度下 ”或“
”或“ ”]的饱和溶液中
”]的饱和溶液中 浓度较大。
浓度较大。(6)向某含镉废水中加入
 ,当
,当 浓度达到
浓度达到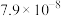 mol/L时,废水中
mol/L时,废水中 的浓度为
的浓度为 ,此时
,此时
您最近一年使用:0次
名校
解题方法
4 . 离子液体被认为是21世纪理想的绿色溶剂,是指室温或者接近室温时呈液态,而本身由阴、阳离子构成的化合物。氯代1-丁基-3-甲基咪唑离子液{[bmim]Cl}可以与GaCl3混合形成离子液体;[bmim]Cl也可以转化成其他离子液体。如图是[bmim]Cl与NH4BF4离子交换反应合成离子液体[bmim]BF4的流程。

(1)NH4BF4中N原子的杂化方式为_____ ,BF 的空间构型为
的空间构型为_____ 。
(2)已知分子中的大π键可以用Π 表示,其中m代表参与形成大π键的原子数,n代表大π键中的电子数,则[bmim]+中大π键可以表示为
表示,其中m代表参与形成大π键的原子数,n代表大π键中的电子数,则[bmim]+中大π键可以表示为_____ 。
(3)GaCl3的熔点为77.8℃,则GaCl3的晶体类型为_____ ,GaCl3和[bmim]Cl混合形成离子液体的过程中会存在以下转化:GaCl3 GaCl
GaCl
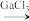 Ga2Cl
Ga2Cl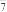 ,已知Ga2Cl
,已知Ga2Cl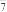 中含有两个配位键,试画出Ga2Cl
中含有两个配位键,试画出Ga2Cl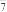 的结构式:
的结构式:_____ 。
(4)氟及其化合物的用途非常广泛。
①AsF3、IF 、OF2、BeF2中价层电子对数不同于其他微粒的立体构型为
、OF2、BeF2中价层电子对数不同于其他微粒的立体构型为_____ 。
②基于CaF2设计的Born-Haber循环如图所示。

钙的第一电离能为_____ kJ•mol-1;F-F键的键能为_____ kJ•mol-1。

(1)NH4BF4中N原子的杂化方式为
 的空间构型为
的空间构型为(2)已知分子中的大π键可以用Π
 表示,其中m代表参与形成大π键的原子数,n代表大π键中的电子数,则[bmim]+中大π键可以表示为
表示,其中m代表参与形成大π键的原子数,n代表大π键中的电子数,则[bmim]+中大π键可以表示为(3)GaCl3的熔点为77.8℃,则GaCl3的晶体类型为
 GaCl
GaCl
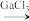 Ga2Cl
Ga2Cl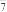 ,已知Ga2Cl
,已知Ga2Cl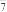 中含有两个配位键,试画出Ga2Cl
中含有两个配位键,试画出Ga2Cl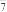 的结构式:
的结构式:(4)氟及其化合物的用途非常广泛。
①AsF3、IF
 、OF2、BeF2中价层电子对数不同于其他微粒的立体构型为
、OF2、BeF2中价层电子对数不同于其他微粒的立体构型为②基于CaF2设计的Born-Haber循环如图所示。

钙的第一电离能为
您最近一年使用:0次
名校
解题方法
5 . N、Cu等元素的化合物在工农业生产中有着广泛的应用。
(1)下列N元素的电子排布式表示的状态中,失去一个电子所需能量最低的为_____ (填字母)。
(2)NF3是一种优良的等离子蚀刻气体,在芯片制造、高能激光器领域有广泛应用,NF3是_____ (填“极性”或“非极性”)分子。
(3)向含少量CuSO4的水溶液中逐滴滴入氨水,生成蓝色沉淀,继续滴加氨水至过量,沉淀溶解,得到深蓝色溶液,写出沉淀溶解的离子方程式:_____ 。
(4)一种铜金合金具有储氢功能,其晶体为面心立方最密堆积结构,晶胞中Cu原子处于面心,Au原子处于顶点,则Au原子的配位数为______ 。该储氢材料储氢时,氢分子可进入由Cu原子与Au原子构成的四面体空隙中。若将Cu原子与Au原子等同看待,该晶体储氢后的晶胞结构与ZnS的结构相似(如图),该晶体储氢后的化学式为_____ 。

(5)Cu元素与Br元素形成的化合物的晶胞结构亦如图(白球代表Br,黑球代表Cu),该晶胞沿z轴(图)在平面的投影图中,Cu原子构成的几何图形是_____ 。若晶胞的密度为dg•cm-3,则Cu原子与Br原子之间的最短距离为____ (列出计算式即可,NA表示阿伏加德罗常数的值)。

(1)下列N元素的电子排布式表示的状态中,失去一个电子所需能量最低的为
A.1s22s22p 2p 2p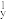 2p 2p | B.1s22s22p 2p 2p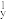 3s1 3s1 |
C.1s22s22p 2p 2p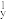 | D.1s22s22p 3s1 3s1 |
(3)向含少量CuSO4的水溶液中逐滴滴入氨水,生成蓝色沉淀,继续滴加氨水至过量,沉淀溶解,得到深蓝色溶液,写出沉淀溶解的离子方程式:
(4)一种铜金合金具有储氢功能,其晶体为面心立方最密堆积结构,晶胞中Cu原子处于面心,Au原子处于顶点,则Au原子的配位数为

(5)Cu元素与Br元素形成的化合物的晶胞结构亦如图(白球代表Br,黑球代表Cu),该晶胞沿z轴(图)在平面的投影图中,Cu原子构成的几何图形是

您最近一年使用:0次
2022-12-16更新
|
139次组卷
|
2卷引用:甘肃省张掖市高台县第一中学2022-2023学年高二上学期12月月考化学试题
名校
6 . 一氧化二氯(Cl2O)是国际公认的高效安全灭菌消毒剂,其部分性质如下:现用如图所示装置制备少量Cl2O。
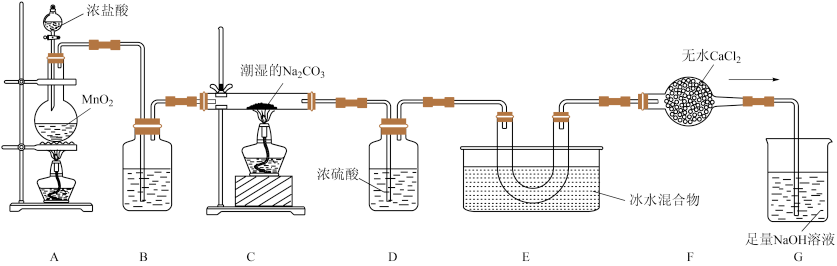
已知:常温下,Cl2O是棕黄色、有刺激性气味的气体,易溶于水;熔点:-120.6°C;沸点2.0°C。
(1)盛有浓盐酸的仪器的名称是_________________ 。
(2)装置A中发生反应的离子方程式为___________ 。
(3)装置B中的试剂是_______ (填名称)。
(4)装置C中固体产物为NaCl和NaHCO3,写出该反应的化学方程式________ 。
(5)装置E中Cl2O的收率与装置C的温度和纯碱的含水量的关系如表所示,下列猜想明显不合理的是。
(6)C中盛装含水碳酸钠(即Na2CO3与水按照质量106:9调制而成),用来吸收氯气制备Cl2O。如果用Na2CO3·xH2O表示含水碳酸钠,则x为__________ 。

已知:常温下,Cl2O是棕黄色、有刺激性气味的气体,易溶于水;熔点:-120.6°C;沸点2.0°C。
(1)盛有浓盐酸的仪器的名称是
(2)装置A中发生反应的离子方程式为
(3)装置B中的试剂是
(4)装置C中固体产物为NaCl和NaHCO3,写出该反应的化学方程式
(5)装置E中Cl2O的收率与装置C的温度和纯碱的含水量的关系如表所示,下列猜想明显不合理的是。
温度/°C | 纯碱含水量/% | Cl2O收率/% |
0~10 | 5.44 | 67.85 |
0~10 | 7.88 | 89.26 |
10~20 | 8.00 | 64.24 |
30~40 | 10.25 | 52.63 |
30~40 | 12.50 | 30.38 |
| A.温度越高,Cl2O的收率越低 |
| B.纯碱含水量越高,Cl2O的收率越高 |
| C.随着纯碱含水量增大,Cl2O的收率先增大后减小 |
| D.温度较低时,纯碱含水量越高,Cl2O的收率越高,温度较高时,纯碱含水量越高,Cl2O的收率越低 |
您最近一年使用:0次
2022-12-16更新
|
326次组卷
|
8卷引用:甘肃省张掖市高台县第一中学2022-2023学年高一上学期期中考试化学试题
名校
解题方法
7 . 图是有关物质的转化,下列说法不正确的是


| A.转化①②③④均有可能通过化合反应来实现 |
| B.X一定含有碳元素 |
| C.转化④需吸收热量 |
| D.若X是碳,转化①也可以反向进行 |
您最近一年使用:0次
2022-12-11更新
|
241次组卷
|
3卷引用:甘肃省张掖市、陇南2地联考2022-2023学年高一上学期12月期中考试化学试题
名校
解题方法
8 . 已知
 ,平衡体系中气体的平均摩尔质量(
,平衡体系中气体的平均摩尔质量(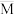 )在不同温度下随压强p的变化曲线如图所示。下列说法正确的是
)在不同温度下随压强p的变化曲线如图所示。下列说法正确的是
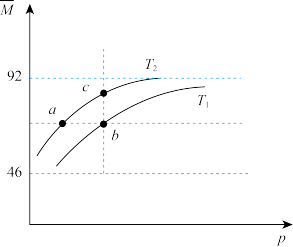

 ,平衡体系中气体的平均摩尔质量(
,平衡体系中气体的平均摩尔质量(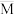 )在不同温度下随压强p的变化曲线如图所示。下列说法正确的是
)在不同温度下随压强p的变化曲线如图所示。下列说法正确的是
A.温度: |
B.平衡常数: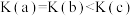 |
C.反应速率: |
D.当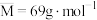 时, 时,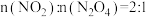 |
您最近一年使用:0次
2022-12-04更新
|
554次组卷
|
11卷引用:甘肃省张掖市高台县第一中学2022-2023学年高三上学期期中检测化学试题
甘肃省张掖市高台县第一中学2022-2023学年高三上学期期中检测化学试题山东省枣庄滕州市2022-2023学年高三上学期期中考试化学试题山东省滕州市第二中学2022-2023学年高三上学期11月定时检测化学试题河北省张家口市2017-2018学年高二上学期期末考试化学试题安徽省淮北市树人高级中学2020-2021学年高二上学期第四阶段考试化学试题安徽省黄山市屯溪第一中学2021-2022学年高二上学期期中考试化学试题湖北省石首市第一中学2021-2022学年高二上学期10月月考化学试题湖北省石首市第一中学2021-2022学年高二上学期12月月考化学试题江西省景德镇一中2022-2023学年高一下学期期中考试(18班)化学试题.第二章 章末训练重庆市长寿中学校2022-2023学年高二上学期1月期末考试化学试题
名校
解题方法
9 . 某校化学实验兴趣小组为了探究在实验室制备 的过程中有水蒸气和HCl挥发出来,同时证明氯气的某些性质,甲同学设计了如图所示的实验装置(支撑用的铁架台省略),按要求回答问题,已知:
的过程中有水蒸气和HCl挥发出来,同时证明氯气的某些性质,甲同学设计了如图所示的实验装置(支撑用的铁架台省略),按要求回答问题,已知: 易溶于
易溶于 ,HCl不溶于
,HCl不溶于 。
。
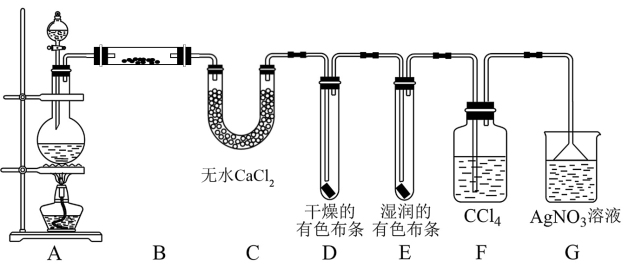
(1)A中发生反应的化学方程式为:_______ ;
(2)装置B的作用是_______ ;
(3)写出氯气和水发生反应的离子方程式_______ ,装置D和E中出现的不同现象说明_______ 。
(4)装置F的作用是_______ 。
(5)写出装置G中发生反应的化学方程式_______
(6)乙同学认为甲同学的实验有缺陷,不能确保最终通入 溶液中的气体只有一种,为了确保实验结论的可靠性,证明最终通入
溶液中的气体只有一种,为了确保实验结论的可靠性,证明最终通入 溶液的气体只有一种,乙同学提出在某两个装置之间再加一个装置。你认为该装置应加在
溶液的气体只有一种,乙同学提出在某两个装置之间再加一个装置。你认为该装置应加在_______ 与_______ 之间(填装置字母序号),装置中应放入_______ (填写试剂或用品名称)。
 的过程中有水蒸气和HCl挥发出来,同时证明氯气的某些性质,甲同学设计了如图所示的实验装置(支撑用的铁架台省略),按要求回答问题,已知:
的过程中有水蒸气和HCl挥发出来,同时证明氯气的某些性质,甲同学设计了如图所示的实验装置(支撑用的铁架台省略),按要求回答问题,已知: 易溶于
易溶于 ,HCl不溶于
,HCl不溶于 。
。
(1)A中发生反应的化学方程式为:
(2)装置B的作用是
(3)写出氯气和水发生反应的离子方程式
(4)装置F的作用是
(5)写出装置G中发生反应的化学方程式
(6)乙同学认为甲同学的实验有缺陷,不能确保最终通入
 溶液中的气体只有一种,为了确保实验结论的可靠性,证明最终通入
溶液中的气体只有一种,为了确保实验结论的可靠性,证明最终通入 溶液的气体只有一种,乙同学提出在某两个装置之间再加一个装置。你认为该装置应加在
溶液的气体只有一种,乙同学提出在某两个装置之间再加一个装置。你认为该装置应加在
您最近一年使用:0次
名校
解题方法
10 . 已知草酸镍晶体( )难溶于水,常用于制镍粉。工业上从废镍催化剂(主要成分为Ni,含有一定量的Al2O3、FeO、SiO2、CaO等)制备草酸镍的流程如图所示:
)难溶于水,常用于制镍粉。工业上从废镍催化剂(主要成分为Ni,含有一定量的Al2O3、FeO、SiO2、CaO等)制备草酸镍的流程如图所示: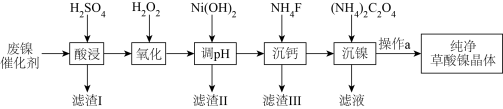
已知:①相关金属离子生成氢氧化物沉淀的pH见表中数据:
②Ksp(CaF2)=1.46 ③当某物质浓度小于1
③当某物质浓度小于1 时,视为完全沉淀
时,视为完全沉淀
回答下列问题:
(1)写出一种能提高“酸浸”速率的措施_______ 。滤渣Ⅰ的成分为 和
和_______ (填化学式)。
(2)“氧化”时反应的离子方程式为_______ 。
(3)“调 ”的范围为
”的范围为_______ ,用化学反应原理的相关知识简要说明滤渣Ⅱ的形成原因_______ 。
(4)“沉钙”过程中,当 沉淀完全时,溶液中
沉淀完全时,溶液中
_______  (列出计算式即可)。
(列出计算式即可)。
(5)“沉镍”时的离子方程式为_______ 。
(6)操作a包含过滤、用乙醇洗涤、110℃下烘干等步骤,其中用乙醇洗涤的目的是洗去杂质和_______ 。
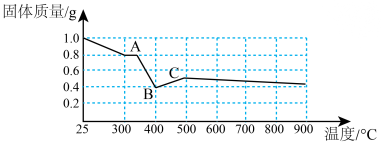
(7)某化学研究小组在文献中查阅到: 受热分解时,固体质量随温度变化的曲线如图所示,写出加热到400℃时,
受热分解时,固体质量随温度变化的曲线如图所示,写出加热到400℃时, 晶体受热分解的化学方程式为
晶体受热分解的化学方程式为_______ 。
 )难溶于水,常用于制镍粉。工业上从废镍催化剂(主要成分为Ni,含有一定量的Al2O3、FeO、SiO2、CaO等)制备草酸镍的流程如图所示:
)难溶于水,常用于制镍粉。工业上从废镍催化剂(主要成分为Ni,含有一定量的Al2O3、FeO、SiO2、CaO等)制备草酸镍的流程如图所示:
已知:①相关金属离子生成氢氧化物沉淀的pH见表中数据:
| 金属离子 | Fe3+ | Fe2+ | Al3+ | Ni2+ |
| 开始沉淀的pH | 1.1 | 5.8 | 3.0 | 6.8 |
| 完全沉淀的pH | 3.2 | 8.8 | 5.0 | 9.5 |
 ③当某物质浓度小于1
③当某物质浓度小于1 时,视为完全沉淀
时,视为完全沉淀回答下列问题:
(1)写出一种能提高“酸浸”速率的措施
 和
和(2)“氧化”时反应的离子方程式为
(3)“调
 ”的范围为
”的范围为(4)“沉钙”过程中,当
 沉淀完全时,溶液中
沉淀完全时,溶液中
 (列出计算式即可)。
(列出计算式即可)。(5)“沉镍”时的离子方程式为
(6)操作a包含过滤、用乙醇洗涤、110℃下烘干等步骤,其中用乙醇洗涤的目的是洗去杂质和
(7)某化学研究小组在文献中查阅到:
 受热分解时,固体质量随温度变化的曲线如图所示,写出加热到400℃时,
受热分解时,固体质量随温度变化的曲线如图所示,写出加热到400℃时, 晶体受热分解的化学方程式为
晶体受热分解的化学方程式为
您最近一年使用:0次



