名校
解题方法
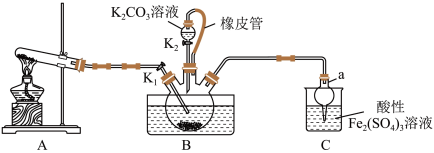
1 . 硫氰化钾(KSCN)是一种用途广泛的化工原料,常用于染料、药物的生产。实验小组设计如图实验装置模拟工业制备 KSCN 并进行相关探究实验。___________ 。
(2)装置A用于实验室制备氨气,反应的化学方程式为___________ 。
(3)装置B中,三颈烧瓶内盛放有 CS₂、水和固体催化剂,通入氨气的导管口需要浸没在 CS₂液体中,其目的是___________ (写两点)。
(4)KSCN 溶液的制备:实验开始时打开K₁,加热装置A、D,待三颈烧瓶内液体不分层后,熄灭装置A处的酒精灯,关闭K₁,移开水浴。将装置B继续加热至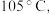 待 NH₄HS 完全分解后(
待 NH₄HS 完全分解后(  打开 K₂,缓缓滴入适量的)
打开 K₂,缓缓滴入适量的)  溶液,继续加热有气泡产生,制得KSCN 溶液,该反应的化学方程式是
溶液,继续加热有气泡产生,制得KSCN 溶液,该反应的化学方程式是___________ 。
(5)尾气处理:装置C 中仪器a的名称是___________ ,酸性Fe₂(SO₄)₃溶液用于除去尾气中两种污染性气体,其中一种气体M能使酚酞溶液变红,另一种气体N能使溶液产生淡黄色沉淀,写出除去气体N的离子方程式___________ 。
(6)过滤装置C中吸收尾气后的悬浊液,得到滤液x。取少量滤液x进行如图实验[已知 (白色)]:
(白色)]:___________ [可供选择的试剂: 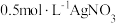 溶液、
溶液、 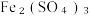 溶液、
溶液、 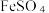 溶液、
溶液、  溶液]。
溶液]。

(2)装置A用于实验室制备氨气,反应的化学方程式为
(3)装置B中,三颈烧瓶内盛放有 CS₂、水和固体催化剂,通入氨气的导管口需要浸没在 CS₂液体中,其目的是
(4)KSCN 溶液的制备:实验开始时打开K₁,加热装置A、D,待三颈烧瓶内液体不分层后,熄灭装置A处的酒精灯,关闭K₁,移开水浴。将装置B继续加热至
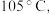 待 NH₄HS 完全分解后(
待 NH₄HS 完全分解后(  打开 K₂,缓缓滴入适量的)
打开 K₂,缓缓滴入适量的)  溶液,继续加热有气泡产生,制得KSCN 溶液,该反应的化学方程式是
溶液,继续加热有气泡产生,制得KSCN 溶液,该反应的化学方程式是(5)尾气处理:装置C 中仪器a的名称是
(6)过滤装置C中吸收尾气后的悬浊液,得到滤液x。取少量滤液x进行如图实验[已知
 (白色)]:
(白色)]: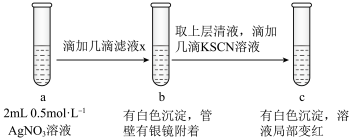
 溶液、
溶液、 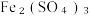 溶液、
溶液、 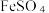 溶液、
溶液、  溶液]。
溶液]。
您最近一年使用:0次
2024-04-16更新
|
279次组卷
|
2卷引用:福建师范大学附属中学2021-2022学年高一下学期期末考试化学试题
名校
解题方法
2 . I.已知:金属钠和空气可以制备纯度较高的 ,反应原理是:
,反应原理是: ,并且
,并且 易与空气中
易与空气中 、水蒸气反应。现用金属钠和空气制备纯度较高的
、水蒸气反应。现用金属钠和空气制备纯度较高的 ,可利用的装置如图所示。回答下列问题:
,可利用的装置如图所示。回答下列问题:
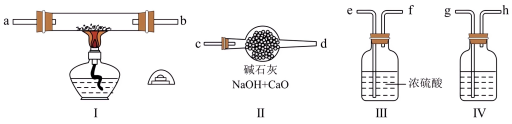
(1)装置Ⅳ中盛放的试剂是_______ ,其作用是_________ 。
(2)若规定气体的气流方向从左到右,则组合实验装置时各接口的连接顺序为:______ →d。
(3)装置Ⅱ的作用是___________ 。
(4)操作中通空气和加热的先后顺序为___________ 。
Ⅱ.为了探究过氧化钠的强氧化性,某小组设计了如图所示的实验装置。
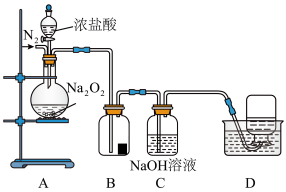
实验步骤及现象如下:
①检查装置气密性后,装入药品并连接装置A、B、C。
②缓慢通入一定量的 后,将装置D连接好(导管末端未伸入集气瓶中),再向圆底烧瓶中缓慢滴加浓盐酸,装置A中剧烈反应,有气体产生。
后,将装置D连接好(导管末端未伸入集气瓶中),再向圆底烧瓶中缓慢滴加浓盐酸,装置A中剧烈反应,有气体产生。
③待装置D中导管口产生连续气泡后,将导管末端伸入集气瓶中,收集到无色气体。
④反应一段时间后,关闭活塞,再通一段时间N₂,直至装置中气体变为无色。
回答下列问题:
(5)装置A中盛装浓盐酸的仪器名称是______ 。
(6)实验中观察到B中湿润的红色纸条褪色,说明在浓盐酸和 的反应中有
的反应中有______ (填化学式)生成。
(7)实验中,在D的集气瓶中收集到能使带火星木条复燃的无色气体,有同学认为该气体是 被浓盐酸还原所得,从氧化还原角度分析该推断是否合理并说明理由?
被浓盐酸还原所得,从氧化还原角度分析该推断是否合理并说明理由?___________ 。
(8)还有同学认为D的集气瓶中收集到的气体是 与浓盐酸中的水反应得到。通过实验证实
与浓盐酸中的水反应得到。通过实验证实 与干燥的
与干燥的 能反应,请完成并配平该化学方程式:
能反应,请完成并配平该化学方程式:________ ,___ +____
+____
 ____
____ +____
+____ +_____。当有0.1mol电子发生转移时,生成的
+_____。当有0.1mol电子发生转移时,生成的 在标况下的体积为
在标况下的体积为______ 。
 ,反应原理是:
,反应原理是: ,并且
,并且 易与空气中
易与空气中 、水蒸气反应。现用金属钠和空气制备纯度较高的
、水蒸气反应。现用金属钠和空气制备纯度较高的 ,可利用的装置如图所示。回答下列问题:
,可利用的装置如图所示。回答下列问题:
(1)装置Ⅳ中盛放的试剂是
(2)若规定气体的气流方向从左到右,则组合实验装置时各接口的连接顺序为:
(3)装置Ⅱ的作用是
(4)操作中通空气和加热的先后顺序为
Ⅱ.为了探究过氧化钠的强氧化性,某小组设计了如图所示的实验装置。

实验步骤及现象如下:
①检查装置气密性后,装入药品并连接装置A、B、C。
②缓慢通入一定量的
 后,将装置D连接好(导管末端未伸入集气瓶中),再向圆底烧瓶中缓慢滴加浓盐酸,装置A中剧烈反应,有气体产生。
后,将装置D连接好(导管末端未伸入集气瓶中),再向圆底烧瓶中缓慢滴加浓盐酸,装置A中剧烈反应,有气体产生。③待装置D中导管口产生连续气泡后,将导管末端伸入集气瓶中,收集到无色气体。
④反应一段时间后,关闭活塞,再通一段时间N₂,直至装置中气体变为无色。
回答下列问题:
(5)装置A中盛装浓盐酸的仪器名称是
(6)实验中观察到B中湿润的红色纸条褪色,说明在浓盐酸和
 的反应中有
的反应中有(7)实验中,在D的集气瓶中收集到能使带火星木条复燃的无色气体,有同学认为该气体是
 被浓盐酸还原所得,从氧化还原角度分析该推断是否合理并说明理由?
被浓盐酸还原所得,从氧化还原角度分析该推断是否合理并说明理由?(8)还有同学认为D的集气瓶中收集到的气体是
 与浓盐酸中的水反应得到。通过实验证实
与浓盐酸中的水反应得到。通过实验证实 与干燥的
与干燥的 能反应,请完成并配平该化学方程式:
能反应,请完成并配平该化学方程式: +____
+____
 ____
____ +____
+____ +_____。当有0.1mol电子发生转移时,生成的
+_____。当有0.1mol电子发生转移时,生成的 在标况下的体积为
在标况下的体积为
您最近一年使用:0次
3 . 我国将力争2030年前实现碳达峰、2060年前实现碳中和,是党中央经过深思熟虑做出的重要决策,事关中华民族永续发展和构建人类命运共同体。研究CO2的综合利用对促进“低碳经济”的发展有重要意义。
I.利用二氧化碳催化加氢制甲醇。回答下列问题:
某温度下,二氧化碳与氢气反应制甲醇的总反应为 ,
,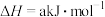 。
。
(1)已知 、
、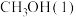 的燃烧热分别为
的燃烧热分别为 、
、 ,且
,且
 ,则
,则
_____ 。
在体积为4.0L的密闭容器中充入0.8molCO2和2.0molH2,发生反应CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH<0,测得CO2、CH3OH的物质的量随时间变化如图:
CH3OH(g)+H2O(g) ΔH<0,测得CO2、CH3OH的物质的量随时间变化如图:
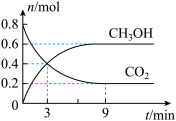
(2) 时间段内,
时间段内, 的平均反应速率为
的平均反应速率为_____ 。
(3)该反应的平衡常数表达式K=_____ ;若在上述平衡体系中再充入0.4molCO2和1.2molH2O(g)(保持温度不变),则此平衡将_____ 移动(填“向正反应方向”、“不”、“向逆反应方向”)。
(4)下列措施能使 增大的是_____。
增大的是_____。
Ⅱ.利用CO2、NH3为原料生产尿素[CO(NH2)2],反应原理为:2NH3(g)+CO2(g) H2O(l)+CO(NH2)2(s) ΔH=-178kJ∙mol-1.T1℃时,在1L的密闭容器中充入CO2和NH3模拟工业生产,n(NH3)/n(CO2)=x,图中是CO2平衡转化率(α)与x的关系。
H2O(l)+CO(NH2)2(s) ΔH=-178kJ∙mol-1.T1℃时,在1L的密闭容器中充入CO2和NH3模拟工业生产,n(NH3)/n(CO2)=x,图中是CO2平衡转化率(α)与x的关系。
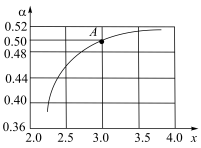
(5)图中A点NH3的平衡转化率α=_____ %。
(6)当x=1.0时,若起始的压强为p0kPa,水为液态,平衡时压强变为起始的1/2。则该反应的平衡常数Kp=_____ (kPa)-3(Kp为以分压表示的平衡常数,分压=总压×体积分数)。
I.利用二氧化碳催化加氢制甲醇。回答下列问题:
某温度下,二氧化碳与氢气反应制甲醇的总反应为
 ,
,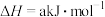 。
。(1)已知
 、
、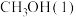 的燃烧热分别为
的燃烧热分别为 、
、 ,且
,且
 ,则
,则
在体积为4.0L的密闭容器中充入0.8molCO2和2.0molH2,发生反应CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) ΔH<0,测得CO2、CH3OH的物质的量随时间变化如图:
CH3OH(g)+H2O(g) ΔH<0,测得CO2、CH3OH的物质的量随时间变化如图:
(2)
 时间段内,
时间段内, 的平均反应速率为
的平均反应速率为(3)该反应的平衡常数表达式K=
(4)下列措施能使
 增大的是_____。
增大的是_____。A.将 从体系中分离 从体系中分离 |
| B.充入He,使体系压强增大 |
| C.降低温度、增大压强 |
D.再充入 |
Ⅱ.利用CO2、NH3为原料生产尿素[CO(NH2)2],反应原理为:2NH3(g)+CO2(g)
 H2O(l)+CO(NH2)2(s) ΔH=-178kJ∙mol-1.T1℃时,在1L的密闭容器中充入CO2和NH3模拟工业生产,n(NH3)/n(CO2)=x,图中是CO2平衡转化率(α)与x的关系。
H2O(l)+CO(NH2)2(s) ΔH=-178kJ∙mol-1.T1℃时,在1L的密闭容器中充入CO2和NH3模拟工业生产,n(NH3)/n(CO2)=x,图中是CO2平衡转化率(α)与x的关系。
(5)图中A点NH3的平衡转化率α=
(6)当x=1.0时,若起始的压强为p0kPa,水为液态,平衡时压强变为起始的1/2。则该反应的平衡常数Kp=
您最近一年使用:0次
名校
4 . 将浓度均为0.02mol•L-1的H2O2、H2SO4、KI、Na2S2O3溶液及淀粉混合,一定时间后溶液变为蓝色。该实验是一种“碘钟实验”。某小组同学再室温下对该“碘钟实验”的原理进行探究。
资料:该“碘钟实验”的总反应为H2O2+2S2O +2H+=S4O
+2H+=S4O +2H2O,反应分两步进行,反应A:……;反应B:I2+2S2O
+2H2O,反应分两步进行,反应A:……;反应B:I2+2S2O =2I-+S4O
=2I-+S4O 。
。
(1)反应A的离子方程式是_____ ;对于总反应,I-的作用相当于_____ 。
(2)为证明反应A、B的存在,进行实验I.
实验I:
a.向酸化的H2O2溶液中加入试剂X的水溶液,溶液变为蓝色。
b.再向得到的蓝色溶液中加入Na2S2O3溶液,溶液的蓝色褪去。
试剂X是_____
(3)为探究硫酸浓度对溶液变蓝快慢的影响,进行实验Ⅱ、实验Ⅲ.
(各溶液浓度均为0.02mol•L-1)
溶液从混合时的无色变为蓝色的时间:实验Ⅱ是15min,实验Ⅲ是20min。
①实验Ⅲ中,x、y、z所对应的数值分别是_____ 。
②对比试验Ⅱ、实验Ⅲ,可得出的实验结论是_____ 。
(4)为探究其他因素对该“碘钟实验”的影响,进行实验Ⅳ.(各溶液浓度均为0.02mol•L-1)
实验过程中,溶液始终未出现变蓝的现象。试结合该“碘钟实验”总反应方程式,推测反应A与反应B速率的相对快慢关系:_____ 。
资料:该“碘钟实验”的总反应为H2O2+2S2O
 +2H+=S4O
+2H+=S4O +2H2O,反应分两步进行,反应A:……;反应B:I2+2S2O
+2H2O,反应分两步进行,反应A:……;反应B:I2+2S2O =2I-+S4O
=2I-+S4O 。
。(1)反应A的离子方程式是
(2)为证明反应A、B的存在,进行实验I.
实验I:
a.向酸化的H2O2溶液中加入试剂X的水溶液,溶液变为蓝色。
b.再向得到的蓝色溶液中加入Na2S2O3溶液,溶液的蓝色褪去。
试剂X是
(3)为探究硫酸浓度对溶液变蓝快慢的影响,进行实验Ⅱ、实验Ⅲ.
(各溶液浓度均为0.02mol•L-1)
| 用量/mL | H2O2溶液 | H2SO4溶液 | Na2S2O3溶液 | 试剂X溶液 | H2O |
| 实验Ⅱ | 5 | 4 | 8 | 3 | 0 |
| 实验Ⅲ | 5 | 2 | x | y | z |
①实验Ⅲ中,x、y、z所对应的数值分别是
②对比试验Ⅱ、实验Ⅲ,可得出的实验结论是
(4)为探究其他因素对该“碘钟实验”的影响,进行实验Ⅳ.(各溶液浓度均为0.02mol•L-1)
| 用量/mL | H2O2溶液 | H2SO4溶液 | Na2S2O3溶液 | 试剂X溶液 | H2O |
| 实验Ⅳ | 4 | 4 | 9 | 3 | 0 |
您最近一年使用:0次
名校
解题方法
5 . 甲醇是重要的工业原料。
(1)已知CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H=-49.0kJ•mol-1。T℃下,向体积为2L的恒容密闭容器中充入2molCO2(g)和6molH2(g),测得CO2(g)和CH3OH(g)的浓度随时间变化曲线如图。
CH3OH(g)+H2O(g) △H=-49.0kJ•mol-1。T℃下,向体积为2L的恒容密闭容器中充入2molCO2(g)和6molH2(g),测得CO2(g)和CH3OH(g)的浓度随时间变化曲线如图。
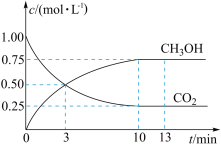
①T℃时,计算该反应的平衡常数为_______ (结果保留3位有效数字)。
②若保持温度和容器体积不变,13min时,向容器中充入1molCO2(g)和1molH2O(g),此时,该反应的v正_______ v逆(填“>”、“<”或=)。
③已知下列物质总键能(1mol物质所含化学键的键能之和)的数据如表,由此可计算表中a=_______ 。
(2)已知:(Ⅰ)CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H1=-49.0kJ•mol-1
CH3OH(g)+H2O(g) △H1=-49.0kJ•mol-1
(Ⅱ)CO2(g)+H2(g) CO(g)+H2O(g) △H2=+41.1kJ•mol-1
CO(g)+H2O(g) △H2=+41.1kJ•mol-1
(Ⅲ)2H2(g)+CO(g) CH3OH(g) △H3
CH3OH(g) △H3
①△H3=_______ kJ/mol。
②在一定温度下,已知反应Ⅰ、Ⅱ、Ⅲ的平衡常数分别为K1、K2、K3,则K3=________ (用K1、K2表示)。
(1)已知CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) △H=-49.0kJ•mol-1。T℃下,向体积为2L的恒容密闭容器中充入2molCO2(g)和6molH2(g),测得CO2(g)和CH3OH(g)的浓度随时间变化曲线如图。
CH3OH(g)+H2O(g) △H=-49.0kJ•mol-1。T℃下,向体积为2L的恒容密闭容器中充入2molCO2(g)和6molH2(g),测得CO2(g)和CH3OH(g)的浓度随时间变化曲线如图。
①T℃时,计算该反应的平衡常数为
②若保持温度和容器体积不变,13min时,向容器中充入1molCO2(g)和1molH2O(g),此时,该反应的v正
③已知下列物质总键能(1mol物质所含化学键的键能之和)的数据如表,由此可计算表中a=
| 物质 | CO2 | H2 | CH3OH | H2O |
| 总键能/kJ•mol | 1620 | a | 2047 | 930 |
 CH3OH(g)+H2O(g) △H1=-49.0kJ•mol-1
CH3OH(g)+H2O(g) △H1=-49.0kJ•mol-1(Ⅱ)CO2(g)+H2(g)
 CO(g)+H2O(g) △H2=+41.1kJ•mol-1
CO(g)+H2O(g) △H2=+41.1kJ•mol-1(Ⅲ)2H2(g)+CO(g)
 CH3OH(g) △H3
CH3OH(g) △H3①△H3=
②在一定温度下,已知反应Ⅰ、Ⅱ、Ⅲ的平衡常数分别为K1、K2、K3,则K3=
您最近一年使用:0次
6 . 一定条件下,某恒容密闭容器中,起始浓度依次为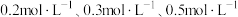 的
的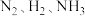 ,发生反应
,发生反应 ,反应达到平衡时,下列数据合理的是
,反应达到平衡时,下列数据合理的是
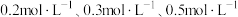 的
的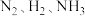 ,发生反应
,发生反应 ,反应达到平衡时,下列数据合理的是
,反应达到平衡时,下列数据合理的是A.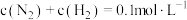 | B.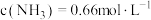 |
C.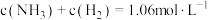 | D.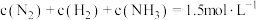 |
您最近一年使用:0次
解题方法
7 . 一种适合在沙漠或偏远地区使用的锂尿电池装置(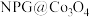 为纳米多孔金包裹
为纳米多孔金包裹 )如图所示,已知
)如图所示,已知 溶液显碱性。下列说法错误的是
溶液显碱性。下列说法错误的是

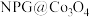 为纳米多孔金包裹
为纳米多孔金包裹 )如图所示,已知
)如图所示,已知 溶液显碱性。下列说法错误的是
溶液显碱性。下列说法错误的是
| A.纳米多孔金具有比表面积大、导电性好、耐腐蚀的优点 |
B.电池工作时,正极反应式为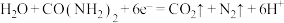 |
C.电池工作时,外电路电流从纳米多孔金流向 板 板 |
| D.电池工作一段时间后,正极区电解质溶液质量增大 |
您最近一年使用:0次
8 . 下图是飞船和空间站中利用Sabatier反应再生氧气的大体流程。
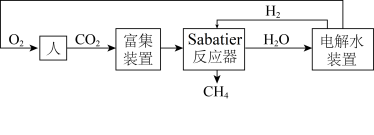
(1)已知:2H2(g)+O2(g) 2H2O(g) ∆H=﹣483.6kJ·mol-1
2H2O(g) ∆H=﹣483.6kJ·mol-1
CH4(g)+2O2(g) CO2(g)+2H2O(g) ∆H=﹣802.3kJ·mol-1
CO2(g)+2H2O(g) ∆H=﹣802.3kJ·mol-1
则Sabatier反应CO2(g)+4H2(g) CH4(g)+2H2O(g)的∆H=
CH4(g)+2H2O(g)的∆H=___________ 。
(2)二氧化碳的富集装置如图所示。
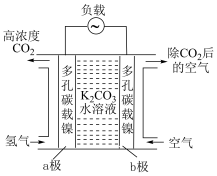
①该富集法采用___________ 原理(填“原电池”或“电解池”)。当a极上消耗1molH2,并保持电解液溶质不变时,b极上除去的CO2在标准状况下的体积为___________ 。
②工作一段时间后,K2CO3溶液的pH___________ (填“变大”“变小”或“不变”)。
(3)一定条件下,进行上述Sabatier反应:
①在恒温恒压装置中,下列能说明反应达到平衡状态的是___________ 。
a.混合气体的密度不再改变 b.混合气体的总质量不再改变
c.混合气体平均摩尔质量不再改变 d.v正(CO2)=2v逆(H2O)
②在Sabatier反应器的前端维持较高温度800K,其目的是___________ 。
③在温度为T、压强为P0的条件下,按n(CO2)∶n(H2)=1∶4投料进行反应,平衡时CO2的转化率为50%,Kp=___________ (用P0表示)。已知Kp是以分压表示的平衡常数,分压=总压×物质的量分数。
(4)在298K时,几种离子的摩尔电导率如下表。已知:摩尔电导率越大,溶液的导电性越好。空间站通过电解水实现O2的再生,从导电性角度选择最适宜的电解质为___________ (填化学式)。

(1)已知:2H2(g)+O2(g)
 2H2O(g) ∆H=﹣483.6kJ·mol-1
2H2O(g) ∆H=﹣483.6kJ·mol-1CH4(g)+2O2(g)
 CO2(g)+2H2O(g) ∆H=﹣802.3kJ·mol-1
CO2(g)+2H2O(g) ∆H=﹣802.3kJ·mol-1则Sabatier反应CO2(g)+4H2(g)
 CH4(g)+2H2O(g)的∆H=
CH4(g)+2H2O(g)的∆H=(2)二氧化碳的富集装置如图所示。

①该富集法采用
②工作一段时间后,K2CO3溶液的pH
(3)一定条件下,进行上述Sabatier反应:
①在恒温恒压装置中,下列能说明反应达到平衡状态的是
a.混合气体的密度不再改变 b.混合气体的总质量不再改变
c.混合气体平均摩尔质量不再改变 d.v正(CO2)=2v逆(H2O)
②在Sabatier反应器的前端维持较高温度800K,其目的是
③在温度为T、压强为P0的条件下,按n(CO2)∶n(H2)=1∶4投料进行反应,平衡时CO2的转化率为50%,Kp=
(4)在298K时,几种离子的摩尔电导率如下表。已知:摩尔电导率越大,溶液的导电性越好。空间站通过电解水实现O2的再生,从导电性角度选择最适宜的电解质为
| 离子种类 | H+ | OH- |  SO SO | Cl- |  CO CO | K+ | Na+ |
| 摩尔电导率×104(S·m2·mol-1) | 349.82 | 198.0 | 79.8 | 76.34 | 72.0 | 73.52 | 50.11 |
您最近一年使用:0次
解题方法
9 . 甲醇是一种优质燃料,在工业上常用CO和H2合成甲醇,反应方程式为CO(g)+2H2(g) CH3OH(g)。
CH3OH(g)。
已知:①CO(g)+1/2O2(g)=CO2(g) H1
H1
②H2(g)+1/2O2(g)=H2O(g) ΔH2
③CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(g) ΔH3
回答下列问题:
(1)CO(g)+2H2(g) CH3OH(g)的平衡常数K表达式
CH3OH(g)的平衡常数K表达式___________ ,该反应的反应热ΔH4=__________ (用ΔH1、ΔH2、ΔH3)。
(2)若在绝热、恒容的密闭容器中充入1 mol CO、2 mol H2,发生CO(g)+2H2(g) CH3OH(g)反应,下列示意图正确且能说明反应在进行到t1时刻为平衡状态的是
CH3OH(g)反应,下列示意图正确且能说明反应在进行到t1时刻为平衡状态的是___________ (填选项字母,单选)。
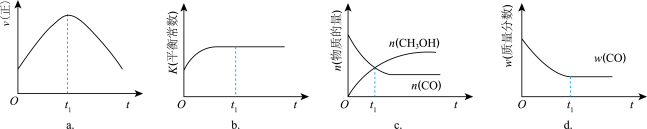
(3)T1℃时,在一个体积为5 L的恒容容器中充入1 mol CO、2 mol H2,经过5 min达到平衡,CO的转化率为0.8,则5 min内用H2表示的反应速率为v(H2)=___________ ,T1℃时,CO(g)+2H2(g) CH3OH(g)的平衡常数K=
CH3OH(g)的平衡常数K=___________ 。
(4)为了提高燃料的利用率可以将甲醇设计为燃料电池,写出KOH作电解质溶液时,甲醇燃料电池的负极反应式:___________ 。该电池负极与水库的铁闸相连时,可以保护铁闸不被腐蚀,这种电化学保护方法叫做___________ 。
(5)含有甲醇的废水随意排放会造成水污染,可用ClO2将其氧化为CO2,然后再加碱中和即可。写出处理甲醇酸性废水过程中,ClO2与甲醇反应的离子方程式:___________ 。
 CH3OH(g)。
CH3OH(g)。已知:①CO(g)+1/2O2(g)=CO2(g)
 H1
H1 ②H2(g)+1/2O2(g)=H2O(g) ΔH2
③CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(g) ΔH3
回答下列问题:
(1)CO(g)+2H2(g)
 CH3OH(g)的平衡常数K表达式
CH3OH(g)的平衡常数K表达式(2)若在绝热、恒容的密闭容器中充入1 mol CO、2 mol H2,发生CO(g)+2H2(g)
 CH3OH(g)反应,下列示意图正确且能说明反应在进行到t1时刻为平衡状态的是
CH3OH(g)反应,下列示意图正确且能说明反应在进行到t1时刻为平衡状态的是
(3)T1℃时,在一个体积为5 L的恒容容器中充入1 mol CO、2 mol H2,经过5 min达到平衡,CO的转化率为0.8,则5 min内用H2表示的反应速率为v(H2)=
 CH3OH(g)的平衡常数K=
CH3OH(g)的平衡常数K=(4)为了提高燃料的利用率可以将甲醇设计为燃料电池,写出KOH作电解质溶液时,甲醇燃料电池的负极反应式:
(5)含有甲醇的废水随意排放会造成水污染,可用ClO2将其氧化为CO2,然后再加碱中和即可。写出处理甲醇酸性废水过程中,ClO2与甲醇反应的离子方程式:
您最近一年使用:0次
10 . 化合物 是一种具有玫瑰香味的香料,可用作化妆品和食品的添加剂。实验室制备
是一种具有玫瑰香味的香料,可用作化妆品和食品的添加剂。实验室制备 的两种合成路线如图。
的两种合成路线如图。
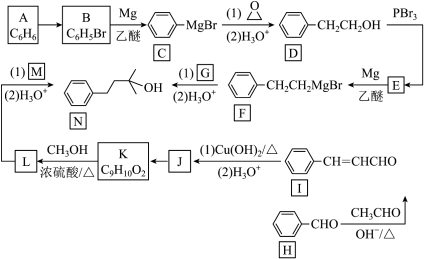
回答下列问题:
已知: .
.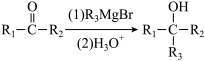 (R1、R3为烃基,R2为H或烃基
(R1、R3为烃基,R2为H或烃基

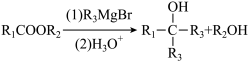 (R1、R2、R3为烃基
(R1、R2、R3为烃基
(1)H的化学名称为___________ , 所需的试剂是
所需的试剂是 ___________ 。
(2)D E反应类型是
E反应类型是 ___________ , 中非含氧官能团名称是
中非含氧官能团名称是 ___________ 。
(3)G、M的结构简式分别为___________ 、 ___________ 。
(4)I与新制Cu(OH)2悬浊液发生反应的方程式为___________ 。
(5)写出满足下列条件的 的同分异构体结构简式
的同分异构体结构简式 ___________ 、 ___________ 。 写出两种即可
写出两种即可
 属于芳香族化合物;
属于芳香族化合物;
 能发生银镜反应;
能发生银镜反应;
 核磁共振氢谱有
核磁共振氢谱有 组峰,峰面积比为1:1:2:6。
组峰,峰面积比为1:1:2:6。
 是一种具有玫瑰香味的香料,可用作化妆品和食品的添加剂。实验室制备
是一种具有玫瑰香味的香料,可用作化妆品和食品的添加剂。实验室制备 的两种合成路线如图。
的两种合成路线如图。 
回答下列问题:
已知:
 .
.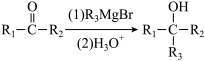 (R1、R3为烃基,R2为H或烃基
(R1、R3为烃基,R2为H或烃基

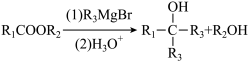 (R1、R2、R3为烃基
(R1、R2、R3为烃基
(1)H的化学名称为
 所需的试剂是
所需的试剂是 (2)D
 E反应类型是
E反应类型是  中非含氧官能团名称是
中非含氧官能团名称是 (3)G、M的结构简式分别为
(4)I与新制Cu(OH)2悬浊液发生反应的方程式为
(5)写出满足下列条件的
 的同分异构体结构简式
的同分异构体结构简式  写出两种即可
写出两种即可
 属于芳香族化合物;
属于芳香族化合物; 能发生银镜反应;
能发生银镜反应;  核磁共振氢谱有
核磁共振氢谱有 组峰,峰面积比为1:1:2:6。
组峰,峰面积比为1:1:2:6。
您最近一年使用:0次



