名校
解题方法
1 . 一种制备 的工艺路线如图所示,反应
的工艺路线如图所示,反应 所得溶液pH在3~4之间,反应
所得溶液pH在3~4之间,反应 需及时补加
需及时补加 以保持反应在
以保持反应在 条件下进行。常温下,
条件下进行。常温下, 的电离平衡常数
的电离平衡常数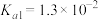 ,
,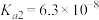 。下列说法正确的是
。下列说法正确的是
 的工艺路线如图所示,反应
的工艺路线如图所示,反应 所得溶液pH在3~4之间,反应
所得溶液pH在3~4之间,反应 需及时补加
需及时补加 以保持反应在
以保持反应在 条件下进行。常温下,
条件下进行。常温下, 的电离平衡常数
的电离平衡常数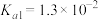 ,
,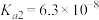 。下列说法正确的是
。下列说法正确的是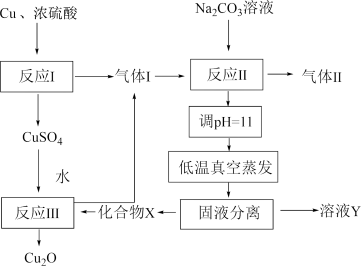
A.反应 、 、 、 、 均为氧化还原反应 均为氧化还原反应 |
B.低温真空蒸发主要目的是防止 被氧化 被氧化 |
C.溶液Y可循环用于反应 所在操作单元吸收气体 所在操作单元吸收气体 |
D.若 产量不变,参与反应 产量不变,参与反应 的X与 的X与 物质的量之比 物质的量之比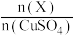 增大时,需补加 增大时,需补加 的量增多 的量增多 |
您最近一年使用:0次
2024-06-10更新
|
99次组卷
|
4卷引用:福建省福州第三中学2023-2024学年高三上学期第五次质量检测化学试题
名校
解题方法
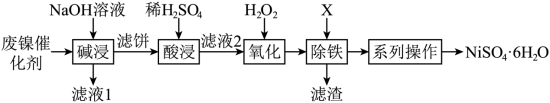
2 . 利用油脂厂废弃镍(Ni)催化剂(主要含有Ni,还含少量Al、Fe、NiO、Al2O3、Fe2O3)制备NiSO4·6H2O的工艺流程如下:
(1)为了加快“碱浸”的速率可以采取的措施是_______ (任写两条)。
(2)向滤液1中通入足量CO2可以将其中的金属元素沉淀,写出该反应的离子反应方程式____ 。
(3)“滤液2” 中含金属阳离子有_______ 。
(4)①“氧化”中反应的离子反应方程式是_______ 。
②“氧化”中可以代替H2O2的最佳物质是_______ (填标号)。
a.Cl2 b.O2 c.Fe
(5)根据除铁及系列操作,回答以下问题:
①已知溶液中存在Fe3++3H2O Fe(OH)3+3H+平衡,X物质可以为下列的
Fe(OH)3+3H+平衡,X物质可以为下列的_______ 。
a.H2SO4 b.NiO c.Ni(OH)2 d.CO2
②边搅拌边向滤液中加入X至pH=4,加热、过滤、洗涤,检验沉淀是否洗涤干净的方法_______ 。
③结晶:将滤液蒸发、降温至稍高于_______ ℃结晶,过滤即获得产品,硫酸镍晶体溶解度曲线图如图所示。
(1)为了加快“碱浸”的速率可以采取的措施是
(2)向滤液1中通入足量CO2可以将其中的金属元素沉淀,写出该反应的离子反应方程式
(3)“滤液2” 中含金属阳离子有
(4)①“氧化”中反应的离子反应方程式是
②“氧化”中可以代替H2O2的最佳物质是
a.Cl2 b.O2 c.Fe
(5)根据除铁及系列操作,回答以下问题:
①已知溶液中存在Fe3++3H2O
 Fe(OH)3+3H+平衡,X物质可以为下列的
Fe(OH)3+3H+平衡,X物质可以为下列的a.H2SO4 b.NiO c.Ni(OH)2 d.CO2
②边搅拌边向滤液中加入X至pH=4,加热、过滤、洗涤,检验沉淀是否洗涤干净的方法
③结晶:将滤液蒸发、降温至稍高于
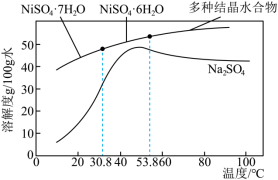
您最近一年使用:0次
名校
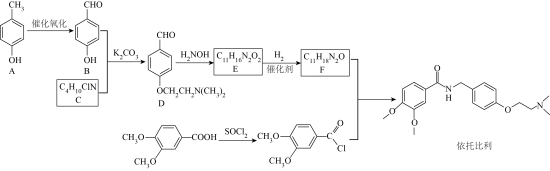
3 . 某研究小组按下列路线合成胃动力药依托比利。
(1)化合物 的含氧官能团名称是
的含氧官能团名称是_______ 。
(2)下列说法不正确 的是_______。
(3)化合物C的结构简式是_______ 。
(4)写出 的化学方程式
的化学方程式_______ 。
(5)研究小组在实验室用苯甲醛为原料合成药物 苄基苯甲酰胺(
苄基苯甲酰胺(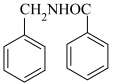 )。利用如图合成线路中的相关信息,设计该合成路线
)。利用如图合成线路中的相关信息,设计该合成路线_______ (用流程图表示,无机试剂任选)
(6)写出一种同时符合下列条件的化合物 的同分异构体的结构简式
的同分异构体的结构简式_______ 。
①分子中含有苯环
已知: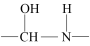
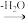 -CH=N-
-CH=N-
(1)化合物
 的含氧官能团名称是
的含氧官能团名称是(2)下列说法
A.化合物A能与 发生显色反应 发生显色反应 |
B. 的转变也可用 的转变也可用 在酸性条件下氧化来实现 在酸性条件下氧化来实现 |
C.在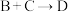 的反应中, 的反应中, 作催化剂 作催化剂 |
| D.依托比利可在酸性或碱性条件下发生水解反应 |
(4)写出
 的化学方程式
的化学方程式(5)研究小组在实验室用苯甲醛为原料合成药物
 苄基苯甲酰胺(
苄基苯甲酰胺( )。利用如图合成线路中的相关信息,设计该合成路线
)。利用如图合成线路中的相关信息,设计该合成路线(6)写出一种同时符合下列条件的化合物
 的同分异构体的结构简式
的同分异构体的结构简式①分子中含有苯环
②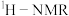 谱和
谱和 谱检测表明:分子中共有4种不同化学环境的氢原子,有酰胺基(
谱检测表明:分子中共有4种不同化学环境的氢原子,有酰胺基(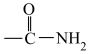 )。
)。
您最近一年使用:0次
名校
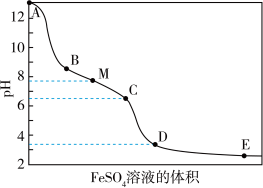
4 .  溶液具有漂白能力,已知
溶液具有漂白能力,已知 时,
时,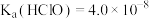 ,向含有
,向含有 的
的 溶液中逐滴滴入
溶液中逐滴滴入 溶液,滴加过程中溶液的
溶液,滴加过程中溶液的 随
随 溶液的体积的变化曲线及实验现象见下表。下列叙述不正确的是
溶液的体积的变化曲线及实验现象见下表。下列叙述不正确的是
 溶液具有漂白能力,已知
溶液具有漂白能力,已知 时,
时,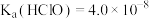 ,向含有
,向含有 的
的 溶液中逐滴滴入
溶液中逐滴滴入 溶液,滴加过程中溶液的
溶液,滴加过程中溶液的 随
随 溶液的体积的变化曲线及实验现象见下表。下列叙述不正确的是
溶液的体积的变化曲线及实验现象见下表。下列叙述不正确的是| 变化曲线 | 实验现象 |
| ⅰ. 产生红褐色沉淀 产生红褐色沉淀ⅱ.  红褐色沉淀的量增多 红褐色沉淀的量增多ⅲ.  红褐色沉淀的量增多 红褐色沉淀的量增多ⅳ.  点附近产生有刺激性气味的气体 点附近产生有刺激性气味的气体ⅴ.  红褐色沉淀的量略有增多 红褐色沉淀的量略有增多 |
A.NaClO的电子式是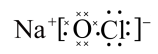 |
B.NaClO溶液中离子浓度大小顺序是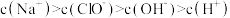 |
C.25℃,pH=7.0的NaClO和HClO的混合溶液中, |
D.C点附近生成红褐色沉淀的主要反应的离子方程式为 |
您最近一年使用:0次
名校
解题方法
5 . 以银锰精矿(主要含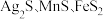 )和氧化锰矿(主要含
)和氧化锰矿(主要含 )为原料联合提取银和锰的一种流程示意图如图所示:
)为原料联合提取银和锰的一种流程示意图如图所示: 的氧化性强于
的氧化性强于 ;
;
(1)“浸锰”过程是在 溶液中使矿石中的锰元素浸出,同时去除
溶液中使矿石中的锰元素浸出,同时去除 ,有利于后续银的浸出,矿石中的银以
,有利于后续银的浸出,矿石中的银以 的形式残留于浸锰渣中。
的形式残留于浸锰渣中。
①“浸锰"过程中,发生反应: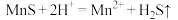 ,则可推断:
,则可推断: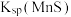
____ (填“ ”或“
”或“ ”)
”)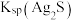 。
。
②在 溶液中,银锰精矿中的
溶液中,银锰精矿中的 和氧化锰矿中的
和氧化锰矿中的 发生反应,则浸锰液中主要的金属阳离子有
发生反应,则浸锰液中主要的金属阳离子有_______ 。
(2)“浸银”时,使用过量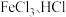 和
和 的混合液作为浸出剂,将
的混合液作为浸出剂,将 中的银以
中的银以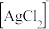 形式浸出。
形式浸出。
①将“浸银”反应的离子方程式补充完整:_______ 。
_______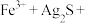 _______
_______ _______
_______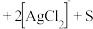 。
。
②结合平衡移动原理,解释浸出剂中 的作用:
的作用:_______ 。
(3)“沉银”过程中需要过量的铁粉作为还原剂。该步反应的离子方程式有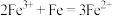 和
和_______ 。
(4)碳是一种很常见的元素,它能形成多种物质。碳与铁可以形成合金。
①基态碳原子的价电子排布图_____ ;基态铁原子核外共有_____ 种不同空间运动状态的电子。
②从结构角度分析, 较
较 稳定的原因是
稳定的原因是_______ 。
③碳与其他元素一起能形成多种酸或酸根。 的空间构型是
的空间构型是_______ 。
④类卤素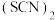 分子中
分子中 键与
键与 键的数目比
键的数目比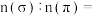
_______ 。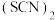 对应的酸有两种,理论上硫氰酸
对应的酸有两种,理论上硫氰酸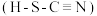 的沸点低于异硫氰酸
的沸点低于异硫氰酸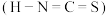 的沸点,其原因是
的沸点,其原因是_______ 。
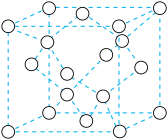
⑤碳还能形成多种同素异形体,如石墨、金刚石等。2017年,中外科学家团队共同合成了碳的一种新型同素异形体: 碳。
碳。 碳的结构是将立方金刚石中的每个碳原子用一个由4个碳原子组成的正四面体结构单元取代,可形成碳的一种新型三维立方晶体结构-
碳的结构是将立方金刚石中的每个碳原子用一个由4个碳原子组成的正四面体结构单元取代,可形成碳的一种新型三维立方晶体结构- 碳(如图)。已知
碳(如图)。已知 碳密度为
碳密度为 ,阿伏加德罗常数为
,阿伏加德罗常数为 ,则
,则 碳的晶胞参数
碳的晶胞参数
_______ pm(写出表达式即可)。
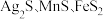 )和氧化锰矿(主要含
)和氧化锰矿(主要含 )为原料联合提取银和锰的一种流程示意图如图所示:
)为原料联合提取银和锰的一种流程示意图如图所示: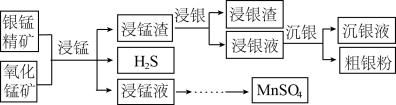
 的氧化性强于
的氧化性强于 ;
;(1)“浸锰”过程是在
 溶液中使矿石中的锰元素浸出,同时去除
溶液中使矿石中的锰元素浸出,同时去除 ,有利于后续银的浸出,矿石中的银以
,有利于后续银的浸出,矿石中的银以 的形式残留于浸锰渣中。
的形式残留于浸锰渣中。①“浸锰"过程中,发生反应:
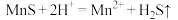 ,则可推断:
,则可推断: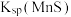
 ”或“
”或“ ”)
”)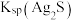 。
。②在
 溶液中,银锰精矿中的
溶液中,银锰精矿中的 和氧化锰矿中的
和氧化锰矿中的 发生反应,则浸锰液中主要的金属阳离子有
发生反应,则浸锰液中主要的金属阳离子有(2)“浸银”时,使用过量
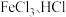 和
和 的混合液作为浸出剂,将
的混合液作为浸出剂,将 中的银以
中的银以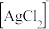 形式浸出。
形式浸出。①将“浸银”反应的离子方程式补充完整:
_______
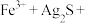 _______
_______ _______
_______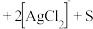 。
。②结合平衡移动原理,解释浸出剂中
 的作用:
的作用:(3)“沉银”过程中需要过量的铁粉作为还原剂。该步反应的离子方程式有
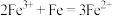 和
和(4)碳是一种很常见的元素,它能形成多种物质。碳与铁可以形成合金。
①基态碳原子的价电子排布图
②从结构角度分析,
 较
较 稳定的原因是
稳定的原因是③碳与其他元素一起能形成多种酸或酸根。
 的空间构型是
的空间构型是④类卤素
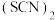 分子中
分子中 键与
键与 键的数目比
键的数目比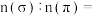
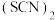 对应的酸有两种,理论上硫氰酸
对应的酸有两种,理论上硫氰酸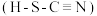 的沸点低于异硫氰酸
的沸点低于异硫氰酸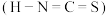 的沸点,其原因是
的沸点,其原因是⑤碳还能形成多种同素异形体,如石墨、金刚石等。2017年,中外科学家团队共同合成了碳的一种新型同素异形体:
 碳。
碳。 碳的结构是将立方金刚石中的每个碳原子用一个由4个碳原子组成的正四面体结构单元取代,可形成碳的一种新型三维立方晶体结构-
碳的结构是将立方金刚石中的每个碳原子用一个由4个碳原子组成的正四面体结构单元取代,可形成碳的一种新型三维立方晶体结构- 碳(如图)。已知
碳(如图)。已知 碳密度为
碳密度为 ,阿伏加德罗常数为
,阿伏加德罗常数为 ,则
,则 碳的晶胞参数
碳的晶胞参数
您最近一年使用:0次
名校
6 . 全球大气 浓度升高对人类生产、生活产生了影响,碳及其化合物的资源化利用成为研究热点。回答下列问题:
浓度升高对人类生产、生活产生了影响,碳及其化合物的资源化利用成为研究热点。回答下列问题:
(1)已知 时,大气中的
时,大气中的 溶于水存在以下过程:
溶于水存在以下过程:
①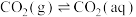
②
过程①的
_______ 0(填“ ”“
”“ ”或“
”或“ ”)。溶液中
”)。溶液中 的浓度与其在大气中的分压(分压
的浓度与其在大气中的分压(分压 总压
总压 物质的量分数)成正比,比例系数为
物质的量分数)成正比,比例系数为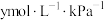 。当大气压强为
。当大气压强为 ,大气中
,大气中 的物质的量分数为
的物质的量分数为 时,溶液中
时,溶液中 的浓度为
的浓度为_______  (忽略
(忽略 和水的电离)。
和水的电离)。
(2)甲烷干法重整制 同时存在如下反应:
同时存在如下反应:
Ⅰ.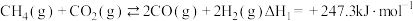
Ⅱ.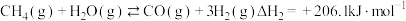
Ⅲ.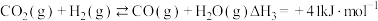
①一定条件下,向 恒容密闭容器中通入
恒容密闭容器中通入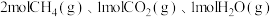 发生上述反应达到平衡时容器中
发生上述反应达到平衡时容器中 为
为 为
为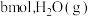 为
为 ,此时
,此时 的浓度为
的浓度为____  。
。
②向恒容密闭容器中充入等物质的量的 和
和 ,若只发生反应Ⅰ和Ⅲ,则下列说法正确的是
,若只发生反应Ⅰ和Ⅲ,则下列说法正确的是____ 。
A.高温低压有利于提高 的平衡转化率
的平衡转化率
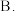 充分反应后的混合气体中,
充分反应后的混合气体中, 的体积分数可能达到
的体积分数可能达到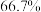
C.充分反应后的混合气体通过生石灰,固体质量增大,说明干重整反应存在限度
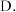 当混合气体中
当混合气体中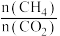 恒定时,反应达到平衡状态
恒定时,反应达到平衡状态
③恒温下,向恒压容器中通入物质的量为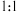 的
的 和
和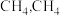 的物质的量
的物质的量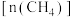 随时间变化如图所示。在
随时间变化如图所示。在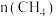 不变的条件下,改成加入
不变的条件下,改成加入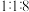 的
的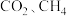 和
和 的混合气体,请在图中画出
的混合气体,请在图中画出 的物质的量随时间
的物质的量随时间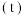 变化的曲线
变化的曲线_______ 。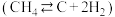 ,关键是开发出具有抗积碳性能
,关键是开发出具有抗积碳性能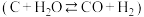 的催化剂。催化剂
的催化剂。催化剂 对积碳与消碳的影响如图所示:
对积碳与消碳的影响如图所示:_______ (填“A”或“ ”),理由是
”),理由是_______ 。
 浓度升高对人类生产、生活产生了影响,碳及其化合物的资源化利用成为研究热点。回答下列问题:
浓度升高对人类生产、生活产生了影响,碳及其化合物的资源化利用成为研究热点。回答下列问题:(1)已知
 时,大气中的
时,大气中的 溶于水存在以下过程:
溶于水存在以下过程:①
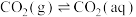
②

过程①的

 ”“
”“ ”或“
”或“ ”)。溶液中
”)。溶液中 的浓度与其在大气中的分压(分压
的浓度与其在大气中的分压(分压 总压
总压 物质的量分数)成正比,比例系数为
物质的量分数)成正比,比例系数为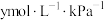 。当大气压强为
。当大气压强为 ,大气中
,大气中 的物质的量分数为
的物质的量分数为 时,溶液中
时,溶液中 的浓度为
的浓度为 (忽略
(忽略 和水的电离)。
和水的电离)。(2)甲烷干法重整制
 同时存在如下反应:
同时存在如下反应:Ⅰ.
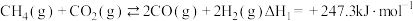
Ⅱ.
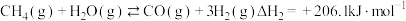
Ⅲ.
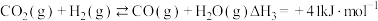
①一定条件下,向
 恒容密闭容器中通入
恒容密闭容器中通入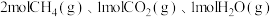 发生上述反应达到平衡时容器中
发生上述反应达到平衡时容器中 为
为 为
为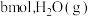 为
为 ,此时
,此时 的浓度为
的浓度为 。
。②向恒容密闭容器中充入等物质的量的
 和
和 ,若只发生反应Ⅰ和Ⅲ,则下列说法正确的是
,若只发生反应Ⅰ和Ⅲ,则下列说法正确的是A.高温低压有利于提高
 的平衡转化率
的平衡转化率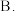 充分反应后的混合气体中,
充分反应后的混合气体中, 的体积分数可能达到
的体积分数可能达到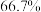
C.充分反应后的混合气体通过生石灰,固体质量增大,说明干重整反应存在限度
 当混合气体中
当混合气体中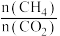 恒定时,反应达到平衡状态
恒定时,反应达到平衡状态③恒温下,向恒压容器中通入物质的量为
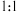 的
的 和
和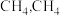 的物质的量
的物质的量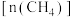 随时间变化如图所示。在
随时间变化如图所示。在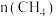 不变的条件下,改成加入
不变的条件下,改成加入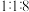 的
的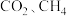 和
和 的混合气体,请在图中画出
的混合气体,请在图中画出 的物质的量随时间
的物质的量随时间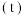 变化的曲线
变化的曲线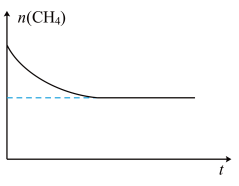
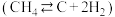 ,关键是开发出具有抗积碳性能
,关键是开发出具有抗积碳性能 的催化剂。催化剂
的催化剂。催化剂 对积碳与消碳的影响如图所示:
对积碳与消碳的影响如图所示: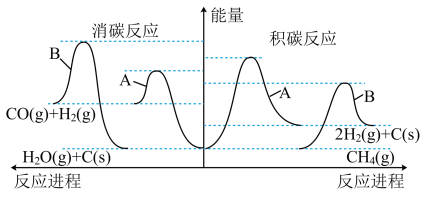
 ”),理由是
”),理由是
您最近一年使用:0次
名校
7 . 按要求填空:
(1)用系统命名法命名: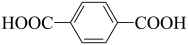 的苯环上的碳原子的杂化方式为
的苯环上的碳原子的杂化方式为___________ ,羧基上碳原子的杂化方式为___________ ,最多有___________ 个原子共平面。
(3)正硝酸钠( )为白色晶体,是一种重要的化工原料。
)为白色晶体,是一种重要的化工原料。
① 阴离子的空间构型为
阴离子的空间构型为___________ ,其中心原子杂化方式为___________ 。
②写出一种与 的阴离子互为等电子体的阴离子或分子
的阴离子互为等电子体的阴离子或分子___________ (填化学式)。
(4) 的电子式为
的电子式为___________ ; 中H-N-H键角比
中H-N-H键角比 中H-N-H键角
中H-N-H键角_________ (填“大”或“小”),理由是_____________ 。
(5)若硝酸的结构表示为 ,已知硝酸与水分子可形成一水合二硝酸结晶水合物(
,已知硝酸与水分子可形成一水合二硝酸结晶水合物(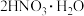 ),水分子以三个氢键与两个硝酸分子结合,请写出一水合二硝酸的结构式
),水分子以三个氢键与两个硝酸分子结合,请写出一水合二硝酸的结构式______ (氢键用“…”表示)。
(6)已知NaCl和MgO的晶体结构相似,熔点较高的是____________________ (填化学式),原因是______________________ 。
(1)用系统命名法命名:
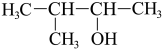

 的苯环上的碳原子的杂化方式为
的苯环上的碳原子的杂化方式为(3)正硝酸钠(
 )为白色晶体,是一种重要的化工原料。
)为白色晶体,是一种重要的化工原料。①
 阴离子的空间构型为
阴离子的空间构型为②写出一种与
 的阴离子互为等电子体的阴离子或分子
的阴离子互为等电子体的阴离子或分子(4)
 的电子式为
的电子式为 中H-N-H键角比
中H-N-H键角比 中H-N-H键角
中H-N-H键角(5)若硝酸的结构表示为
 ,已知硝酸与水分子可形成一水合二硝酸结晶水合物(
,已知硝酸与水分子可形成一水合二硝酸结晶水合物(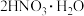 ),水分子以三个氢键与两个硝酸分子结合,请写出一水合二硝酸的结构式
),水分子以三个氢键与两个硝酸分子结合,请写出一水合二硝酸的结构式(6)已知NaCl和MgO的晶体结构相似,熔点较高的是
您最近一年使用:0次
名校
解题方法
8 . 分子人工光合作用的光捕获原理如图所示,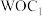 是水氧化催化剂WOC在水氧化过程中产生的中间体,
是水氧化催化剂WOC在水氧化过程中产生的中间体,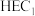 是析氢催化剂HEC在析氢过程中产生的中间体。
是析氢催化剂HEC在析氢过程中产生的中间体。
(1)与Fe元素同周期,基态原子有2个未成对电子的金属元素有___________ 种,下列状态的铁中,电离最外层一个电子所需能量最大的是___________ (填选项)。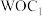 中通过螯合作用形成的配位键有
中通过螯合作用形成的配位键有___________ mol。
(3)在多原子分子中有相互平行的p轨道,它们连贯、重叠在一起,构成一个整体,p电子在多个原子间运动,像这样不局限在两个原子之间的 键称为离域
键称为离域 键,如苯分子中的离域
键,如苯分子中的离域 键可表示为
键可表示为 。N元素形成的两种微粒
。N元素形成的两种微粒 、
、 中,
中, 中的离域
中的离域 键可表示为
键可表示为___________ , 、
、 的键角由大到小的顺序为
的键角由大到小的顺序为_________________________________ 。
(4)水催化氧化是“分子人工光合作用”的关键步骤。水的晶体有普通冰和重冰等不同类型。普通冰的晶胞结构与水分子间的氢键如图甲、乙所示。晶胞参数分别为a pm、c pm, ;标注为1、2、3的氧原子在Z轴的分数坐标分别为:0.375c、0.5c、0.875c。
;标注为1、2、3的氧原子在Z轴的分数坐标分别为:0.375c、0.5c、0.875c。___________ pm。
②普通冰晶体的密度为______________________  (列出数学表达式,不必计算出结果)。
(列出数学表达式,不必计算出结果)。
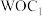 是水氧化催化剂WOC在水氧化过程中产生的中间体,
是水氧化催化剂WOC在水氧化过程中产生的中间体,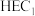 是析氢催化剂HEC在析氢过程中产生的中间体。
是析氢催化剂HEC在析氢过程中产生的中间体。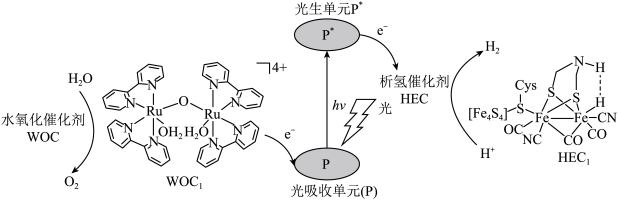
(1)与Fe元素同周期,基态原子有2个未成对电子的金属元素有
A. 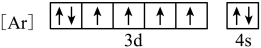
B.
C. 
D.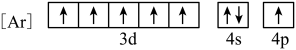
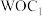 中通过螯合作用形成的配位键有
中通过螯合作用形成的配位键有(3)在多原子分子中有相互平行的p轨道,它们连贯、重叠在一起,构成一个整体,p电子在多个原子间运动,像这样不局限在两个原子之间的
 键称为离域
键称为离域 键,如苯分子中的离域
键,如苯分子中的离域 键可表示为
键可表示为 。N元素形成的两种微粒
。N元素形成的两种微粒 、
、 中,
中, 中的离域
中的离域 键可表示为
键可表示为 、
、 的键角由大到小的顺序为
的键角由大到小的顺序为(4)水催化氧化是“分子人工光合作用”的关键步骤。水的晶体有普通冰和重冰等不同类型。普通冰的晶胞结构与水分子间的氢键如图甲、乙所示。晶胞参数分别为a pm、c pm,
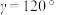 ;标注为1、2、3的氧原子在Z轴的分数坐标分别为:0.375c、0.5c、0.875c。
;标注为1、2、3的氧原子在Z轴的分数坐标分别为:0.375c、0.5c、0.875c。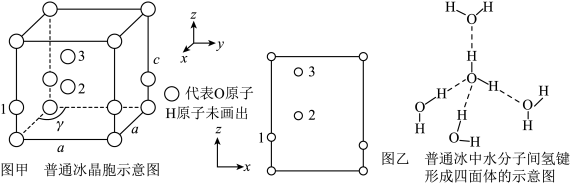
②普通冰晶体的密度为
 (列出数学表达式,不必计算出结果)。
(列出数学表达式,不必计算出结果)。
您最近一年使用:0次
名校
解题方法
9 .  、
、 是重要的电极材料,回答下列问题:
是重要的电极材料,回答下列问题:
(1)基态Co原子的价电子中,两种自旋状态的电子数之比为___________ 。
(2)Co(Ⅲ)可形成多种配合物。
①已知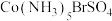 中Co(Ⅲ)的配位数为6,向该配合物的溶液中滴加
中Co(Ⅲ)的配位数为6,向该配合物的溶液中滴加 溶液无明显现象,滴加
溶液无明显现象,滴加 溶液有淡黄色沉淀生成,则该配合物可表示为
溶液有淡黄色沉淀生成,则该配合物可表示为______________________ 。
② 结构如图所示,
结构如图所示, 位于正八面体中心,若其中两个
位于正八面体中心,若其中两个 被
被 取代,则
取代,则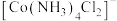 的空间结构有
的空间结构有___________ 种。 的结构如下图,该配合物中存在的作用力类型有
的结构如下图,该配合物中存在的作用力类型有___________ (填标号)。
(3) 、
、 在合成化学上应用广泛。
在合成化学上应用广泛。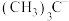 的空间结构为
的空间结构为___________ ;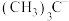 、
、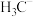 、
、 的稳定性随中心C原子上电子云密度增大而减小,其中稳定性最强的是
的稳定性随中心C原子上电子云密度增大而减小,其中稳定性最强的是______________ 。
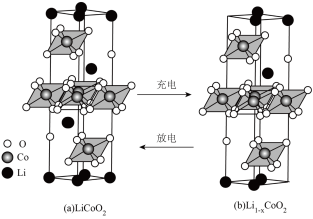
(4)①正极材料 的晶胞结构如图(a(部分O位于晶胞之外),每个晶胞中含有
的晶胞结构如图(a(部分O位于晶胞之外),每个晶胞中含有___________ 个O;充电时, 脱出部分
脱出部分 ,形成
,形成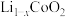 ,结构如图(b)则
,结构如图(b)则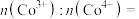
___________ 。 晶胞结构如图(c),
晶胞结构如图(c), 原子插入石墨层中间,若该晶胞中碳碳键键长为m pm。石墨层间距为n pm。该晶体的密度为
原子插入石墨层中间,若该晶胞中碳碳键键长为m pm。石墨层间距为n pm。该晶体的密度为______________________  (用
(用 表示阿伏伽德罗常数的值)。
表示阿伏伽德罗常数的值)。
 、
、 是重要的电极材料,回答下列问题:
是重要的电极材料,回答下列问题:(1)基态Co原子的价电子中,两种自旋状态的电子数之比为
(2)Co(Ⅲ)可形成多种配合物。
①已知
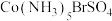 中Co(Ⅲ)的配位数为6,向该配合物的溶液中滴加
中Co(Ⅲ)的配位数为6,向该配合物的溶液中滴加 溶液无明显现象,滴加
溶液无明显现象,滴加 溶液有淡黄色沉淀生成,则该配合物可表示为
溶液有淡黄色沉淀生成,则该配合物可表示为②
 结构如图所示,
结构如图所示, 位于正八面体中心,若其中两个
位于正八面体中心,若其中两个 被
被 取代,则
取代,则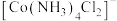 的空间结构有
的空间结构有
 的结构如下图,该配合物中存在的作用力类型有
的结构如下图,该配合物中存在的作用力类型有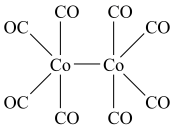
(3)
 、
、 在合成化学上应用广泛。
在合成化学上应用广泛。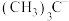 的空间结构为
的空间结构为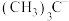 、
、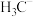 、
、 的稳定性随中心C原子上电子云密度增大而减小,其中稳定性最强的是
的稳定性随中心C原子上电子云密度增大而减小,其中稳定性最强的是(4)①正极材料
 的晶胞结构如图(a(部分O位于晶胞之外),每个晶胞中含有
的晶胞结构如图(a(部分O位于晶胞之外),每个晶胞中含有 脱出部分
脱出部分 ,形成
,形成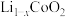 ,结构如图(b)则
,结构如图(b)则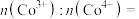
 晶胞结构如图(c),
晶胞结构如图(c), 原子插入石墨层中间,若该晶胞中碳碳键键长为m pm。石墨层间距为n pm。该晶体的密度为
原子插入石墨层中间,若该晶胞中碳碳键键长为m pm。石墨层间距为n pm。该晶体的密度为 (用
(用 表示阿伏伽德罗常数的值)。
表示阿伏伽德罗常数的值)。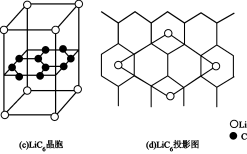
您最近一年使用:0次
名校
解题方法
10 . 以CO2和H2为原料制造更高价值的化学产品是用来缓解温室效应的研究方向。
(1)工业上常用CO2和H2为原料合成甲醇(CH3OH),过程中发生如下两个反应:
反应I:
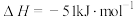
反应Ⅱ:
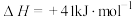
①已知几种化学键的键能如下表所示,则a=_____ kJ·mol-1.
②若反应Ⅱ逆反应活化能 ,则该反应的正反应的活化能
,则该反应的正反应的活化能
_____ kJ·mol-1.
(2)向2L容器中充入1molCO2和2molH2,若只发生反应I,测得反应在不同压强下平衡混合物中甲醇体积分数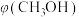 随温度变化如图1所示,逆反应速率与容器中
随温度变化如图1所示,逆反应速率与容器中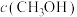 关系如图2所示:
关系如图2所示:
①图1中P1_____ P2(填“>”、“<”或“=”);
②图2中x点平衡体系时升温,反应重新达平衡状态时新平衡点可能是_____ (填字母序号)。 、
、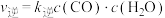 ,k正、k逆分别表示正逆反应速率常数,只与温度有关。则图3中所示的甲、乙、丙、丁四条直线中,表示lgk正随温度T变化关系的直线是
,k正、k逆分别表示正逆反应速率常数,只与温度有关。则图3中所示的甲、乙、丙、丁四条直线中,表示lgk正随温度T变化关系的直线是_____ ,表示lgk逆随温度T变化关系的直线是_____ 。
(4)已知一定温度下按照起始比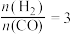 ,在一密闭容器中进行反应:
,在一密闭容器中进行反应: ,保持总压为2.1MPa不变,达到平衡时CO的平衡转化率为50%,则该条件下用平衡体系中各气体分压表示的平衡常数
,保持总压为2.1MPa不变,达到平衡时CO的平衡转化率为50%,则该条件下用平衡体系中各气体分压表示的平衡常数
_____ MPa-2(保留2位有效数字)(各气体分压=平衡体系中各气体的体积分数×总压)。
(5)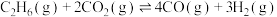
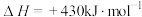 ,在四种不同容器中发生上述反应,若初始温度、压强和反应物用量均相同,则CO2的转化率最高的是_____(填字母)。
,在四种不同容器中发生上述反应,若初始温度、压强和反应物用量均相同,则CO2的转化率最高的是_____(填字母)。
(1)工业上常用CO2和H2为原料合成甲醇(CH3OH),过程中发生如下两个反应:
反应I:

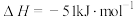
反应Ⅱ:

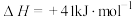
①已知几种化学键的键能如下表所示,则a=
| 化学键 | C—H | C—O | H—O | H—H | C≡O |
| 键能/kJ·mol-1 | 406 | 351 | 465 | 436 | a |
 ,则该反应的正反应的活化能
,则该反应的正反应的活化能
(2)向2L容器中充入1molCO2和2molH2,若只发生反应I,测得反应在不同压强下平衡混合物中甲醇体积分数
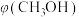 随温度变化如图1所示,逆反应速率与容器中
随温度变化如图1所示,逆反应速率与容器中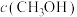 关系如图2所示:
关系如图2所示:①图1中P1
②图2中x点平衡体系时升温,反应重新达平衡状态时新平衡点可能是

 、
、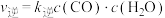 ,k正、k逆分别表示正逆反应速率常数,只与温度有关。则图3中所示的甲、乙、丙、丁四条直线中,表示lgk正随温度T变化关系的直线是
,k正、k逆分别表示正逆反应速率常数,只与温度有关。则图3中所示的甲、乙、丙、丁四条直线中,表示lgk正随温度T变化关系的直线是(4)已知一定温度下按照起始比
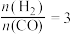 ,在一密闭容器中进行反应:
,在一密闭容器中进行反应: ,保持总压为2.1MPa不变,达到平衡时CO的平衡转化率为50%,则该条件下用平衡体系中各气体分压表示的平衡常数
,保持总压为2.1MPa不变,达到平衡时CO的平衡转化率为50%,则该条件下用平衡体系中各气体分压表示的平衡常数
(5)
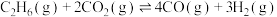
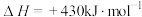 ,在四种不同容器中发生上述反应,若初始温度、压强和反应物用量均相同,则CO2的转化率最高的是_____(填字母)。
,在四种不同容器中发生上述反应,若初始温度、压强和反应物用量均相同,则CO2的转化率最高的是_____(填字母)。| A.恒温恒容容器 | B.恒容绝热容器 |
| C.恒压绝热容器 | D.恒温恒压容器 |
您最近一年使用:0次