真题
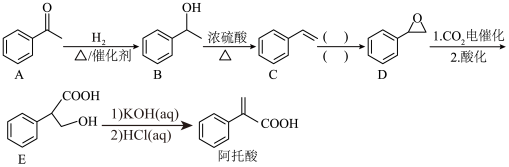
1 . 二氧化碳的转化与综合利用是实现“碳达峰”“碳中和”战略的重要途径。近期,我国学者以电催化反应为关键步骤,用CO2作原料,实现了重要医药中间体——阿托酸的合成,其合成路线如下:______ 。
(2)A→B的反应类型为______ 。
(3)A的含有苯环且能发生银镜反应的同分异构体数目为______ ,其中在核磁共振氢谱中呈现四组峰的结构简式为______ 。
(4)写出B→C反应方程式:______ 。
(5)C→D反应所需试剂及条件为______ 。
(6)在D→E反应中,用Mg作阳极、Pt作阴极进行电解,则CO2与D的反应在______ (填“阳极”或“阴极”)上进行。
(7)下列关于E的叙述错误的是______ (填序号)。
a.可发生聚合反应
b.分子内9个碳原子共平面
c.分子内含有1个手性碳原子
d.可形成分子内氢键和分子间氢键
(8)结合题干信息,完成以下合成路线:______ 。
(2)A→B的反应类型为
(3)A的含有苯环且能发生银镜反应的同分异构体数目为
(4)写出B→C反应方程式:
(5)C→D反应所需试剂及条件为
(6)在D→E反应中,用Mg作阳极、Pt作阴极进行电解,则CO2与D的反应在
(7)下列关于E的叙述错误的是
a.可发生聚合反应
b.分子内9个碳原子共平面
c.分子内含有1个手性碳原子
d.可形成分子内氢键和分子间氢键
(8)结合题干信息,完成以下合成路线:
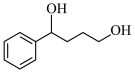
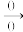
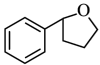
 ( )
( )

您最近一年使用:0次
2 . 实验室制取A并进一步制取无水FeCl3的实验装置如图所示。
已知:无水FeCl3在空气中易与水发生作用,加热易升华。
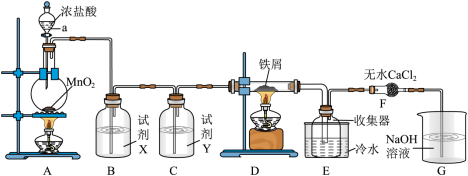
回答下列问题:
(1)仪器a的名称是_______ ,装置A所发生的氧化还原反应中,氧化剂与还原剂的物质的量之比为_______ 。
(2)试剂X是_______ 。
(3)装置F中无水CaCl2的作用是_______
(4)某温度下,将氯气通入G装置中,反应得到NaCl,NaClO和NaClO3的混合溶液,经测定ClO-与ClO 的物质的量之比为4∶1,写出该反应总的离子方程式:
的物质的量之比为4∶1,写出该反应总的离子方程式:_______ 。
已知:无水FeCl3在空气中易与水发生作用,加热易升华。

回答下列问题:
(1)仪器a的名称是
(2)试剂X是
(3)装置F中无水CaCl2的作用是
(4)某温度下,将氯气通入G装置中,反应得到NaCl,NaClO和NaClO3的混合溶液,经测定ClO-与ClO
 的物质的量之比为4∶1,写出该反应总的离子方程式:
的物质的量之比为4∶1,写出该反应总的离子方程式:
您最近一年使用:0次
名校
3 . 如图所示与对应叙述相符的是
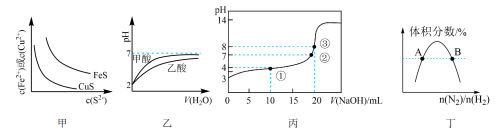

A.图甲:一定温度 、 、 沉淀溶解平衡曲线,则 沉淀溶解平衡曲线,则 |
B.图乙:等体积 的甲酸与乙酸稀释的 的甲酸与乙酸稀释的 曲线,则酸性:甲酸 曲线,则酸性:甲酸 乙酸 乙酸 |
C.图丙:某温度下向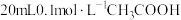 溶液中逐滴加入 溶液中逐滴加入 溶液, 溶液, 变化曲线如图丙所示(忽略温度变化),则①点 变化曲线如图丙所示(忽略温度变化),则①点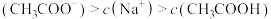 |
D.图丁: 平衡时 平衡时 体积分数随起始 体积分数随起始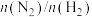 变化曲线,则转化率: 变化曲线,则转化率: |
您最近一年使用:0次
名校
解题方法
4 . 研究SO2、NOx等大气污染气体的处理具有重要意义。利用反应8NH3+6NO2 12H2O+7N2处理NO2。
12H2O+7N2处理NO2。
(1)120℃时,该反应在一容积为2L的容器内反应,10min时生成0.6molH2O,则10min内,平均反应速率v(NO2)=___________ mol/(L·min)。
(2)一定条件下NO2与SO2可发生反应:4SO2(g)+2NO2(g)⇌4SO3(g)+N2(g) ΔH=akJ/mol
①已知:O2(g)+2SO2(g)⇌2SO3(g) ΔH1=-196.6kJ/mol
N2(g)+2O2(g)⇌2NO2(g) ΔH2=+67kJ/mol
则a=___________ 。
②将NO2与SO2按物质的量之比1:1置于恒温恒容密闭容器中反应。下列能说明反应达到平衡状态的是___________ (填序号)。
A.体系压强保持不变 B.NO2与SO2物质的量之比保持不变 C.v(SO2)消耗=v(SO3)生成
③将一定量的NO2与SO2置于密闭容器中发生反应,在相同时间内测得SO3的物质的量分数与温度的变化曲线如图1所示(虚线为平衡时的曲线)。SO2的平衡转化率与压强、温度及氮硫比m【m= 】的关系如图2所示:
】的关系如图2所示:

由图1可知温度过高或温度过低均不利于该反应的进行,原因是___________ ;图2中压强p1___________ (填“>”“<”或“=”,下同)p2,氮硫比m1___________ m2。
(3)利用CH3OCH3燃料电池电解,可将雾霾中的NO、SO2分别转化为 和
和 ,装置如图3所示。请写出a电极发生反应的电极反应式
,装置如图3所示。请写出a电极发生反应的电极反应式___________ ;溶液A的化学式为___________ 。

 12H2O+7N2处理NO2。
12H2O+7N2处理NO2。(1)120℃时,该反应在一容积为2L的容器内反应,10min时生成0.6molH2O,则10min内,平均反应速率v(NO2)=
(2)一定条件下NO2与SO2可发生反应:4SO2(g)+2NO2(g)⇌4SO3(g)+N2(g) ΔH=akJ/mol
①已知:O2(g)+2SO2(g)⇌2SO3(g) ΔH1=-196.6kJ/mol
N2(g)+2O2(g)⇌2NO2(g) ΔH2=+67kJ/mol
则a=
②将NO2与SO2按物质的量之比1:1置于恒温恒容密闭容器中反应。下列能说明反应达到平衡状态的是
A.体系压强保持不变 B.NO2与SO2物质的量之比保持不变 C.v(SO2)消耗=v(SO3)生成
③将一定量的NO2与SO2置于密闭容器中发生反应,在相同时间内测得SO3的物质的量分数与温度的变化曲线如图1所示(虚线为平衡时的曲线)。SO2的平衡转化率与压强、温度及氮硫比m【m=
 】的关系如图2所示:
】的关系如图2所示:
由图1可知温度过高或温度过低均不利于该反应的进行,原因是
(3)利用CH3OCH3燃料电池电解,可将雾霾中的NO、SO2分别转化为
 和
和 ,装置如图3所示。请写出a电极发生反应的电极反应式
,装置如图3所示。请写出a电极发生反应的电极反应式
您最近一年使用:0次
名校
解题方法
5 . 完成下列问题:
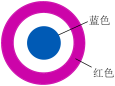
(1)取一块打磨过的生铁片,在其表面滴一滴含酚酞和K3[Fe(CN)6]的食盐水,放置一段时间后,生铁片上出现如图所示“斑痕”,其边缘为红色,中心区域为蓝色,在两色环交界处出现铁锈,生铁片发生___________ 腐蚀,边缘区的电极反应式为___________ 。
(2)区分晶体和非晶体最可靠的方法是___________ 。
(3)以铝材为阳极,在H2SO4溶液中电解,铝材表面形成氧化膜,阳极反应式为___________ 。
(4)以多孔铂为电极,如图装置中A、B口分别通入CH3CH2OH和O2构成乙醇燃料电池,则b电极是___________ (填“正极”或“负极”),该电池的负极的电极反应式为___________

用该燃料电池作为电源进行电解,将两个铂电极插入500 mL CuSO4溶液中进行电解,通电一定时间后,某一电极增重0.064 g(设电解时该电极无氢气析出,且不考虑水解和溶液体积变化),此时溶液中氢离子浓度约为___________ 。
(5)利用人工光合作用可将CO2转化为甲酸,反应原理为2CO2+2H2O=2HCOOH+O2,装置如图所示:
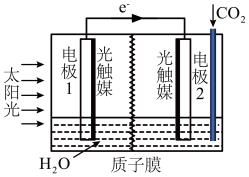
①电极2的电极反应式是___________ 。
②在标准状况下,当产生22.4 L O2时,理论上电极1室液体质量变化___________ g。
(学法题)书写电极反应式时应注意哪些问题___________ 。
(1)取一块打磨过的生铁片,在其表面滴一滴含酚酞和K3[Fe(CN)6]的食盐水,放置一段时间后,生铁片上出现如图所示“斑痕”,其边缘为红色,中心区域为蓝色,在两色环交界处出现铁锈,生铁片发生

(2)区分晶体和非晶体最可靠的方法是
(3)以铝材为阳极,在H2SO4溶液中电解,铝材表面形成氧化膜,阳极反应式为
(4)以多孔铂为电极,如图装置中A、B口分别通入CH3CH2OH和O2构成乙醇燃料电池,则b电极是

用该燃料电池作为电源进行电解,将两个铂电极插入500 mL CuSO4溶液中进行电解,通电一定时间后,某一电极增重0.064 g(设电解时该电极无氢气析出,且不考虑水解和溶液体积变化),此时溶液中氢离子浓度约为
(5)利用人工光合作用可将CO2转化为甲酸,反应原理为2CO2+2H2O=2HCOOH+O2,装置如图所示:

①电极2的电极反应式是
②在标准状况下,当产生22.4 L O2时,理论上电极1室液体质量变化
(学法题)书写电极反应式时应注意哪些问题
您最近一年使用:0次
名校
解题方法
6 . 有关溶液中的计算
(1)某温度下测得0.01mol·L-1的NaOH溶液的pH为11,在该温度下,将pH=12的NaOH溶液VaL与pH=2的硫酸VbL混合。若所得混合液的pH=10,忽略体积变化,则Va∶Vb=___________ 。
(2)在25℃下,将amol·L-1的氨水与0.01mol·L-1的盐酸等体积混合,反应平衡时溶液中c( )=c(Cl-),用含a的代数式表示NH3·H2O的电离常数Kb=
)=c(Cl-),用含a的代数式表示NH3·H2O的电离常数Kb=___________ 。
(3)常温下二元酸发生如下电离:H2A=H++HA-;HA-⇌H++A2-(Ka=1×10﹣2)。则常温下pH=10的Na2A溶液中c(A2-)是c(HA-)的___________ 倍。
(4)常温下Fe(OH)3的溶度积Ksp=1.0×10-38,Cu(OH)2的溶度积Ksp=3.0×10-20,通常认为残留在溶液中的离子浓度小于1.0×10-5mol·L-1时就沉淀完全,设溶液中CuSO4的浓度为3.0mol·L-1,则Cu(OH)2开始沉淀时溶液的pH为___________ ,Fe3+完全沉淀时溶液的pH为___________ 。
(1)某温度下测得0.01mol·L-1的NaOH溶液的pH为11,在该温度下,将pH=12的NaOH溶液VaL与pH=2的硫酸VbL混合。若所得混合液的pH=10,忽略体积变化,则Va∶Vb=
(2)在25℃下,将amol·L-1的氨水与0.01mol·L-1的盐酸等体积混合,反应平衡时溶液中c(
 )=c(Cl-),用含a的代数式表示NH3·H2O的电离常数Kb=
)=c(Cl-),用含a的代数式表示NH3·H2O的电离常数Kb=(3)常温下二元酸发生如下电离:H2A=H++HA-;HA-⇌H++A2-(Ka=1×10﹣2)。则常温下pH=10的Na2A溶液中c(A2-)是c(HA-)的
(4)常温下Fe(OH)3的溶度积Ksp=1.0×10-38,Cu(OH)2的溶度积Ksp=3.0×10-20,通常认为残留在溶液中的离子浓度小于1.0×10-5mol·L-1时就沉淀完全,设溶液中CuSO4的浓度为3.0mol·L-1,则Cu(OH)2开始沉淀时溶液的pH为
您最近一年使用:0次
名校
解题方法
7 . 常温下,下列有关电解质溶液的叙述正确的是
A.0.1mol·L-1CuSO4·(NH4)2SO4·6H2O的溶液中: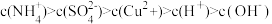 |
B.在 溶液中 溶液中 |
C.0.1mol/LNa2CO3溶液中: |
D.0.1mol·L-1的NaHA溶液,其pH=4: |
您最近一年使用:0次
名校
8 . 下列叙述正确的是
| A.pH=7的溶液一定是中性溶液 |
| B.一定温度下,pH=a的氨水,稀释10倍后,其pH=b,则a=b+1 |
| C.将10mL0.0lmol/LNaOH溶液与同浓度的HA溶液混合,若混合后溶液呈中性,则消耗的HA的体积V≥10mL |
| D.由水电离出来的H+的浓度为1.0×10-10mol·L-1,则原溶液的pH一定为4 |
您最近一年使用:0次
名校
解题方法
9 . 现有常温下浓度均为1 mol∙L−1的下列四种溶液:① 溶液、②
溶液、② 溶液、③
溶液、③ 溶液、④NaOH溶液、⑤
溶液、④NaOH溶液、⑤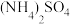 溶液。
溶液。
(1)这5种溶液pH由大到小的顺序是_______ ,其中由水电离的 浓度最小的是
浓度最小的是_______ 。 填序号
填序号
(2)②中各离子浓度由大到小的顺序是_______ , 的水解平衡常数Kh=
的水解平衡常数Kh=_____ 。(已知碳酸的电离常数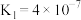 、
、 )
)
(3)向③中通入少量氨气,此时 的值
的值_____  填“增大”、“减小”或“不变”
填“增大”、“减小”或“不变” 。
。
(4)若将③和④混合后溶液恰好呈中性,则混合前③的体积_____ ④的体积(填“>” “<” 或“=”)。
(5)一定量的稀 溶液与足量的Zn反应,为减缓产生的H2速率但又不影响H2的总量,可采取的措施是
溶液与足量的Zn反应,为减缓产生的H2速率但又不影响H2的总量,可采取的措施是______ (填字母)。
A.加 固体 B.加
固体 B.加 固体 C.加
固体 C.加 溶液
溶液
D.加氨水 E.加 溶液
溶液
(6)常温下,向 溶液中加入
溶液中加入 溶液发生反应的离子方程式为
溶液发生反应的离子方程式为_______ ,若将所得悬浊液的pH调整为4,则溶液中 的溶液为
的溶液为______ mol∙L−1 (已知常温下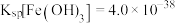 )。
)。
 溶液、②
溶液、② 溶液、③
溶液、③ 溶液、④NaOH溶液、⑤
溶液、④NaOH溶液、⑤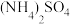 溶液。
溶液。(1)这5种溶液pH由大到小的顺序是
 浓度最小的是
浓度最小的是 填序号
填序号
(2)②中各离子浓度由大到小的顺序是
 的水解平衡常数Kh=
的水解平衡常数Kh=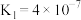 、
、 )
)(3)向③中通入少量氨气,此时
 的值
的值 填“增大”、“减小”或“不变”
填“增大”、“减小”或“不变” 。
。(4)若将③和④混合后溶液恰好呈中性,则混合前③的体积
(5)一定量的稀
 溶液与足量的Zn反应,为减缓产生的H2速率但又不影响H2的总量,可采取的措施是
溶液与足量的Zn反应,为减缓产生的H2速率但又不影响H2的总量,可采取的措施是A.加
 固体 B.加
固体 B.加 固体 C.加
固体 C.加 溶液
溶液 D.加氨水 E.加
 溶液
溶液(6)常温下,向
 溶液中加入
溶液中加入 溶液发生反应的离子方程式为
溶液发生反应的离子方程式为 的溶液为
的溶液为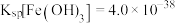 )。
)。
您最近一年使用:0次
解题方法
10 . 现代生活离不开方便实用的化学电源。各种各样的化学电源都是依据原电池的原理制造的。回答下列问题:
(1)锂离子电池具有质量小、体积小、储存和输出能量大等特点。一种锂离子电池负极材料为嵌锂石墨,正极材料为 (钴酸锂),电解质溶液为
(钴酸锂),电解质溶液为 (六氟磷酸锂)的碳酸酯溶液(无水)。该电池放电时的主要反应为
(六氟磷酸锂)的碳酸酯溶液(无水)。该电池放电时的主要反应为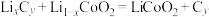 。
。
①放电时,负极反应式为______ 。 由
由______ 极向______ 极迁移(填“正”或“负”)。
②充电时,电池的______ (填“正”或“负”)极应与电源的正极相连,充电时该极的电极反应式为____________ 。
(2)甲醇燃料电池(简称DMFC)由于结构简单、能量转化率高、对环境无污染,可作为常规能源的替代品而越来越受到关注,DMFC的工作原理如图所示。
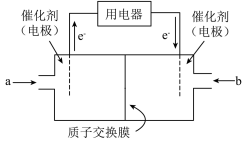
①通入a物质一侧的电极反应式为____________ 。
②通入11.2 L(折算为标准状况下)甲醇蒸气,测得电路中转移1.8 mol电子,则甲醇的利用率为______ 。
(3)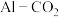 电池工作原理如图所示,利用该电池能有效地将
电池工作原理如图所示,利用该电池能有效地将 转化成化工原料草酸铝
转化成化工原料草酸铝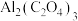 。
。
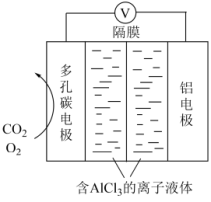
①电池的总反应式为____________ 。
②电池的正极反应式: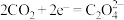 (草酸根)正极反应过程中,
(草酸根)正极反应过程中, 是催化剂,催化过程可表示为:
是催化剂,催化过程可表示为:
ⅰ.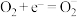 ⅱ.……
ⅱ.……
写出反应ⅱ的离子方程式:____________ 。
(1)锂离子电池具有质量小、体积小、储存和输出能量大等特点。一种锂离子电池负极材料为嵌锂石墨,正极材料为
 (钴酸锂),电解质溶液为
(钴酸锂),电解质溶液为 (六氟磷酸锂)的碳酸酯溶液(无水)。该电池放电时的主要反应为
(六氟磷酸锂)的碳酸酯溶液(无水)。该电池放电时的主要反应为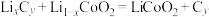 。
。①放电时,负极反应式为
 由
由②充电时,电池的
(2)甲醇燃料电池(简称DMFC)由于结构简单、能量转化率高、对环境无污染,可作为常规能源的替代品而越来越受到关注,DMFC的工作原理如图所示。

①通入a物质一侧的电极反应式为
②通入11.2 L(折算为标准状况下)甲醇蒸气,测得电路中转移1.8 mol电子,则甲醇的利用率为
(3)
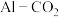 电池工作原理如图所示,利用该电池能有效地将
电池工作原理如图所示,利用该电池能有效地将 转化成化工原料草酸铝
转化成化工原料草酸铝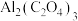 。
。
①电池的总反应式为
②电池的正极反应式:
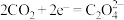 (草酸根)正极反应过程中,
(草酸根)正极反应过程中, 是催化剂,催化过程可表示为:
是催化剂,催化过程可表示为:ⅰ.
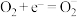 ⅱ.……
ⅱ.……写出反应ⅱ的离子方程式:
您最近一年使用:0次



