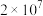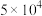名校
解题方法
1 . 铁被誉为“工业之母”,铁也是人体必须的痕量元素之一。
(1)基态Fe原子的核外电子中有_______ 对成对电子。其重要化合物 中的化学键具有明显的共价性,蒸汽状态下以双聚分子存在的结构式为
中的化学键具有明显的共价性,蒸汽状态下以双聚分子存在的结构式为_______ ,其中Fe的配位数为_______ 。
(2)血红素(含 )是吡咯(
)是吡咯(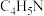 )的重要衍生物,可用于治疗缺铁性贫血。吡咯和血红素的结构如图:
)的重要衍生物,可用于治疗缺铁性贫血。吡咯和血红素的结构如图:_______ ,请描述原因:_______ 。
②已知吡咯中的各个原子均在同一平面内,则吡咯分子中N原子的杂化类型为。1mol吡咯分子中所含的σ键总数为_______ 个(设 为阿伏伽德罗常数的值)。分子中的大π键可用
为阿伏伽德罗常数的值)。分子中的大π键可用 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,则吡咯环中的大π键应表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,则吡咯环中的大π键应表示为_______ 。
③CO中毒是由于CO与血红蛋白(Hb)发生配位反应: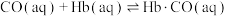 K。
K。
已知CO、 与血红素(Hb)的配位常数K如表所示。
与血红素(Hb)的配位常数K如表所示。
则反应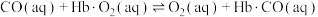 的平衡常数
的平衡常数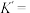
_______ 。
(3)一种由Mg和Fe组成的储氢材料的结构属立方晶系,晶胞参数为a pm,晶胞如图所示(氢未标出)。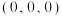 ,B点原子的分数坐标为
,B点原子的分数坐标为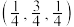 ,则C点原子的分数坐标为
,则C点原子的分数坐标为_______ 。
②该结构中,H原子以正八面体的配位模式有序分布在Fe的周围,H原子与Fe原子之间的最短距离等于晶胞参数的 ,则该晶体的化学式为
,则该晶体的化学式为_______ ,晶胞密度为_______  (列出计算式即可,设阿伏加德罗常数的值为
(列出计算式即可,设阿伏加德罗常数的值为 )。
)。
(1)基态Fe原子的核外电子中有
 中的化学键具有明显的共价性,蒸汽状态下以双聚分子存在的结构式为
中的化学键具有明显的共价性,蒸汽状态下以双聚分子存在的结构式为(2)血红素(含
 )是吡咯(
)是吡咯(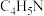 )的重要衍生物,可用于治疗缺铁性贫血。吡咯和血红素的结构如图:
)的重要衍生物,可用于治疗缺铁性贫血。吡咯和血红素的结构如图: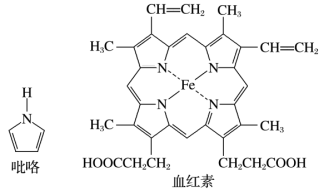
②已知吡咯中的各个原子均在同一平面内,则吡咯分子中N原子的杂化类型为。1mol吡咯分子中所含的σ键总数为
 为阿伏伽德罗常数的值)。分子中的大π键可用
为阿伏伽德罗常数的值)。分子中的大π键可用 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,则吡咯环中的大π键应表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,则吡咯环中的大π键应表示为③CO中毒是由于CO与血红蛋白(Hb)发生配位反应:
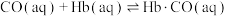 K。
K。已知CO、
 与血红素(Hb)的配位常数K如表所示。
与血红素(Hb)的配位常数K如表所示。CO |
| |
配位常数K |
|
|
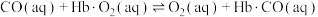 的平衡常数
的平衡常数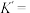
(3)一种由Mg和Fe组成的储氢材料的结构属立方晶系,晶胞参数为a pm,晶胞如图所示(氢未标出)。
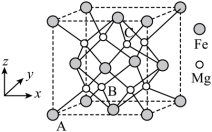
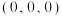 ,B点原子的分数坐标为
,B点原子的分数坐标为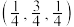 ,则C点原子的分数坐标为
,则C点原子的分数坐标为②该结构中,H原子以正八面体的配位模式有序分布在Fe的周围,H原子与Fe原子之间的最短距离等于晶胞参数的
 ,则该晶体的化学式为
,则该晶体的化学式为 (列出计算式即可,设阿伏加德罗常数的值为
(列出计算式即可,设阿伏加德罗常数的值为 )。
)。
您最近一年使用:0次
名校
2 . X为乙二胺,Y为乙二胺四乙酸(EDTA),均易与金属离子形成配合物。Z为乙二胺与 形成的配离子,W为EDTA阴离子与
形成的配离子,W为EDTA阴离子与 形成的整合物。下列叙述正确的是
形成的整合物。下列叙述正确的是
 形成的配离子,W为EDTA阴离子与
形成的配离子,W为EDTA阴离子与 形成的整合物。下列叙述正确的是
形成的整合物。下列叙述正确的是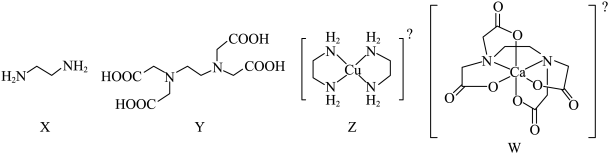
| A.X和Y中均含有手性碳原子 | B.Z和W均带两个单位的正电荷 |
| C.Z和W中金属离子的配位数均为4 | D.Z和W中均含普通共价键和配位键 |
您最近一年使用:0次
名校
3 . I. 和
和 在工农业、科研等方面应用广泛。
在工农业、科研等方面应用广泛。
(1) (氨硼烷)是具有广泛应用前景的储氢材料。
(氨硼烷)是具有广泛应用前景的储氢材料。
① 中存在配位键,提供空轨道的原子是
中存在配位键,提供空轨道的原子是___________ 。
② 的沸点高于
的沸点高于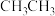 的可能原因是
的可能原因是___________ 。
(2)工业合成 时用到含铁催化剂。
时用到含铁催化剂。
① 元素在周期表第
元素在周期表第___________ 族,基态 原子电子的空间运动状态有
原子电子的空间运动状态有___________ 种。
②从结构的角度分析 容易被氧化成
容易被氧化成 的原因是
的原因是___________ 。
(3) 合金是储氢密度很高的材料之一,其晶胞结构如图所示。若该晶体储氢时,
合金是储氢密度很高的材料之一,其晶胞结构如图所示。若该晶体储氢时, 分子在晶胞的体心和棱的中心位置。
分子在晶胞的体心和棱的中心位置。 合金中,每个
合金中,每个 原子周围与它最近且相等距离的
原子周围与它最近且相等距离的 原子有
原子有___________ 个。
②要储存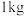
 ,至少需要
,至少需要___________ 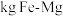 合金。
合金。
II.请回答:
(4)下列说法中正确的有___________ 。
①金属晶体的导电性、导热性均与自由电子有关
②若晶体中有阳离子,必然有阴离子
③分子晶体的熔点一定比金属晶体低
④共价键的强弱决定分子晶体熔、沸点的高低
⑤共价晶体中一定含有共价键
⑥含有离子的晶体一定是离子晶体
⑦硬度由大到小:金刚石>碳化硅>晶体硅
⑧ 和
和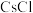 晶体中,阴离子周围紧邻的阳离子数均为8
晶体中,阴离子周围紧邻的阳离子数均为8
 和
和 在工农业、科研等方面应用广泛。
在工农业、科研等方面应用广泛。(1)
 (氨硼烷)是具有广泛应用前景的储氢材料。
(氨硼烷)是具有广泛应用前景的储氢材料。①
 中存在配位键,提供空轨道的原子是
中存在配位键,提供空轨道的原子是②
 的沸点高于
的沸点高于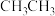 的可能原因是
的可能原因是(2)工业合成
 时用到含铁催化剂。
时用到含铁催化剂。①
 元素在周期表第
元素在周期表第 原子电子的空间运动状态有
原子电子的空间运动状态有②从结构的角度分析
 容易被氧化成
容易被氧化成 的原因是
的原因是(3)
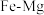 合金是储氢密度很高的材料之一,其晶胞结构如图所示。若该晶体储氢时,
合金是储氢密度很高的材料之一,其晶胞结构如图所示。若该晶体储氢时, 分子在晶胞的体心和棱的中心位置。
分子在晶胞的体心和棱的中心位置。
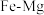 合金中,每个
合金中,每个 原子周围与它最近且相等距离的
原子周围与它最近且相等距离的 原子有
原子有②要储存
 ,至少需要
,至少需要 合金。
合金。II.请回答:
(4)下列说法中正确的有
①金属晶体的导电性、导热性均与自由电子有关
②若晶体中有阳离子,必然有阴离子
③分子晶体的熔点一定比金属晶体低
④共价键的强弱决定分子晶体熔、沸点的高低
⑤共价晶体中一定含有共价键
⑥含有离子的晶体一定是离子晶体
⑦硬度由大到小:金刚石>碳化硅>晶体硅
⑧
 和
和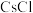 晶体中,阴离子周围紧邻的阳离子数均为8
晶体中,阴离子周围紧邻的阳离子数均为8
您最近一年使用:0次
名校
4 . M、R、X、Y为原子序数依次增大的短周期主族元素,Z是一种过渡元素,M的基态原子L层中p轨道电子数是s电子的2倍,R是同周期元素中最活泼的金属元素,X和M形成的一种化合物是引起酸雨的主要大气污染物,Z的基态原子4s和3d轨道半充满。下列说法正确的是
A.电负性: |
B.第一电离能: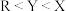 |
| C.X的氢化物的沸点低于与其组成相似的M的氢化物,是因为范德华力较小 |
D.在稀硫酸中,Z的最高价含氧酸的钾盐(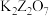 )氧化M的一种氢化物,Z被还原为 )氧化M的一种氢化物,Z被还原为 价,该反应中氧化剂和还原剂的物质的量之比为 价,该反应中氧化剂和还原剂的物质的量之比为 |
您最近一年使用:0次
名校
解题方法
5 . 以软锰矿(主要含有MnO2及少量Fe、Al、Si、Ca、Mg等的氧化物)为原料制备KMnO4的工艺流程如图所示:
①25℃时,Ksp[(MgF2)]=5.0×10-11,Ksp[(CaF2)]=5.0×10-9,Ksp[(Fe(OH)3]=1.0×10-38
②H2CO3的电离常数:Ka1=4.4×10-7,Ka2 =4.7×10-11;NH3·H2O的电离常数:Kb =1.8×10-5
③当溶液中离子浓度≤1.0×10-5mol·L-1时,可认为该离子沉淀完全。
回答下列问题:
(1)Mn在元素周期表中位于_______ 区,核外电子占据最高能层的符号是_______ ,金属锰可导电,导热,具有金属光泽,有延展性,这些性质都可以用_______ “理论”解释。
(2)“浸取”时Na2SO3将MnO2转化为Mn2+,该反应的离子方程式为_______ 。
(3)“除Fe、Al、Si”时,将Fe2+氧化为Fe3+后,再向该溶液中加入Mn(OH)2调节pH,则使Fe3+沉淀完全的pH的最小值为_______ 。
(4)“除Ca、Mg”时,所得滤液中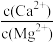 =
=_______ 。
(5)“沉锰”时,NH4HCO3溶液作“沉锰”试剂。
①NH4HCO3的水溶液中c(HCO )、c(NH
)、c(NH )、c(H+)、c(OH-)从大到小的顺序为
)、c(H+)、c(OH-)从大到小的顺序为_______ 。
②“沉锰”时,“锰”转化为MnCO3,反应的离子方程式为_______ 。
(6)工业上常用铁和石墨做电极材料,电解锰酸钾(K2MnO4)溶液制备高锰酸钾。
①铁为_______ (填“阴极”或“阳极”)。
②阳极的电极反应式为_______ 。

①25℃时,Ksp[(MgF2)]=5.0×10-11,Ksp[(CaF2)]=5.0×10-9,Ksp[(Fe(OH)3]=1.0×10-38
②H2CO3的电离常数:Ka1=4.4×10-7,Ka2 =4.7×10-11;NH3·H2O的电离常数:Kb =1.8×10-5
③当溶液中离子浓度≤1.0×10-5mol·L-1时,可认为该离子沉淀完全。
回答下列问题:
(1)Mn在元素周期表中位于
(2)“浸取”时Na2SO3将MnO2转化为Mn2+,该反应的离子方程式为
(3)“除Fe、Al、Si”时,将Fe2+氧化为Fe3+后,再向该溶液中加入Mn(OH)2调节pH,则使Fe3+沉淀完全的pH的最小值为
(4)“除Ca、Mg”时,所得滤液中
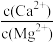 =
=(5)“沉锰”时,NH4HCO3溶液作“沉锰”试剂。
①NH4HCO3的水溶液中c(HCO
 )、c(NH
)、c(NH )、c(H+)、c(OH-)从大到小的顺序为
)、c(H+)、c(OH-)从大到小的顺序为②“沉锰”时,“锰”转化为MnCO3,反应的离子方程式为
(6)工业上常用铁和石墨做电极材料,电解锰酸钾(K2MnO4)溶液制备高锰酸钾。
①铁为
②阳极的电极反应式为
您最近一年使用:0次
名校
解题方法
6 . 一氯甲烷等卤代烃跟苯的反应如图所示,(无机小分子产物略去)。下列说法正确的是
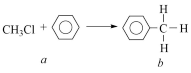
| A.该反应属于化合反应 | B.b的二氯代物有6种结构 |
| C.b分子中共平面的原子最多有8个 | D.C5H11Cl的结构有8种 |
您最近一年使用:0次
名校
解题方法
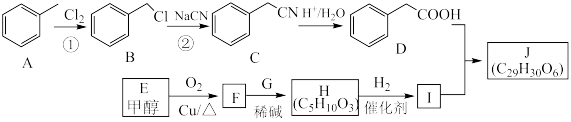
7 . 化合物J是一种治疗高脂血症的药物,其合成路线如图:______ ,反应H→I的反应类型为______ 。
(2)化合物J中的官能团为______ 。
(3)E→F反应的化学方程式为____________ 。
(4)H的结构简式为______ 。
(5)K是D的同系物,其相对分子质量比D多14,满足下列条件的K的同分异构体共有______ 种(不考虑立体异构)。
①苯环上只有两个侧链
②能与Na反应生成
③能与银氨溶液发生银镜反应
K的所有同分异构体在下列表征仪器中显示的信号(或数据)完全相同的是______ (填字母)。
a.质谱仪 b.红外光谱仪 c.元素分析仪 d.核磁共振仪
Ⅱ. 。
。
(2)化合物J中的官能团为
(3)E→F反应的化学方程式为
(4)H的结构简式为
(5)K是D的同系物,其相对分子质量比D多14,满足下列条件的K的同分异构体共有
①苯环上只有两个侧链
②能与Na反应生成

③能与银氨溶液发生银镜反应
K的所有同分异构体在下列表征仪器中显示的信号(或数据)完全相同的是
a.质谱仪 b.红外光谱仪 c.元素分析仪 d.核磁共振仪
您最近一年使用:0次
名校
8 . 二氯化二硫( )可作硫化剂、氯化剂。常温下是一种黄红色液体,沸点137℃,在潮湿的空气中剧烈水解而发烟。
)可作硫化剂、氯化剂。常温下是一种黄红色液体,沸点137℃,在潮湿的空气中剧烈水解而发烟。 可通过硫与少量氯气在110~140℃反应制得。
可通过硫与少量氯气在110~140℃反应制得。
(1)有关 的下列说法正确的是 。
的下列说法正确的是 。
(2)选用以下装置制取少量 (加热及夹持装置略):
(加热及夹持装置略):_____________________ 。
②装置连接顺序:A→__________ →D。
③B中玻璃纤维的作用是______________________ 。
④D中的最佳试剂是__________ (选填序号)。
a.碱石灰 b.浓硫酸 c.NaOH溶液 d.无水氯化钙
(3) 遇水会生成
遇水会生成 、HCl两种气体,某同学设计了如下实验方案来测定该混合气体中
、HCl两种气体,某同学设计了如下实验方案来测定该混合气体中 的体积分数。
的体积分数。_________ (填标号);
a. 溶液 b.
溶液 b. 溶液(硫酸酸化) c.氯水
溶液(硫酸酸化) c.氯水
 )可作硫化剂、氯化剂。常温下是一种黄红色液体,沸点137℃,在潮湿的空气中剧烈水解而发烟。
)可作硫化剂、氯化剂。常温下是一种黄红色液体,沸点137℃,在潮湿的空气中剧烈水解而发烟。 可通过硫与少量氯气在110~140℃反应制得。
可通过硫与少量氯气在110~140℃反应制得。(1)有关
 的下列说法正确的是 。
的下列说法正确的是 。A. 中S-Cl键的键能大于S-S键的键能 中S-Cl键的键能大于S-S键的键能 | B.固态时 属于原子晶体 属于原子晶体 |
| C.第一电离能、电负性均为:Cl>S | D. 中既有极性键又有非极性键 中既有极性键又有非极性键 |
(2)选用以下装置制取少量
 (加热及夹持装置略):
(加热及夹持装置略):
②装置连接顺序:A→
③B中玻璃纤维的作用是
④D中的最佳试剂是
a.碱石灰 b.浓硫酸 c.NaOH溶液 d.无水氯化钙
(3)
 遇水会生成
遇水会生成 、HCl两种气体,某同学设计了如下实验方案来测定该混合气体中
、HCl两种气体,某同学设计了如下实验方案来测定该混合气体中 的体积分数。
的体积分数。
a.
 溶液 b.
溶液 b. 溶液(硫酸酸化) c.氯水
溶液(硫酸酸化) c.氯水
您最近一年使用:0次
名校
9 . 丙烯可发生如下转化,下列说法不正确的是

| A.丙烯分子中最少有6个原子共平面 |
| B.X具有顺反异构 |
| C.Y与足量NaOH溶液共热可生成1,2-丙二醇 |
D.聚合物Z的链节结构简式为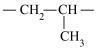 |
您最近一年使用:0次
7日内更新
|
671次组卷
|
4卷引用:陕西省咸阳市武功县普集高级中学2023-2024学年高二下学期6月月考化学试题
名校
10 . 利用 合成甲醇、二甲醚技术是有效利用
合成甲醇、二甲醚技术是有效利用 资源,实现“碳中和”目标的重要途径。
资源,实现“碳中和”目标的重要途径。
(1)开发 直接催化加氢合成二甲醚技术是很好的一个研究方向。
直接催化加氢合成二甲醚技术是很好的一个研究方向。
主反应: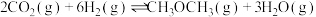

副反应:

①已知25℃和101kPa下,H2(g)、CO(g)的燃烧热 分别为-285.8kJ/mol、-283.0kJ/mol,
分别为-285.8kJ/mol、-283.0kJ/mol,
 ,则
,则
_______ kJ/mol。
②其他条件相同时,反应温度对 平衡转化率影响如图所示。温度低于280℃时,
平衡转化率影响如图所示。温度低于280℃时, 平衡转化率随温度的升高而减小的原因可能是
平衡转化率随温度的升高而减小的原因可能是_______ 。 ,反应平衡时测得
,反应平衡时测得 的转化率为20%,二甲醚的选择性为80%(已知二甲醚的选择性
的转化率为20%,二甲醚的选择性为80%(已知二甲醚的选择性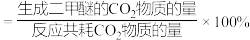 ),则副反应
),则副反应 的
的
_______ (保留两位有效数字,用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(2)利用 合成甲醇也是有效利用
合成甲醇也是有效利用 资源的重要途径。将原料气
资源的重要途径。将原料气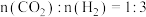 充入某一恒容密闭容器中,只发生
充入某一恒容密闭容器中,只发生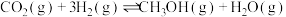
 ,在不同催化剂作用下,反应
,在不同催化剂作用下,反应 时
时 的转化率随温度的变化如图所示。
的转化率随温度的变化如图所示。_______ 。
A.使用催化剂Ⅰ时,d点已达到平衡
B. 的平衡常数大于
的平衡常数大于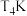 的平衡常数
的平衡常数
C.若a点时, ,则此条件下反应已达到最大限度
,则此条件下反应已达到最大限度
D.c点转化率比a点低的原因一定是催化剂活性降低
②若图中a点时反应已达平衡,现原料气按 充入同一恒容密闭容器中,在催化剂Ⅰ的作用下发生反应。请在图中用实线画出
充入同一恒容密闭容器中,在催化剂Ⅰ的作用下发生反应。请在图中用实线画出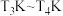 之间
之间 的平衡转化率变化曲线
的平衡转化率变化曲线______ 。
(3)水煤气变换反应的机理被广泛研究,其中有一种为羧基机理,某催化剂催化 (*表示吸附态、
(*表示吸附态、 表示活化能)步骤如下:
表示活化能)步骤如下:
Ⅰ.

Ⅱ._______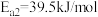
Ⅲ.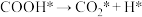

Ⅳ._______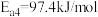
①请补充其中的一个反应式:Ⅱ_______ 。
②反应 的决速步骤是
的决速步骤是_______ (填序号)。
 合成甲醇、二甲醚技术是有效利用
合成甲醇、二甲醚技术是有效利用 资源,实现“碳中和”目标的重要途径。
资源,实现“碳中和”目标的重要途径。(1)开发
 直接催化加氢合成二甲醚技术是很好的一个研究方向。
直接催化加氢合成二甲醚技术是很好的一个研究方向。主反应:
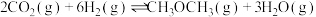

副反应:


①已知25℃和101kPa下,H2(g)、CO(g)的燃烧热
 分别为-285.8kJ/mol、-283.0kJ/mol,
分别为-285.8kJ/mol、-283.0kJ/mol,
 ,则
,则
②其他条件相同时,反应温度对
 平衡转化率影响如图所示。温度低于280℃时,
平衡转化率影响如图所示。温度低于280℃时, 平衡转化率随温度的升高而减小的原因可能是
平衡转化率随温度的升高而减小的原因可能是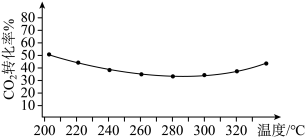
 ,反应平衡时测得
,反应平衡时测得 的转化率为20%,二甲醚的选择性为80%(已知二甲醚的选择性
的转化率为20%,二甲醚的选择性为80%(已知二甲醚的选择性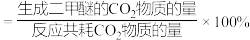 ),则副反应
),则副反应 的
的
(2)利用
 合成甲醇也是有效利用
合成甲醇也是有效利用 资源的重要途径。将原料气
资源的重要途径。将原料气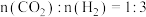 充入某一恒容密闭容器中,只发生
充入某一恒容密闭容器中,只发生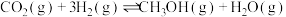
 ,在不同催化剂作用下,反应
,在不同催化剂作用下,反应 时
时 的转化率随温度的变化如图所示。
的转化率随温度的变化如图所示。
A.使用催化剂Ⅰ时,d点已达到平衡
B.
 的平衡常数大于
的平衡常数大于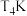 的平衡常数
的平衡常数C.若a点时,
 ,则此条件下反应已达到最大限度
,则此条件下反应已达到最大限度D.c点转化率比a点低的原因一定是催化剂活性降低
②若图中a点时反应已达平衡,现原料气按
 充入同一恒容密闭容器中,在催化剂Ⅰ的作用下发生反应。请在图中用实线画出
充入同一恒容密闭容器中,在催化剂Ⅰ的作用下发生反应。请在图中用实线画出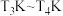 之间
之间 的平衡转化率变化曲线
的平衡转化率变化曲线(3)水煤气变换反应的机理被广泛研究,其中有一种为羧基机理,某催化剂催化
 (*表示吸附态、
(*表示吸附态、 表示活化能)步骤如下:
表示活化能)步骤如下:Ⅰ.


Ⅱ._______
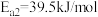
Ⅲ.
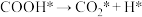

Ⅳ._______
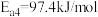
①请补充其中的一个反应式:Ⅱ
②反应
 的决速步骤是
的决速步骤是
您最近一年使用:0次