名校
1 . 缓冲溶液指的是由弱酸及其盐组成的混合溶液。缓冲溶液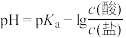 ,当酸和盐浓度相等时缓冲能力最强。丙酸(
,当酸和盐浓度相等时缓冲能力最强。丙酸( )简写为HR,其酸性比亚硝酸(
)简写为HR,其酸性比亚硝酸( )弱。298K时,用pH为13的NaOH溶液滴定
)弱。298K时,用pH为13的NaOH溶液滴定 溶液,溶液pH与NaOH溶液体积的关系如图所示。已知:
溶液,溶液pH与NaOH溶液体积的关系如图所示。已知: ,
,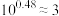 。
。
下列叙述正确的是
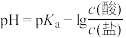 ,当酸和盐浓度相等时缓冲能力最强。丙酸(
,当酸和盐浓度相等时缓冲能力最强。丙酸( )简写为HR,其酸性比亚硝酸(
)简写为HR,其酸性比亚硝酸( )弱。298K时,用pH为13的NaOH溶液滴定
)弱。298K时,用pH为13的NaOH溶液滴定 溶液,溶液pH与NaOH溶液体积的关系如图所示。已知:
溶液,溶液pH与NaOH溶液体积的关系如图所示。已知: ,
,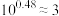 。
。下列叙述正确的是
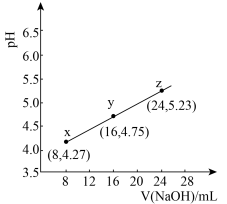
A.常温下,丙酸电离常数 的数量级为 的数量级为 |
| B.在x、y、z点溶液中,缓冲能力最强的是z点 |
C.在z点溶液中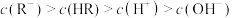 |
| D.若用同体积同浓度HNO2溶液替代HR溶液,则图中曲线竖直上移 |
您最近一年使用:0次
2024-04-05更新
|
73次组卷
|
2卷引用:四川省成都电子科技大学实验中学2023-2024学年高二上学期期末模拟化学试题
名校
2 . 某温度下, 和
和 的沉淀溶解平衡曲线如下图(图中
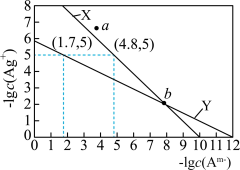
的沉淀溶解平衡曲线如下图(图中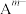 表示
表示 或
或 )所示,下列说法正确的是
)所示,下列说法正确的是
 和
和 的沉淀溶解平衡曲线如下图(图中
的沉淀溶解平衡曲线如下图(图中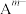 表示
表示 或
或 )所示,下列说法正确的是
)所示,下列说法正确的是
A. 是 是 的沉淀溶解平衡曲线 的沉淀溶解平衡曲线 |
B.a点时, 和 和 均生成沉淀 均生成沉淀 |
C.b点时,有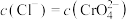 ,则 ,则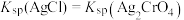 |
D.当用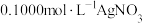 溶液滴定 溶液滴定 浓度约为 浓度约为 的溶液时,可用 的溶液时,可用 作指示剂( 作指示剂( 为红色沉淀) 为红色沉淀) |
您最近一年使用:0次
2024-03-14更新
|
191次组卷
|
2卷引用:浙江省杭州市浙江大学附属中学2023-2024学年高二上学期期末考试化学试题
3 . 铁酸锌(ZnFe2O4)是可见光的敏感半导体材料,也可以用作脱硫剂,难溶于水和稀硫酸,以锌灰(含ZnO及少量PbO、CuO、Fe2O3、SiO2)和Fe2(SO4)3为原料制备的ZnFe2O4的过程可以表示为下图:

已知:锌和铝都是活泼金属,它们的单质及化合物的性质具有一定的相似性
(1)请写出ZnO与氢氧化钠溶液反应的化学反应方程式:___________ 。
(2)下列说法正确的是___________。
(3)浸取过程中为了提高锌灰的浸取效果,还可以采取哪些方法(写出两种)___________ 。
(4)700℃时ZnFe2O4会分解,设计实验验证ZnFe2O4中含有Fe元素:___________ 。
(5)400℃时,装有脱硫剂的硫化反应器中,ZnFe2O4与H2、H2S反应生硫化物,其化学方程式为___________ 。

已知:锌和铝都是活泼金属,它们的单质及化合物的性质具有一定的相似性
(1)请写出ZnO与氢氧化钠溶液反应的化学反应方程式:
(2)下列说法正确的是___________。
| A.杂质中的SiO2属于酸性氧化物,能与Fe2O3反应 |
| B.除杂过程包括加足量锌粉、双氧水氧化等步骤,除Pb2+和Cu2+外,与锌粉反应的离子还有Fe3+和H+ |
| C.碳酸氢钠是为了调节溶液的pH,也可以用弱碱NH3·H2O代替 |
| D.ZnFe2O4难溶于稀硫酸,但在SO2-H2SO4体系中溶解度会明显增大 |
(3)浸取过程中为了提高锌灰的浸取效果,还可以采取哪些方法(写出两种)
(4)700℃时ZnFe2O4会分解,设计实验验证ZnFe2O4中含有Fe元素:
(5)400℃时,装有脱硫剂的硫化反应器中,ZnFe2O4与H2、H2S反应生硫化物,其化学方程式为
您最近一年使用:0次
4 . 将 转化为
转化为 、
、 等燃料,可以有效缓解能源危机,同时可以减少温室气体,实现“双碳目标”。
等燃料,可以有效缓解能源危机,同时可以减少温室气体,实现“双碳目标”。
 还原
还原 的热化学方程式如下:
的热化学方程式如下:
Ⅰ:
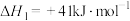
Ⅱ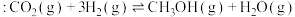
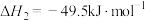
(1)已知反应Ⅰ、Ⅱ的平衡常数分别为 、
、 。由盖斯定律可知,
。由盖斯定律可知, 与
与 反应生成
反应生成 的热化学方程式为
的热化学方程式为_______ ,其平衡常数
_______ (用 、
、 表示)。
表示)。
(2)若反应Ⅰ的正反应活化能表示为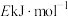 ,则
,则
_______ (填“>”、“<”或“=”)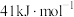 。
。
(3) 、初始压强为
、初始压强为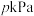 时,向
时,向 恒容密闭容器中充入
恒容密闭容器中充入 和
和 ,发生反应Ⅰ,
,发生反应Ⅰ, 达到平衡时,测得
达到平衡时,测得 的物质的量为
的物质的量为 。
。
①平衡时 的体积分数
的体积分数
_______ (填分数),
_______ (用平衡分压代替平衡浓度计算,分压=总压 物质的量分数)。
物质的量分数)。
②下列措施既能加快反应速率又能提高 平衡转化率的是
平衡转化率的是_______ (填字母)。
A.升高反应温度 B.增大 的浓度
的浓度
C.分离出 D.缩小容器容积
D.缩小容器容积
③ 时,向
时,向 密闭容器中充入
密闭容器中充入 和一定量的
和一定量的 ,发生反应Ⅰ,两种气体的平衡转化率
,发生反应Ⅰ,两种气体的平衡转化率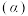 与起始反应物的物质的量之比[
与起始反应物的物质的量之比[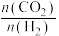 ]的关系如图所示。能表示
]的关系如图所示。能表示 平衡转化率的曲线是
平衡转化率的曲线是_______ (填“ ”或“
”或“ ”),
”), 点的纵坐标
点的纵坐标
_______ (结果精确至 )。
)。
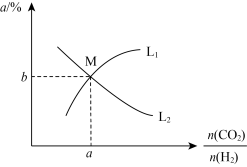
 转化为
转化为 、
、 等燃料,可以有效缓解能源危机,同时可以减少温室气体,实现“双碳目标”。
等燃料,可以有效缓解能源危机,同时可以减少温室气体,实现“双碳目标”。 还原
还原 的热化学方程式如下:
的热化学方程式如下:Ⅰ:

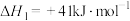
Ⅱ
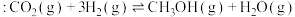
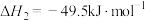
(1)已知反应Ⅰ、Ⅱ的平衡常数分别为
 、
、 。由盖斯定律可知,
。由盖斯定律可知, 与
与 反应生成
反应生成 的热化学方程式为
的热化学方程式为
 、
、 表示)。
表示)。(2)若反应Ⅰ的正反应活化能表示为
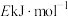 ,则
,则
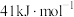 。
。(3)
 、初始压强为
、初始压强为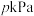 时,向
时,向 恒容密闭容器中充入
恒容密闭容器中充入 和
和 ,发生反应Ⅰ,
,发生反应Ⅰ, 达到平衡时,测得
达到平衡时,测得 的物质的量为
的物质的量为 。
。①平衡时
 的体积分数
的体积分数

 物质的量分数)。
物质的量分数)。②下列措施既能加快反应速率又能提高
 平衡转化率的是
平衡转化率的是A.升高反应温度 B.增大
 的浓度
的浓度C.分离出
 D.缩小容器容积
D.缩小容器容积③
 时,向
时,向 密闭容器中充入
密闭容器中充入 和一定量的
和一定量的 ,发生反应Ⅰ,两种气体的平衡转化率
,发生反应Ⅰ,两种气体的平衡转化率 与起始反应物的物质的量之比[
与起始反应物的物质的量之比[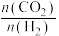 ]的关系如图所示。能表示
]的关系如图所示。能表示 平衡转化率的曲线是
平衡转化率的曲线是 ”或“
”或“ ”),
”), 点的纵坐标
点的纵坐标
 )。
)。
您最近一年使用:0次
解题方法
5 . 某装置中模拟 捕获和转化,先进行反应①
捕获和转化,先进行反应①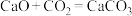 ,反应完毕后向装置中以恒定流速通入恒定组成的
,反应完毕后向装置中以恒定流速通入恒定组成的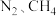 混合气,进行反应②
混合气,进行反应② ,单位时间流出气体各组分的物质的量随反应时间变化如图所示。第二阶段反应中始终未检测到
,单位时间流出气体各组分的物质的量随反应时间变化如图所示。第二阶段反应中始终未检测到 。下列说法错误的是
。下列说法错误的是
 捕获和转化,先进行反应①
捕获和转化,先进行反应①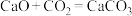 ,反应完毕后向装置中以恒定流速通入恒定组成的
,反应完毕后向装置中以恒定流速通入恒定组成的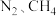 混合气,进行反应②
混合气,进行反应② ,单位时间流出气体各组分的物质的量随反应时间变化如图所示。第二阶段反应中始终未检测到
,单位时间流出气体各组分的物质的量随反应时间变化如图所示。第二阶段反应中始终未检测到 。下列说法错误的是
。下列说法错误的是
A. 后催化剂催化效果逐渐降低 后催化剂催化效果逐渐降低 |
B.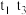 ,存在生成 ,存在生成 的副反应 的副反应 |
C. 时催化剂上开始积碳 时催化剂上开始积碳 |
D. 时,副反应生成 时,副反应生成 的速率小于反应②生成 的速率小于反应②生成 速率 速率 |
您最近一年使用:0次
2024-02-04更新
|
231次组卷
|
2卷引用:山东省东营市2023-2024学年高二期末考试化学试题
名校
解题方法
6 . 重金属有毒,会对水造成污染,某工厂生产的废水中含有 和少量的
和少量的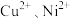 ,可采用图流程进行逐一分离,实现资源再利用。
,可采用图流程进行逐一分离,实现资源再利用。 的
的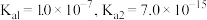 。
。
回答下列问题:
(1) 中
中 元素的化合价为
元素的化合价为_____ , 在还原池中发生反应的离子方程式为
在还原池中发生反应的离子方程式为______ 。
(2)沉淀1是 ,若
,若 时沉淀1恰好沉淀完全,则其
时沉淀1恰好沉淀完全,则其
_______ (已知: ,化为最简),其性质与
,化为最简),其性质与 相似,请写出
相似,请写出 与
与 反应的化学方程式:
反应的化学方程式:_______ 。
(3)① 溶液呈碱性的原因是
溶液呈碱性的原因是_____ (用离子方程式表示),沉淀2是_____ 。
②若有一种溶液由等体积、等物质的量浓度的氢硫酸和硫化钠溶液混合而成,则混合后溶液中的离子浓度关系正确的是_____ (填序号)。
A.
B.
C.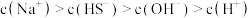
D.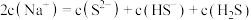
(4)若 时
时 平衡浓度为
平衡浓度为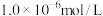 ,则此时沉淀池2中
,则此时沉淀池2中 的浓度为
的浓度为____  。
。
 和少量的
和少量的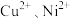 ,可采用图流程进行逐一分离,实现资源再利用。
,可采用图流程进行逐一分离,实现资源再利用。
 的
的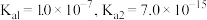 。
。回答下列问题:
(1)
 中
中 元素的化合价为
元素的化合价为 在还原池中发生反应的离子方程式为
在还原池中发生反应的离子方程式为(2)沉淀1是
 ,若
,若 时沉淀1恰好沉淀完全,则其
时沉淀1恰好沉淀完全,则其
 ,化为最简),其性质与
,化为最简),其性质与 相似,请写出
相似,请写出 与
与 反应的化学方程式:
反应的化学方程式:(3)①
 溶液呈碱性的原因是
溶液呈碱性的原因是②若有一种溶液由等体积、等物质的量浓度的氢硫酸和硫化钠溶液混合而成,则混合后溶液中的离子浓度关系正确的是
A.

B.

C.
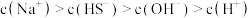
D.
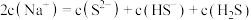
(4)若
 时
时 平衡浓度为
平衡浓度为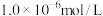 ,则此时沉淀池2中
,则此时沉淀池2中 的浓度为
的浓度为 。
。
您最近一年使用:0次
7 . 已知 的电离常数
的电离常数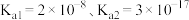 。常温下,难溶物
。常温下,难溶物 在不同浓度盐酸(足量)中恰好不再溶解时,测得混合液中
在不同浓度盐酸(足量)中恰好不再溶解时,测得混合液中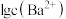 与
与 的关系如图所示,下列说法正确的是
的关系如图所示,下列说法正确的是
 的电离常数
的电离常数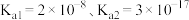 。常温下,难溶物
。常温下,难溶物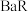 在不同浓度盐酸(足量)中恰好不再溶解时,测得混合液中
在不同浓度盐酸(足量)中恰好不再溶解时,测得混合液中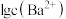 与
与 的关系如图所示,下列说法正确的是
的关系如图所示,下列说法正确的是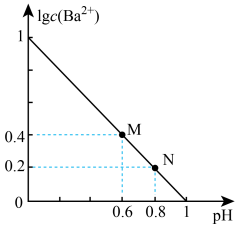
A.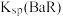 约为 约为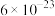 |
B.M点: |
C.N点: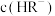 约为 约为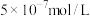 |
D.直线上任一点均满足: |
您最近一年使用:0次
2024-01-14更新
|
243次组卷
|
2卷引用:云南师范大学附属中学2023-2024学年高二上学期1月期末化学试题
8 . 某温度下,两种难溶盐 的饱和溶液中
的饱和溶液中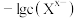 或
或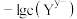 与
与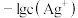 的关系如图所示。下列说法错误的是
的关系如图所示。下列说法错误的是
 的饱和溶液中
的饱和溶液中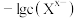 或
或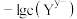 与
与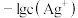 的关系如图所示。下列说法错误的是
的关系如图所示。下列说法错误的是
A. |
B.若混合溶液中各离子浓度如J点所示,加入 ,则平衡时 ,则平衡时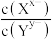 变小 变小 |
C.向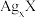 固体中加入 固体中加入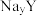 溶液,可发生 溶液,可发生 的转化 的转化 |
D.若混合溶液中各离子起始浓度如T点所示,待平衡时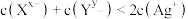 |
您最近一年使用:0次
2023-11-29更新
|
4543次组卷
|
7卷引用:宁夏银川一中2023-2024学年高二上学期期末考试化学试题
宁夏银川一中2023-2024学年高二上学期期末考试化学试题(已下线)专题06 沉淀溶解平衡-【寒假自学课】2024年高二化学寒假提升学与练(人教版2019)河南省信阳高级中学2023-2024学年高三上学期1月月考理综试题(已下线)题型14 电解质溶液-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)题型15 沉淀溶解平衡及图像分析-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)2023年河北省高考化学试卷(已下线)选择题11-14
名校
9 . 乙醇-水蒸气催化重整制氢过程发生的主要反应如下:
i.C2H5OH (g) +3H2O (g) 2CO2 (g) +6H2 (g) ΔH1
2CO2 (g) +6H2 (g) ΔH1
ii.CO2 (g) +H2 (g) CO (g) +H2O (g) ΔH2=+41kJ·mol-1
CO (g) +H2O (g) ΔH2=+41kJ·mol-1
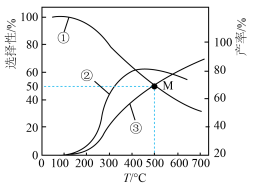
在1.0x105Pa时,向恒压密闭容器中通入1mol C2H5OH和3 mol H2O,若仅考虑上述反应,平衡时CO2和CO的选择性及H2的产率随温度的变化如图所示。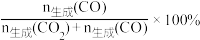 ]
]
回答下列问题:
(1)物质的标准摩尔生成焓是指由最稳定的单质合成标准压力p下单位物质的量的物质的反应焓变,用符号ΔfHm表示。
已知18g液态水气化需要吸收44kJ的能量,则ΔH1=___________ kJ·mol-1。
(2)已知曲线②代表H2的产率,温度在100~200℃时,H2的产率很低,原因是___________ 。
(3)下列措施可提高H2平衡产率的是___________ 。
a.高温高压 b.低温高压 c.使用高效催化剂 d.及时分离出CO2
(4)500℃、1.0x105Pa条件下,反应经过t分钟达到平衡,H2的产率为80%,则C2H5OH的反应速率为___________ kPa·min-1(保留小数点后一位),反应ii的物质的量分数平衡常数Kx的值为___________ 。
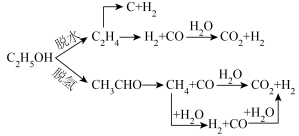
(5)乙醇重整制氢两条途径的机理如下图,Co/SiO2、Co/Al2O3和Co/MgO催化剂(酸性Al2O3>MgO>SiO2)在反应中表现出良好的催化活性和氢气选择性,但经长期反应后,催化剂表面均发现了积碳,积碳量Co/Al2O3>Co/MgO>Co/SiO2.试分析Al2O3表面的积碳量最大的原因___________ 。
i.C2H5OH (g) +3H2O (g)
 2CO2 (g) +6H2 (g) ΔH1
2CO2 (g) +6H2 (g) ΔH1ii.CO2 (g) +H2 (g)
 CO (g) +H2O (g) ΔH2=+41kJ·mol-1
CO (g) +H2O (g) ΔH2=+41kJ·mol-1在1.0x105Pa时,向恒压密闭容器中通入1mol C2H5OH和3 mol H2O,若仅考虑上述反应,平衡时CO2和CO的选择性及H2的产率随温度的变化如图所示。
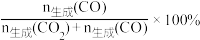 ]
]回答下列问题:
(1)物质的标准摩尔生成焓是指由最稳定的单质合成标准压力p下单位物质的量的物质的反应焓变,用符号ΔfHm表示。
| 物质 | C2H5OH(g) | H2O() | CO2(g) | H2(g) |
| ΔfHm/ kJ∙mol−1 | −235 | −286 | −393.5 | 0 |
(2)已知曲线②代表H2的产率,温度在100~200℃时,H2的产率很低,原因是
(3)下列措施可提高H2平衡产率的是
a.高温高压 b.低温高压 c.使用高效催化剂 d.及时分离出CO2
(4)500℃、1.0x105Pa条件下,反应经过t分钟达到平衡,H2的产率为80%,则C2H5OH的反应速率为
(5)乙醇重整制氢两条途径的机理如下图,Co/SiO2、Co/Al2O3和Co/MgO催化剂(酸性Al2O3>MgO>SiO2)在反应中表现出良好的催化活性和氢气选择性,但经长期反应后,催化剂表面均发现了积碳,积碳量Co/Al2O3>Co/MgO>Co/SiO2.试分析Al2O3表面的积碳量最大的原因
您最近一年使用:0次
2023-11-26更新
|
372次组卷
|
2卷引用:上海市青浦高中2023-2024学年高二上学期期末考试化学模拟试卷
名校
解题方法
10 . 已知 ℃时,
℃时,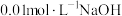 溶液的
溶液的 ,
, 的HA溶液中
的HA溶液中 ,则
,则 的HA溶液中水电离出的
的HA溶液中水电离出的 为
为
 ℃时,
℃时,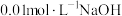 溶液的
溶液的 ,
, 的HA溶液中
的HA溶液中 ,则
,则 的HA溶液中水电离出的
的HA溶液中水电离出的 为
为A.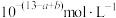 | B. |
C.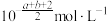 | D.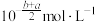 |
您最近一年使用:0次
2023-11-12更新
|
472次组卷
|
3卷引用:江西省鹰潭市2023-2024学年高二上学期1月期末考试化学试题



