名校
1 . 高纯镓广泛用于半导体、光电材料等领域。可以利用炼锌渣(主要含ZnO、CuO、 、FeO和一定量的
、FeO和一定量的 、不溶性杂质)为原料制备高纯镓,同时获得ZnS,流程如图所示:
、不溶性杂质)为原料制备高纯镓,同时获得ZnS,流程如图所示:
①电解制取镓时,溶液中的氯离子会影响镓的析出。
②溶液中存在反应: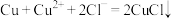 。
。
③室温时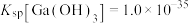 ;
;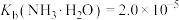 。
。
④黄钠铁矾晶体颗粒大,易沉降易过滤。
(1) 的价层电子排布式为
的价层电子排布式为_____ ,1mol 中含有σ键的物质的量为
中含有σ键的物质的量为_____ 。
(2)黄钠铁矾的化学式为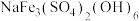 ,写出“沉铁”时的离子方程式
,写出“沉铁”时的离子方程式_____ 。
(3)不采用调节pH的方式沉铁,可能的原因是:①直接调pH沉铁易生成 胶体,不容易过滤;②
胶体,不容易过滤;②_____ ;③_____ 。
(4)“还原除杂”时先向溶液中加入一定量的铜粉,反应一段时间后再向溶液中加入稍过量Zn粉,加入铜粉的目的是_____ 。
(5) 与
与 的各物种的分布分数随pH的变化如图所示。“调节pH=8.2”时,pH不能过高的原因是
的各物种的分布分数随pH的变化如图所示。“调节pH=8.2”时,pH不能过高的原因是_____ 。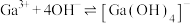 ,
,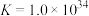 。通过计算探究氨水能否溶解
。通过计算探究氨水能否溶解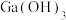 ,反应
,反应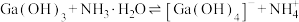 的平衡常数为
的平衡常数为_____ 。
(7)在沉铁前可以加入铁氰化钾检验 是否被完全氧化,若有
是否被完全氧化,若有 则会观察到蓝色沉淀。该蓝色沉淀是一种铁配合物
则会观察到蓝色沉淀。该蓝色沉淀是一种铁配合物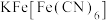 (其摩尔质量为M
(其摩尔质量为M ),其晶胞的
),其晶胞的 如图[
如图[ 未标出,占据四个互不相你的小方体晶胞的
未标出,占据四个互不相你的小方体晶胞的 部分)的体心。若该晶体的密度为
部分)的体心。若该晶体的密度为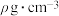 ,则
,则 和
和 的最短距离为
的最短距离为_____ cm(设 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
 、FeO和一定量的
、FeO和一定量的 、不溶性杂质)为原料制备高纯镓,同时获得ZnS,流程如图所示:
、不溶性杂质)为原料制备高纯镓,同时获得ZnS,流程如图所示: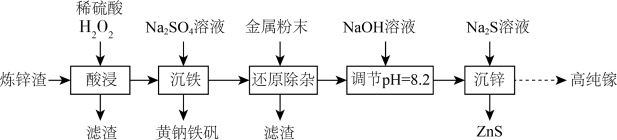
①电解制取镓时,溶液中的氯离子会影响镓的析出。
②溶液中存在反应:
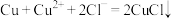 。
。③室温时
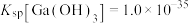 ;
;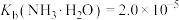 。
。④黄钠铁矾晶体颗粒大,易沉降易过滤。
(1)
 的价层电子排布式为
的价层电子排布式为 中含有σ键的物质的量为
中含有σ键的物质的量为(2)黄钠铁矾的化学式为
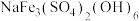 ,写出“沉铁”时的离子方程式
,写出“沉铁”时的离子方程式(3)不采用调节pH的方式沉铁,可能的原因是:①直接调pH沉铁易生成
 胶体,不容易过滤;②
胶体,不容易过滤;②(4)“还原除杂”时先向溶液中加入一定量的铜粉,反应一段时间后再向溶液中加入稍过量Zn粉,加入铜粉的目的是
(5)
 与
与 的各物种的分布分数随pH的变化如图所示。“调节pH=8.2”时,pH不能过高的原因是
的各物种的分布分数随pH的变化如图所示。“调节pH=8.2”时,pH不能过高的原因是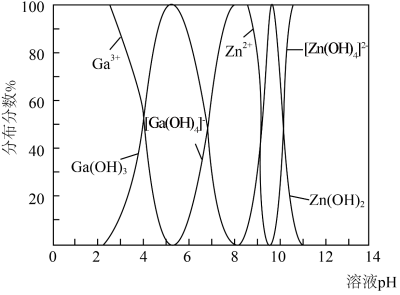
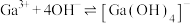 ,
,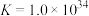 。通过计算探究氨水能否溶解
。通过计算探究氨水能否溶解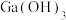 ,反应
,反应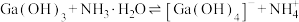 的平衡常数为
的平衡常数为(7)在沉铁前可以加入铁氰化钾检验
 是否被完全氧化,若有
是否被完全氧化,若有 则会观察到蓝色沉淀。该蓝色沉淀是一种铁配合物
则会观察到蓝色沉淀。该蓝色沉淀是一种铁配合物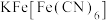 (其摩尔质量为M
(其摩尔质量为M ),其晶胞的
),其晶胞的 如图[
如图[ 未标出,占据四个互不相你的小方体晶胞的
未标出,占据四个互不相你的小方体晶胞的 部分)的体心。若该晶体的密度为
部分)的体心。若该晶体的密度为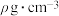 ,则
,则 和
和 的最短距离为
的最短距离为 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。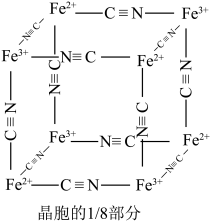
您最近一年使用:0次
名校
解题方法
2 . 一种利用炼锌渣(主要含 、
、 、
、 、
、 和一定量的
和一定量的 、不溶性杂质)为原料制备硫化锌及高纯镓的流程如图所示:
、不溶性杂质)为原料制备硫化锌及高纯镓的流程如图所示: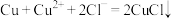 。
。
(1)基态 的价层电子排布式为
的价层电子排布式为___________ ,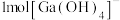 中含有
中含有 键的数目为
键的数目为___________ 。
(2)黄钠铁矾的化学式为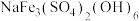 ,晶体颗粒大、易沉降。
,晶体颗粒大、易沉降。
①“沉铁”时生成黄钠铁矾的离子方程式为___________ 。
②不采用调节 的方式沉铁,可能的原因是:
的方式沉铁,可能的原因是: 容易生成
容易生成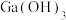 而损失;
而损失;___________ (答2点)。
(3)“还原除杂”时先向溶液中加入一定量的铜粉,反应一段时间后再向溶液中加入稍过量 粉,加入铜粉的目的是
粉,加入铜粉的目的是___________ 。
(4) 与
与 的各物种的分布分数随
的各物种的分布分数随 的变化如图所示。“调节
的变化如图所示。“调节 ”时,
”时, 不能过高的原因是
不能过高的原因是___________ 。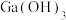 。已知:室温时,
。已知:室温时,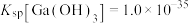 ,
,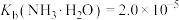 ,
,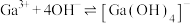
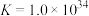 。反应
。反应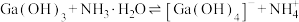 的平衡常数为
的平衡常数为___________ 。
(6)在沉铁前可以加入铁氰化钾检验 是否被完全氧化,若有
是否被完全氧化,若有 则会观察到蓝色沉淀。该蓝色沉淀是一种铁的配合物
则会观察到蓝色沉淀。该蓝色沉淀是一种铁的配合物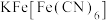 ,其晶胞的
,其晶胞的 如图[
如图[ 未标出,占据四个互不相邻的小立方体(晶胞的
未标出,占据四个互不相邻的小立方体(晶胞的 部分)的体心]。若该晶体的密度为
部分)的体心]。若该晶体的密度为 ,则1个该晶胞含
,则1个该晶胞含___________ 个 ,
, 和
和 的最短距离为
的最短距离为___________  (设
(设 为阿伏加德罗常数的值,列出计算式即可)。
为阿伏加德罗常数的值,列出计算式即可)。
 、
、 、
、 、
、 和一定量的
和一定量的 、不溶性杂质)为原料制备硫化锌及高纯镓的流程如图所示:
、不溶性杂质)为原料制备硫化锌及高纯镓的流程如图所示:
 。
。(1)基态
 的价层电子排布式为
的价层电子排布式为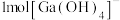 中含有
中含有 键的数目为
键的数目为(2)黄钠铁矾的化学式为
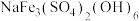 ,晶体颗粒大、易沉降。
,晶体颗粒大、易沉降。①“沉铁”时生成黄钠铁矾的离子方程式为
②不采用调节
 的方式沉铁,可能的原因是:
的方式沉铁,可能的原因是: 容易生成
容易生成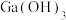 而损失;
而损失;(3)“还原除杂”时先向溶液中加入一定量的铜粉,反应一段时间后再向溶液中加入稍过量
 粉,加入铜粉的目的是
粉,加入铜粉的目的是(4)
 与
与 的各物种的分布分数随
的各物种的分布分数随 的变化如图所示。“调节
的变化如图所示。“调节 ”时,
”时, 不能过高的原因是
不能过高的原因是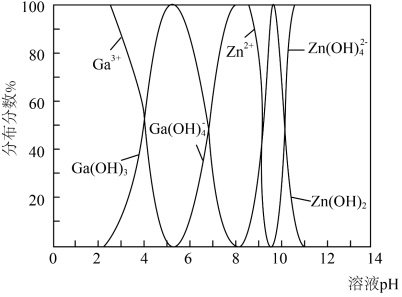
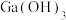 。已知:室温时,
。已知:室温时,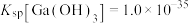 ,
,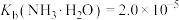 ,
,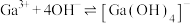
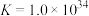 。反应
。反应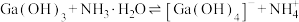 的平衡常数为
的平衡常数为(6)在沉铁前可以加入铁氰化钾检验
 是否被完全氧化,若有
是否被完全氧化,若有 则会观察到蓝色沉淀。该蓝色沉淀是一种铁的配合物
则会观察到蓝色沉淀。该蓝色沉淀是一种铁的配合物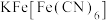 ,其晶胞的
,其晶胞的 如图[
如图[ 未标出,占据四个互不相邻的小立方体(晶胞的
未标出,占据四个互不相邻的小立方体(晶胞的 部分)的体心]。若该晶体的密度为
部分)的体心]。若该晶体的密度为 ,则1个该晶胞含
,则1个该晶胞含 ,
,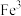 和
和 的最短距离为
的最短距离为 (设
(设 为阿伏加德罗常数的值,列出计算式即可)。
为阿伏加德罗常数的值,列出计算式即可)。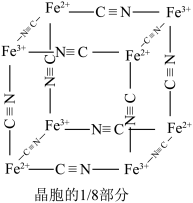
您最近一年使用:0次
名校
解题方法
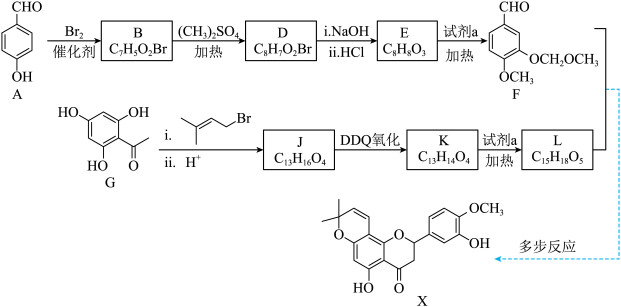
3 . 黄酮类物质X具有抗金黄色葡萄球菌、大肠杆菌等活性,一种合成路线如下。________ 。
(2)A→B反应的化学方程式是________ 。
(3)B→D的反应类型是________ 。
(4)E→F的反应同时生成HCl,试剂a的结构简式是________ 。
(5)G转化为J需加入 。
。
①J的结构简式是________ 。
② 的主要作用是
的主要作用是________ 。
(6)F和L生成X经历如下多步反应:________ 。
②三步反应中,涉及生成手性碳原子的为第________ 步(填“一”“二”或“三”)。
已知: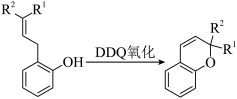
(2)A→B反应的化学方程式是
(3)B→D的反应类型是
(4)E→F的反应同时生成HCl,试剂a的结构简式是
(5)G转化为J需加入
 。
。①J的结构简式是
②
 的主要作用是
的主要作用是(6)F和L生成X经历如下多步反应:
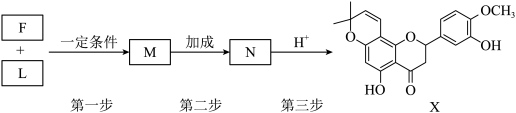
已知:Ⅰ.
Ⅱ.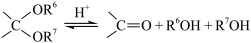
②三步反应中,涉及生成手性碳原子的为第
您最近一年使用:0次
2024-06-04更新
|
473次组卷
|
3卷引用:2024届福建省厦门第一中学高三下学期高考模拟(最后一卷)化学试题
4 . 苯乙烯是生产塑料、橡胶的重要原料,工业上以铁钴催化剂催化乙苯催化脱氢可获得苯乙烯。主要发生的反应为:_______ 。
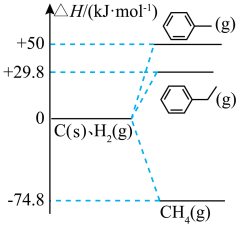
(2)已知,在298K、101kPa条件下,某些物质的相对能量(△H)变化关系如图所示,则△H2=_______ kJ•mol-1。_______ 。
(4)往刚性密闭容器中同时通入乙苯和一定比例水蒸气,控制反应温度为600℃、体系起始总压强为100kPa的条件下进行反应。
①通入水蒸气的作用有_______ 。
②假设容器中只发生反应I,测得体系总压和乙苯转化率随时间变化结果如图所示。_______ kPa,平衡常数Kp=_______ kPa(Kp为以分压表示的平衡常数,气体分压=气体总压×体积分数)。
③反应速率v正=k正×p(乙苯),v逆=k逆×p(苯乙烯)×p(氢气),k正、k逆分别为正、逆反应速率常数,则a点时 =
=_______ 。
(5)工业上也可以利用CO2弱氧化性在催化剂条件下制备苯乙烯,其反应的机理如图所示(α、β表示乙苯分子中C或H原子的位置;A、B为催化剂的活性位点,其中A位点带部分正电荷,B1、B2位点带部分负电荷)。αC—H的极性_______ (选填“>”或“<”)βC—H,步骤Ⅲ形成苯乙烯后更容易脱附的原因为_______ 。
反应I: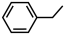 (g)
(g)
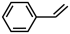 (g)+H2(g) △H1=+117.6kJ•mol-1
(g)+H2(g) △H1=+117.6kJ•mol-1
反应Ⅱ: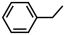 (g)+H2(g)
(g)+H2(g)
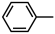 (g)+CH4(g) △H2
(g)+CH4(g) △H2
反应Ⅲ: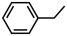 (g)
(g) 8C(s)+H2(g) △H3=-1.67kJ•mol-1
8C(s)+H2(g) △H3=-1.67kJ•mol-1
(2)已知,在298K、101kPa条件下,某些物质的相对能量(△H)变化关系如图所示,则△H2=
| A.v正(C6H5C2H5)=v正(C6H5C2H3) | B.容器内气体密度不再变化 |
| C.苯乙烯、H2的分子数之比不再变化 | D.气体的平均相对分子质量不再变化 |
(4)往刚性密闭容器中同时通入乙苯和一定比例水蒸气,控制反应温度为600℃、体系起始总压强为100kPa的条件下进行反应。
①通入水蒸气的作用有
②假设容器中只发生反应I,测得体系总压和乙苯转化率随时间变化结果如图所示。
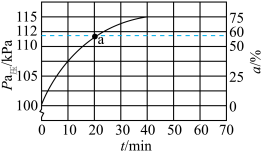
③反应速率v正=k正×p(乙苯),v逆=k逆×p(苯乙烯)×p(氢气),k正、k逆分别为正、逆反应速率常数,则a点时
 =
=(5)工业上也可以利用CO2弱氧化性在催化剂条件下制备苯乙烯,其反应的机理如图所示(α、β表示乙苯分子中C或H原子的位置;A、B为催化剂的活性位点,其中A位点带部分正电荷,B1、B2位点带部分负电荷)。αC—H的极性
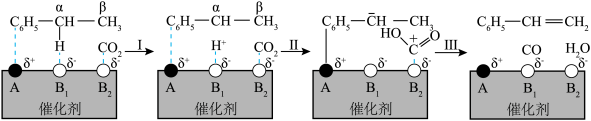
您最近一年使用:0次
名校
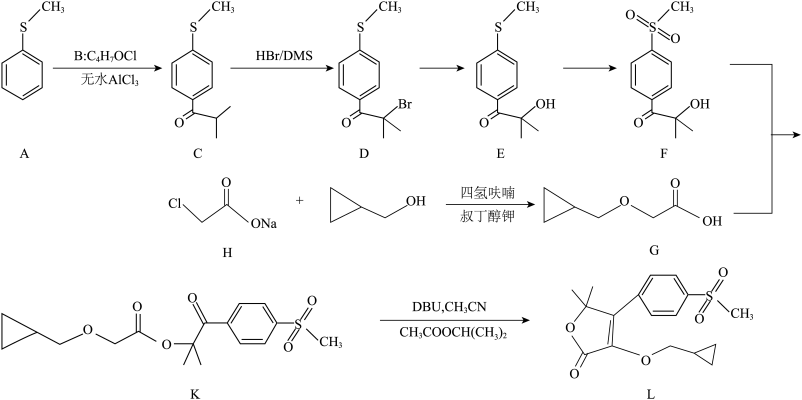
5 . 非罗考昔(化合物L)是一种非甾体抗炎药,其中一种合成路线如下(部分皮应条件略去):______ ,化合物L中所有元素电负性由大到小顺序为_______ 。
(2)已知羧基中羟基被氯取代称之为酰氯,则化合物B的名称为_______ 。
(3)从化合物A生成L的全过程中,下列说法正确的有_______ 。
A.有碳氧双键和碳氢单键断裂,也有碳碳双键和碳氧单键形成
B.反应物K中,碳原子采取的杂化方式有: 、
、 ,并且存在手性碳原子
,并且存在手性碳原子
C.化合物G中碳氧原子间的σ键与π键的个数之比为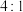
(4)基于上述反应原理,利用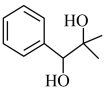 、
、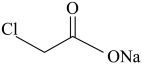 、
、 合成
合成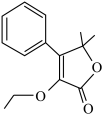
_______ 。
c.最后一步反应中,有机反应物为_______ (写结构简式)。
(2)已知羧基中羟基被氯取代称之为酰氯,则化合物B的名称为
(3)从化合物A生成L的全过程中,下列说法正确的有
A.有碳氧双键和碳氢单键断裂,也有碳碳双键和碳氧单键形成
B.反应物K中,碳原子采取的杂化方式有:
 、
、 ,并且存在手性碳原子
,并且存在手性碳原子C.化合物G中碳氧原子间的σ键与π键的个数之比为
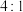
(4)基于上述反应原理,利用
 、
、 、
、 合成
合成
a.从 出发,第一步的化学方程式为
出发,第一步的化学方程式为
c.最后一步反应中,有机反应物为
您最近一年使用:0次
名校
6 . 二氧化铈( )具有较强的氧化性,是一种应用非常广泛的稀土氧化物。以氟碳铈矿(主要含
)具有较强的氧化性,是一种应用非常广泛的稀土氧化物。以氟碳铈矿(主要含 、
、 等)为原料制备
等)为原料制备 的一种工艺流程如图所示。
的一种工艺流程如图所示。
(1)“氧化焙烧”后,Ce元素转化为 和
和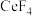 ,写出氧化焙烧的化学方程式
,写出氧化焙烧的化学方程式_______ 。
(2)“酸浸”时,铈的浸出率与温度、 的关系如图所示,应选择的最适宜的条件为
的关系如图所示,应选择的最适宜的条件为_______ (填标号)。不能用盐酸代替硫酸进行酸浸,理由是_______ 。 B.75℃、
B.75℃、 C.85℃、
C.85℃、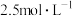 D.100℃、
D.100℃、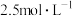
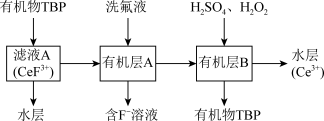
(3)“系列操作”包含以下几个过程: 不能溶于有机物TBP,
不能溶于有机物TBP,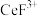 能溶于有机物TBP,且存在反应
能溶于有机物TBP,且存在反应 。
。
“系列操作”在_______ (填仪器名称)中完成,“有机层B”中发生反应的离子方程式为_______ 。
(4)“调pH”中,要使 沉淀完全(通常认为溶液中离子浓度小于
沉淀完全(通常认为溶液中离子浓度小于 为沉淀完全),应控制pH大于
为沉淀完全),应控制pH大于_______ (已知:25℃时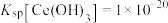 )。
)。
(5)“氧化”中,氧化剂与还原剂的物质的量之比为_______ 。
(6) 具有良好的储氧放氧能力,晶胞如图所示,是汽车尾气净化催化剂的关键成分。
具有良好的储氧放氧能力,晶胞如图所示,是汽车尾气净化催化剂的关键成分。 中位于晶粒表面的
中位于晶粒表面的 具有催化作用。已知
具有催化作用。已知 晶胞边长为
晶胞边长为 ,在边长为
,在边长为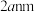 的立方体晶粒中位于表面的
的立方体晶粒中位于表面的 最多有
最多有_______ 个。
②在尾气消除过程中 与
与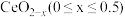 相互转化。
相互转化。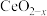 中的Ce为
中的Ce为 、
、 价,测定x的值可判断它们的比例。现取
价,测定x的值可判断它们的比例。现取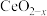 固体1.6560g,加入足量硫酸和
固体1.6560g,加入足量硫酸和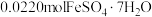 充分溶解,使
充分溶解,使 ⁺全部被还原成
⁺全部被还原成 ,再用
,再用 的酸性
的酸性 标准溶液滴定至终点,重复操作三次,平均消耗标准溶液40.00mL(已知氧化性:
标准溶液滴定至终点,重复操作三次,平均消耗标准溶液40.00mL(已知氧化性: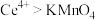 ),则x的值为
),则x的值为_______ ,则此时氧空位率为_______ 。
 )具有较强的氧化性,是一种应用非常广泛的稀土氧化物。以氟碳铈矿(主要含
)具有较强的氧化性,是一种应用非常广泛的稀土氧化物。以氟碳铈矿(主要含 、
、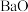 等)为原料制备
等)为原料制备 的一种工艺流程如图所示。
的一种工艺流程如图所示。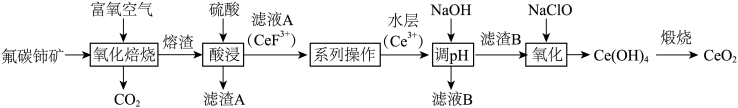
(1)“氧化焙烧”后,Ce元素转化为
 和
和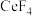 ,写出氧化焙烧的化学方程式
,写出氧化焙烧的化学方程式(2)“酸浸”时,铈的浸出率与温度、
 的关系如图所示,应选择的最适宜的条件为
的关系如图所示,应选择的最适宜的条件为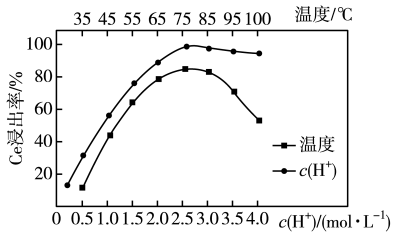
 B.75℃、
B.75℃、 C.85℃、
C.85℃、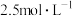 D.100℃、
D.100℃、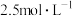
(3)“系列操作”包含以下几个过程:
 不能溶于有机物TBP,
不能溶于有机物TBP,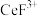 能溶于有机物TBP,且存在反应
能溶于有机物TBP,且存在反应 。
。“系列操作”在
(4)“调pH”中,要使
 沉淀完全(通常认为溶液中离子浓度小于
沉淀完全(通常认为溶液中离子浓度小于 为沉淀完全),应控制pH大于
为沉淀完全),应控制pH大于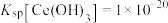 )。
)。(5)“氧化”中,氧化剂与还原剂的物质的量之比为
(6)
 具有良好的储氧放氧能力,晶胞如图所示,是汽车尾气净化催化剂的关键成分。
具有良好的储氧放氧能力,晶胞如图所示,是汽车尾气净化催化剂的关键成分。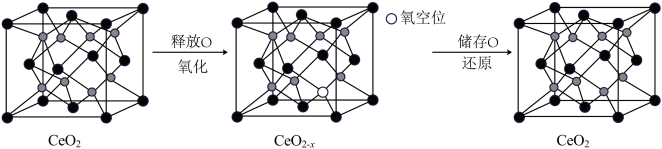
 中位于晶粒表面的
中位于晶粒表面的 具有催化作用。已知
具有催化作用。已知 晶胞边长为
晶胞边长为 ,在边长为
,在边长为 的立方体晶粒中位于表面的
的立方体晶粒中位于表面的 最多有
最多有②在尾气消除过程中
 与
与 相互转化。
相互转化。 中的Ce为
中的Ce为 、
、 价,测定x的值可判断它们的比例。现取
价,测定x的值可判断它们的比例。现取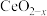 固体1.6560g,加入足量硫酸和
固体1.6560g,加入足量硫酸和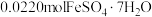 充分溶解,使
充分溶解,使 ⁺全部被还原成
⁺全部被还原成 ,再用
,再用 的酸性
的酸性 标准溶液滴定至终点,重复操作三次,平均消耗标准溶液40.00mL(已知氧化性:
标准溶液滴定至终点,重复操作三次,平均消耗标准溶液40.00mL(已知氧化性: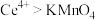 ),则x的值为
),则x的值为
您最近一年使用:0次
7 . 铋及其化合物广泛应用于电子材料、医药等领域.一种以含铋烧渣(主要成分为 ,还含有少量
,还含有少量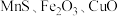 及
及 等)制取
等)制取 并回收锰的工艺流程如下:
并回收锰的工艺流程如下: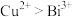 ;
;
② 易水解成
易水解成 沉淀;常温下,
沉淀;常温下, 存在的
存在的 范围约为
范围约为 ;回答下列问题:
;回答下列问题:
(1)基态锰原子的价电子排布式为____________ ;
(2)“水浸提锰”时,另加入少量稀硫酸可促进____________ (填化学式)溶解,进一步提高锰的浸取率;
(3)“浸出”时需要加入过量浓盐酸,其目的是____________ ;
(4)“滤渣2”的主要成分为Bi和____________ (填化学式);
(5)常温下,用铁氰化钾溶液检验“含 滤液”的现象为
滤液”的现象为____________ ;
(6)“脱氯”过程中发生主要反应的离子方程式为____________ ;
(7) 是一种性能优良的光催化剂,可催化降解有机污染物对硝基苯酚(
是一种性能优良的光催化剂,可催化降解有机污染物对硝基苯酚(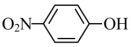 )等.对硝基苯酚的熔点高于邻硝基苯酚(
)等.对硝基苯酚的熔点高于邻硝基苯酚(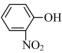 )的熔点,其原因是
)的熔点,其原因是____________________ ;
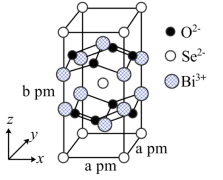
(8)我国科学家在新型二维半导体芯片材料——硒氧化铋的研究中取得突破性进展.硒氧化铋的晶胞结构如图所示,晶胞棱边夹角均为90°,晶胞参数为apm,apm,bpm;____________ (填标号); 周围紧邻的
周围紧邻的 共有
共有____________ 个;
③该晶体的密度为____________  (列出计算式,
(列出计算式, 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
 ,还含有少量
,还含有少量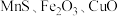 及
及 等)制取
等)制取 并回收锰的工艺流程如下:
并回收锰的工艺流程如下: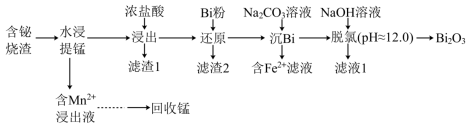
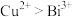 ;
;②
 易水解成
易水解成 沉淀;常温下,
沉淀;常温下, 存在的
存在的 范围约为
范围约为 ;回答下列问题:
;回答下列问题:(1)基态锰原子的价电子排布式为
(2)“水浸提锰”时,另加入少量稀硫酸可促进
(3)“浸出”时需要加入过量浓盐酸,其目的是
(4)“滤渣2”的主要成分为Bi和
(5)常温下,用铁氰化钾溶液检验“含
 滤液”的现象为
滤液”的现象为(6)“脱氯”过程中发生主要反应的离子方程式为
(7)
 是一种性能优良的光催化剂,可催化降解有机污染物对硝基苯酚(
是一种性能优良的光催化剂,可催化降解有机污染物对硝基苯酚( )等.对硝基苯酚的熔点高于邻硝基苯酚(
)等.对硝基苯酚的熔点高于邻硝基苯酚( )的熔点,其原因是
)的熔点,其原因是(8)我国科学家在新型二维半导体芯片材料——硒氧化铋的研究中取得突破性进展.硒氧化铋的晶胞结构如图所示,晶胞棱边夹角均为90°,晶胞参数为apm,apm,bpm;
A. B.
B.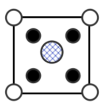 C.
C.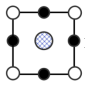 D.
D.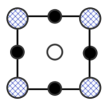
 周围紧邻的
周围紧邻的 共有
共有③该晶体的密度为
 (列出计算式,
(列出计算式, 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
您最近一年使用:0次
8 . 二氧化铈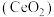 是一种用途广泛的稀土化合物。以氟碳铈矿(主要含
是一种用途广泛的稀土化合物。以氟碳铈矿(主要含 )为原料制备
)为原料制备 的一种工艺流程如图所示:
的一种工艺流程如图所示: 能与
能与 结合成
结合成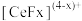 ,也能与
,也能与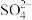 结合成
结合成 ;
;
②在硫酸体系中 能被萃取剂
能被萃取剂 萃取,而
萃取,而 不能。
不能。
回答下列问题:
(1)氧化焙烧中氧化的目的是_______ 。
(2)“萃取”时存在反应: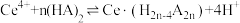 ,如图中D是分配比,表示
,如图中D是分配比,表示 分别在有机层中与水层中存在形式的物质的量浓度之比
分别在有机层中与水层中存在形式的物质的量浓度之比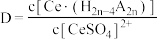 保持其它条件不变,若在起始料液中加入不同量的
保持其它条件不变,若在起始料液中加入不同量的 以改变水层中的
以改变水层中的 ,请解释D随起始料液中
,请解释D随起始料液中 变化的原因:
变化的原因:_______ 。 的作用下
的作用下 转化为
转化为 ,反应的离子方程式为:
,反应的离子方程式为:_______ 。
(4)向水层中加入 溶液来调节溶液的
溶液来调节溶液的 ,
, 应大于
应大于_______ 时, 完全生成
完全生成 沉淀。(已知
沉淀。(已知 )
)
(5)“氧化”步骤中氧化剂与还原剂物质的量之比为_______ 。
(6) 是汽车尾气净化催化剂的关键成分,它能在还原气氛中供氧,在氧化气氛中耗氧,在尾气消除过程中发生着
是汽车尾气净化催化剂的关键成分,它能在还原气氛中供氧,在氧化气氛中耗氧,在尾气消除过程中发生着 的循环,请写出
的循环,请写出 消除
消除 尾气(气体产物是空气的某一成分)的化学方程式
尾气(气体产物是空气的某一成分)的化学方程式_______ 。
(7)氧化铈 ,常用作玻璃工业添加剂,在其立方晶胞中掺杂
,常用作玻璃工业添加剂,在其立方晶胞中掺杂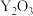 ,
, 占据原来
占据原来 的位置,可以得到更稳定的结构,如图所示,
的位置,可以得到更稳定的结构,如图所示, 晶胞中
晶胞中 与最近
与最近 的核间距为
的核间距为 。(已知:
。(已知: 的空缺率
的空缺率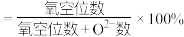 )
) 点原子的分数坐标为
点原子的分数坐标为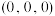 ,则
,则 点原子的分数坐标为
点原子的分数坐标为_______ 。
② 晶胞中与
晶胞中与 最近的
最近的 的个数为
的个数为_______ 。
③ 晶体的密度为
晶体的密度为_______ (只需列出表达式)。
④若掺杂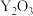 后得到
后得到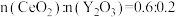 的晶体,则此晶体中
的晶体,则此晶体中 的空缺率为
的空缺率为_______ 。
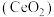 是一种用途广泛的稀土化合物。以氟碳铈矿(主要含
是一种用途广泛的稀土化合物。以氟碳铈矿(主要含 )为原料制备
)为原料制备 的一种工艺流程如图所示:
的一种工艺流程如图所示: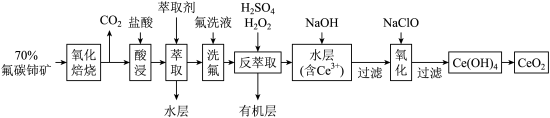
 能与
能与 结合成
结合成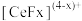 ,也能与
,也能与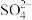 结合成
结合成 ;
;②在硫酸体系中
 能被萃取剂
能被萃取剂 萃取,而
萃取,而 不能。
不能。回答下列问题:
(1)氧化焙烧中氧化的目的是
(2)“萃取”时存在反应:
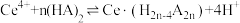 ,如图中D是分配比,表示
,如图中D是分配比,表示 分别在有机层中与水层中存在形式的物质的量浓度之比
分别在有机层中与水层中存在形式的物质的量浓度之比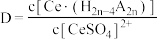 保持其它条件不变,若在起始料液中加入不同量的
保持其它条件不变,若在起始料液中加入不同量的 以改变水层中的
以改变水层中的 ,请解释D随起始料液中
,请解释D随起始料液中 变化的原因:
变化的原因: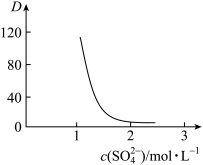
 的作用下
的作用下 转化为
转化为 ,反应的离子方程式为:
,反应的离子方程式为:(4)向水层中加入
 溶液来调节溶液的
溶液来调节溶液的 ,
, 应大于
应大于 完全生成
完全生成 沉淀。(已知
沉淀。(已知 )
)(5)“氧化”步骤中氧化剂与还原剂物质的量之比为
(6)
 是汽车尾气净化催化剂的关键成分,它能在还原气氛中供氧,在氧化气氛中耗氧,在尾气消除过程中发生着
是汽车尾气净化催化剂的关键成分,它能在还原气氛中供氧,在氧化气氛中耗氧,在尾气消除过程中发生着 的循环,请写出
的循环,请写出 消除
消除 尾气(气体产物是空气的某一成分)的化学方程式
尾气(气体产物是空气的某一成分)的化学方程式(7)氧化铈
 ,常用作玻璃工业添加剂,在其立方晶胞中掺杂
,常用作玻璃工业添加剂,在其立方晶胞中掺杂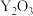 ,
, 占据原来
占据原来 的位置,可以得到更稳定的结构,如图所示,
的位置,可以得到更稳定的结构,如图所示, 晶胞中
晶胞中 与最近
与最近 的核间距为
的核间距为 。(已知:
。(已知: 的空缺率
的空缺率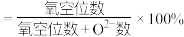 )
)
 点原子的分数坐标为
点原子的分数坐标为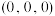 ,则
,则 点原子的分数坐标为
点原子的分数坐标为②
 晶胞中与
晶胞中与 最近的
最近的 的个数为
的个数为③
 晶体的密度为
晶体的密度为④若掺杂
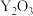 后得到
后得到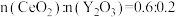 的晶体,则此晶体中
的晶体,则此晶体中 的空缺率为
的空缺率为
您最近一年使用:0次
9 . 利用环化反应合成天然产物callitrisic acid的部分合成路线如下。______ 。
(2)B与C互为同分异构体,核磁共振氢谱峰面积之比为6∶3∶2∶2∶2∶1,B的结构简式为______ 。
(3)C→D的反应类型为______ ;不能用酸性 溶液替换
溶液替换 的原因是
的原因是______ 。
(4)D→E为取代反应,同时生成HCl和 ,其化学方程式为
,其化学方程式为______ 。
(5)E→F发生了傅克酰基化反应,其反应机理如下(―R为烃基)。______ 。
②傅克酰基化反应较难生成多元取代产物的原因是______ 。
(6)F→G发生了鲁滨逊增环反应,是通过迈克尔加成反应和羟醛缩合两步完成的。______ 。

(2)B与C互为同分异构体,核磁共振氢谱峰面积之比为6∶3∶2∶2∶2∶1,B的结构简式为
(3)C→D的反应类型为
 溶液替换
溶液替换 的原因是
的原因是(4)D→E为取代反应,同时生成HCl和
 ,其化学方程式为
,其化学方程式为(5)E→F发生了傅克酰基化反应,其反应机理如下(―R为烃基)。
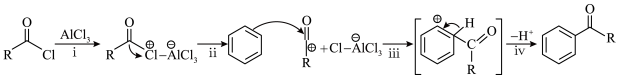
②傅克酰基化反应较难生成多元取代产物的原因是
(6)F→G发生了鲁滨逊增环反应,是通过迈克尔加成反应和羟醛缩合两步完成的。
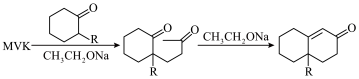
已知: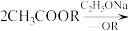
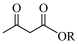
②以 和MVK为原料合成
和MVK为原料合成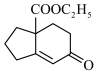 ,路线
,路线
您最近一年使用:0次
10 . 铁是人体必需的微量元素,在人类生产和生活中也有重要作用。
(1)某含Fe2+的结晶水合物的结构片段如图所示(球与球之间的短线代表单键或双键)。

该结晶水合物的化学式为___________ ,其中Fe2+和H2O之间的作用力类型为_____________ 。
(2)用邻二氮菲(phen,结构为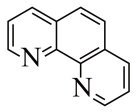 )与琥珀酸亚铁生成稳定的橙色配合物,可测定Fe2+的浓度,发生反应:
)与琥珀酸亚铁生成稳定的橙色配合物,可测定Fe2+的浓度,发生反应: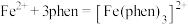 。用邻二氮菲测定Fe2+浓度时应控制pH为2~9的适宜范围,请解释原因:
。用邻二氮菲测定Fe2+浓度时应控制pH为2~9的适宜范围,请解释原因:_____________________________________ 。
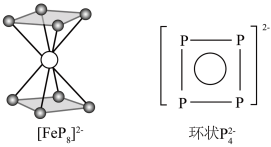
(3)南开大学某课题组合成无机二茂铁的配离子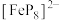 ,其中环状配体
,其中环状配体 以π电子参与配位,结构如图。该配离子中与Fe2+形成配位键的电子共有
以π电子参与配位,结构如图。该配离子中与Fe2+形成配位键的电子共有________ 个,P原子的价层孤电子对占据________ (填标号)。
A. 3s轨道 B. 3p轨道 C. sp2杂化轨道 D. sp3杂化轨道
(4)铁及其化合物的晶体种类较多。Fe和N可组成一种过渡金属氮化物,其晶胞如图所示,六棱柱底边边长为xcm,高为ycm,NA为阿伏加德罗常数的值,则晶胞密度为__________  (列出计算式即可)。
(列出计算式即可)。
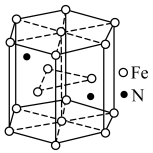
(1)某含Fe2+的结晶水合物的结构片段如图所示(球与球之间的短线代表单键或双键)。

该结晶水合物的化学式为
(2)用邻二氮菲(phen,结构为
 )与琥珀酸亚铁生成稳定的橙色配合物,可测定Fe2+的浓度,发生反应:
)与琥珀酸亚铁生成稳定的橙色配合物,可测定Fe2+的浓度,发生反应: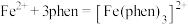 。用邻二氮菲测定Fe2+浓度时应控制pH为2~9的适宜范围,请解释原因:
。用邻二氮菲测定Fe2+浓度时应控制pH为2~9的适宜范围,请解释原因:(3)南开大学某课题组合成无机二茂铁的配离子
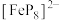 ,其中环状配体
,其中环状配体 以π电子参与配位,结构如图。该配离子中与Fe2+形成配位键的电子共有
以π电子参与配位,结构如图。该配离子中与Fe2+形成配位键的电子共有A. 3s轨道 B. 3p轨道 C. sp2杂化轨道 D. sp3杂化轨道

(4)铁及其化合物的晶体种类较多。Fe和N可组成一种过渡金属氮化物,其晶胞如图所示,六棱柱底边边长为xcm,高为ycm,NA为阿伏加德罗常数的值,则晶胞密度为
 (列出计算式即可)。
(列出计算式即可)。
您最近一年使用:0次



