1 . 功能高分子材料H在生活中有广泛用途,阿司匹林是生活中常用的药物。以芳香内酯R为原料制备H和阿司匹林的流程如下: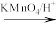 CH3COOH+CH3CH2COOH
CH3COOH+CH3CH2COOH
请回答下列问题:
(1)D分子中采取sp2杂化的碳原子数目为___________ 。
(2)F的名称是___________ ;A中的含氧官能团的名称是___________ 。
(3)R→A转化中i)的反应类型是___________ ;B的结构简式为___________ 。
(4)由C合成H的化学方程式为___________ 。
(5)D有多种同分异构体,同时具备下列条件的结构简式为___________ 。
①遇氯化铁溶液发生显色反应;
②在酸性条件下水解产物之一能发生银镜反应;
③苯环上一溴代物只有2种。
(6)参照上述流程和相关信息,写出以环丙烷( )和乙醇为原料制备丙二酸二乙酯(
)和乙醇为原料制备丙二酸二乙酯(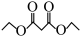 )的合成路线(无机试剂任选)
)的合成路线(无机试剂任选)___________ 。
 CH3COOH+CH3CH2COOH
CH3COOH+CH3CH2COOH请回答下列问题:
(1)D分子中采取sp2杂化的碳原子数目为
(2)F的名称是
(3)R→A转化中i)的反应类型是
(4)由C合成H的化学方程式为
(5)D有多种同分异构体,同时具备下列条件的结构简式为
①遇氯化铁溶液发生显色反应;
②在酸性条件下水解产物之一能发生银镜反应;
③苯环上一溴代物只有2种。
(6)参照上述流程和相关信息,写出以环丙烷(
 )和乙醇为原料制备丙二酸二乙酯(
)和乙醇为原料制备丙二酸二乙酯( )的合成路线(无机试剂任选)
)的合成路线(无机试剂任选)
您最近一年使用:0次
名校
解题方法
2 . W、X、Y、Z、M是原子序数依次增大的短周期主族元素,Y的最外层电子数等于X核外电子总数,五种主族元素组成的化合物Q的结构如图所示。下列说法正确的是
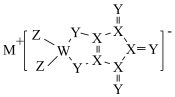
A.简单离子半径: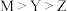 | B.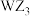 和 和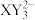 的空间结构不相同 的空间结构不相同 |
C.简单氢化物沸点: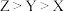 | D.第一电离能: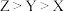 |
您最近一年使用:0次
2024-04-01更新
|
607次组卷
|
2卷引用:甘肃省兰州第一中学2023-2024学年高二下学期4月期中考试化学试题
名校
3 . 以炼铁厂锌灰(主要成分为ZnO,含少量的CuO、SiO2、Fe2O3)为原料制备ZnO的流程如图所示。下列说法正确的是
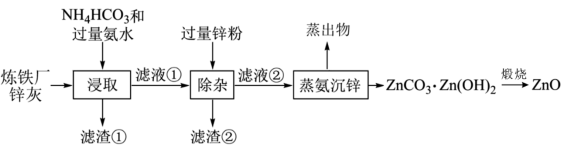
| A.H-N-H键角:[Cu(NH3)4]2+<NH3 |
| B.“滤渣②”的主要成分为Fe、Cu和Zn |
| C.所含金属元素的质量“滤液①”<“滤液②” |
| D.“煅烧”时需要在隔绝空气条件下进行 |
您最近一年使用:0次
2024-03-22更新
|
465次组卷
|
2卷引用:甘肃省兰州第一中学2023-2024学年高二下学期4月期中考试化学试题
4 . 肼 (N2H4)是一种二元弱碱。常温下,向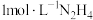 水溶液中滴加盐酸,所得混合溶液中
水溶液中滴加盐酸,所得混合溶液中 或
或 与pH的变化关系如图所示。下列说法错误的是
与pH的变化关系如图所示。下列说法错误的是

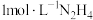 水溶液中滴加盐酸,所得混合溶液中
水溶液中滴加盐酸,所得混合溶液中 或
或 与pH的变化关系如图所示。下列说法错误的是
与pH的变化关系如图所示。下列说法错误的是
A.常温下, 的电离平衡常数 的电离平衡常数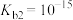 |
B.常温下,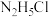 溶液的 溶液的 |
C.M点溶液中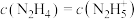 |
D.当溶液 时, 时,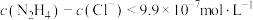 |
您最近一年使用:0次
2024-03-18更新
|
221次组卷
|
3卷引用:甘肃省平凉市静宁县第一中学2023-2024学年高三下学期开学化学试题
解题方法
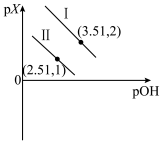
5 . 1,3-丙二胺[H2N(CH2)3NH2]是一种二元弱碱[可简写为M(OH)2],25℃时,向一定浓度的MCl2溶液中逐滴加入NaOH溶液,以X表示 或
或 已知pX=-lgX,混合溶液中pX与pOH的关系如图所示。下列说法正确的是
已知pX=-lgX,混合溶液中pX与pOH的关系如图所示。下列说法正确的是
 或
或 已知pX=-lgX,混合溶液中pX与pOH的关系如图所示。下列说法正确的是
已知pX=-lgX,混合溶液中pX与pOH的关系如图所示。下列说法正确的是
A.曲线Ⅱ表示p{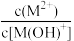 }与pOH的关系 }与pOH的关系 |
| B.M(OH)2第一步电离的电离常数为1×10-1.51 |
| C.pOH=4.01时,c(M2+)=c[M(OH)2]>c[M(OH)+] |
| D.pOH=3.51时,3c[M(OH)2]+c(OH-)=c(H+)+c(Na+) |
您最近一年使用:0次
6 . 室温下,用HCl调节 Na3R溶液的 pH,混合溶液的 pH与离子浓度的关系如图所示。下列说法正确的是
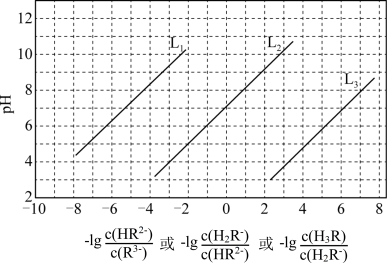

A.L1表示 pH与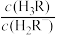 的关系曲线 的关系曲线 |
| B.NaH2R溶液呈酸性 |
| C.电离常数[Ka1(H3R)]的数量级为10-3 |
D.混合溶液的pH=7时,存在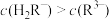 |
您最近一年使用:0次
解题方法
7 . 某兴趣小组利用氢离子交换树脂吸附溶液中其他阳离子,同时交换出氢离子的特性(如图所示),设计了测定 溶度积常数的实验。准确量取
溶度积常数的实验。准确量取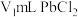 饱和溶液于烧杯中,加入过量的阳离子交换树脂,充分搅拌,静置,过滤,使用蒸馏水洗涤离子交换树脂至洗涤液呈中性,合并滤液和洗涤液至锥形瓶,用滴定法测定锥形瓶中氢离子的物质的量,计算出
饱和溶液于烧杯中,加入过量的阳离子交换树脂,充分搅拌,静置,过滤,使用蒸馏水洗涤离子交换树脂至洗涤液呈中性,合并滤液和洗涤液至锥形瓶,用滴定法测定锥形瓶中氢离子的物质的量,计算出 溶度积常数。(
溶度积常数。(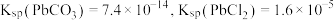 )
)

(1)下列仪器中,本实验用不到的有___________ (写名称)。
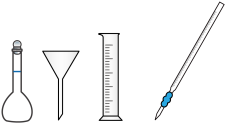
(2)配制 饱和溶液时需要使用煮沸后的蒸馏水,原因是
饱和溶液时需要使用煮沸后的蒸馏水,原因是___________ 。
(3)判断洗涤液已至中性的方法是___________ 。
(4)过滤后的溶液中发现有树脂小颗粒,此时应该___________ 。
(5)若实验使用的烧杯未干燥,测定结果___________ (填“偏高”,“偏低”或“不变”)。
(6)为了测定锥形瓶中氢离子的物质的量,使用浓度为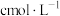 的氢氧化钠溶液进行滴定,可选用
的氢氧化钠溶液进行滴定,可选用___________ 为指示剂,滴定终点现象为___________ 。到达滴定终点时,消耗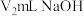 溶液,则
溶液,则 的
的
___________ (写出计算式)。
(7)兴趣小组对实验进行讨论,某同学提出可以利用该方法测定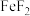 的
的 ,是否可行,原因是
,是否可行,原因是___________ 。
 溶度积常数的实验。准确量取
溶度积常数的实验。准确量取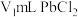 饱和溶液于烧杯中,加入过量的阳离子交换树脂,充分搅拌,静置,过滤,使用蒸馏水洗涤离子交换树脂至洗涤液呈中性,合并滤液和洗涤液至锥形瓶,用滴定法测定锥形瓶中氢离子的物质的量,计算出
饱和溶液于烧杯中,加入过量的阳离子交换树脂,充分搅拌,静置,过滤,使用蒸馏水洗涤离子交换树脂至洗涤液呈中性,合并滤液和洗涤液至锥形瓶,用滴定法测定锥形瓶中氢离子的物质的量,计算出 溶度积常数。(
溶度积常数。(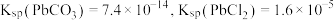 )
)
(1)下列仪器中,本实验用不到的有

(2)配制
 饱和溶液时需要使用煮沸后的蒸馏水,原因是
饱和溶液时需要使用煮沸后的蒸馏水,原因是(3)判断洗涤液已至中性的方法是
(4)过滤后的溶液中发现有树脂小颗粒,此时应该
(5)若实验使用的烧杯未干燥,测定结果
(6)为了测定锥形瓶中氢离子的物质的量,使用浓度为
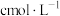 的氢氧化钠溶液进行滴定,可选用
的氢氧化钠溶液进行滴定,可选用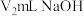 溶液,则
溶液,则 的
的
(7)兴趣小组对实验进行讨论,某同学提出可以利用该方法测定
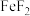 的
的 ,是否可行,原因是
,是否可行,原因是
您最近一年使用:0次
名校
解题方法
8 . 科学家合成了一种高温超导材料,其晶胞结构如图所示,该立方晶胞参数为 。设
。设 为阿伏加德罗常数的值。下列说法错误的是
为阿伏加德罗常数的值。下列说法错误的是
 。设
。设 为阿伏加德罗常数的值。下列说法错误的是
为阿伏加德罗常数的值。下列说法错误的是
A.晶体的最简化学式为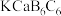 |
B.晶体中与 最近且距离相等的 最近且距离相等的 有4个 有4个 |
| C.晶胞中B和C原子构成的多面体有14个面 |
D.晶体的密度为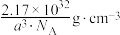 |
您最近一年使用:0次
2023-12-05更新
|
1186次组卷
|
4卷引用:专题04 物质结构与性质-【好题汇编】2024年高考化学一模试题分类汇编(新高考七省专用)
(已下线)专题04 物质结构与性质-【好题汇编】2024年高考化学一模试题分类汇编(新高考七省专用)(已下线)专题04 物质结构与性质 元素推断-【好题汇编】2024年高考化学一模试题分类汇编(全国通用)2024届天津市宁河区芦台第一中学高三下学期第三次模拟化学试题吉林省长春市2024届高三上学期质量监测(一)化学试题
9 . 低碳烯烃(乙烯、丙烯、丁烯等)作为重要的基本化工原料,在现代石油和化学工业中起着举足轻重的作用。一定条件下,碘甲烷(CH3I)热裂解制低碳烯烃的主要反应有:
反应Ⅰ 2CH3I(g) C2H4(g)+2HI(g) H1 Kp1=a
C2H4(g)+2HI(g) H1 Kp1=a
反应Ⅱ 3C2H4(g) 2C3H6(g) H2 Kp2=b
2C3H6(g) H2 Kp2=b
反应Ⅲ 2C2H4(g) C4H8(g) H3 Kp3=c
C4H8(g) H3 Kp3=c
反应I、II、III在不同温度下的分压平衡常数Kp如表1,回答下列问题:
表1
(1)△H1___________ 0(填“>”或“<”,下同)。
(2)实际工业生产中,若存在副反应: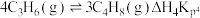 ,则 Kp4=
,则 Kp4=___________ (用含有b、c的代数式表达),结合表1数据分析△H4___________ 0。
(3)控制条件只发生反应I、II、III,测得压强对平衡体系中n(C3H6)/n(C2H4)的影响如表2。
随压强增大 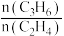 不断增大的原因可能是
不断增大的原因可能是___________ 。
(4)结合信息,请推测有利于提高乙烯产率的措施___________ 。
(5)其它条件不变,向容积为1L的密闭容器中投入1molCH3I(g),假定只发生反应I、II、III,温度对平衡体系中乙烯、丙烯和丁烯所占物质的量分数的影响如图,715K时CH3I(g)的平衡转化率为___________ ,反应Ⅰ以物质的量分数表示的平衡常数 Kx=___________ 。 表示阿伏加德罗常数的值,则晶胞中距离最近的两个Ga原子间距离为
表示阿伏加德罗常数的值,则晶胞中距离最近的两个Ga原子间距离为___________ nm(列出计算式)。
②图乙中掺杂Mn之后,晶体中Mn、Ga、As的原子个数比为___________ 。
反应Ⅰ 2CH3I(g)
 C2H4(g)+2HI(g) H1 Kp1=a
C2H4(g)+2HI(g) H1 Kp1=a反应Ⅱ 3C2H4(g)
 2C3H6(g) H2 Kp2=b
2C3H6(g) H2 Kp2=b反应Ⅲ 2C2H4(g)
 C4H8(g) H3 Kp3=c
C4H8(g) H3 Kp3=c反应I、II、III在不同温度下的分压平衡常数Kp如表1,回答下列问题:
表1
| T/Kp | 298K | 323K | 423K | 523K | 623K | 723K |
| 反应I | 7.77×10-8 | 1.65×10-6 | 1.05×10-2 | 2.80 | 1.41×10² | 2.64×10³ |
| 反应Ⅱ | 7.16×1013 | 2.33×1012 | 1.48×108 | 3.73×105 | 6.42×103 | 3.40×102 |
| 反应Ⅲ | 2.66×1011 | 6.04×109 | 1.40×105 | 1.94×102 | 2.24 | 8.99×10-2 |
(1)△H1
(2)实际工业生产中,若存在副反应:
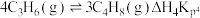 ,则 Kp4=
,则 Kp4=(3)控制条件只发生反应I、II、III,测得压强对平衡体系中n(C3H6)/n(C2H4)的影响如表2。
| p/MPa | 0.2 | 0.4 | 0.6 | 0.8 | 1.0 | 1.2 | 1.4 | 1.6 | 1.8 | 2.0 |
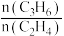 | 1.42 | 1.75 | 1.98 | 2.15 | 2.30 | 2.42 | 2.53 | 2.63 | 2.72 | 2.80 |
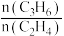 不断增大的原因可能是
不断增大的原因可能是(4)结合信息,请推测有利于提高乙烯产率的措施
(5)其它条件不变,向容积为1L的密闭容器中投入1molCH3I(g),假定只发生反应I、II、III,温度对平衡体系中乙烯、丙烯和丁烯所占物质的量分数的影响如图,715K时CH3I(g)的平衡转化率为
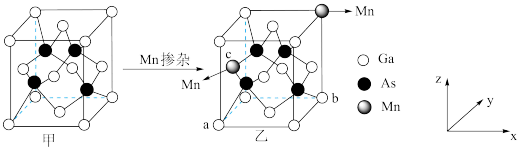
 表示阿伏加德罗常数的值,则晶胞中距离最近的两个Ga原子间距离为
表示阿伏加德罗常数的值,则晶胞中距离最近的两个Ga原子间距离为②图乙中掺杂Mn之后,晶体中Mn、Ga、As的原子个数比为
您最近一年使用:0次
解题方法
10 . K2Cr2O7溶液中存在多个平衡。在考虑平衡:① (aq) +H2O(l)
(aq) +H2O(l) 2
2 (aq) K1=3.0× 10-2(25°C);②
(aq) K1=3.0× 10-2(25°C);② (aq)
(aq)
 (aq) +H+(aq) K2=3.3× 10-7(25°C)的条件下,25°C时,向0.10 mol/L K2Cr2O7溶液中加入NaOH,溶液中
(aq) +H+(aq) K2=3.3× 10-7(25°C)的条件下,25°C时,向0.10 mol/L K2Cr2O7溶液中加入NaOH,溶液中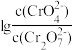 ,随pH的变化关系如图所示,溶液体积变化可忽略。下列说法中正确的是
,随pH的变化关系如图所示,溶液体积变化可忽略。下列说法中正确的是

 (aq) +H2O(l)
(aq) +H2O(l) 2
2 (aq) K1=3.0× 10-2(25°C);②
(aq) K1=3.0× 10-2(25°C);② (aq)
(aq)
 (aq) +H+(aq) K2=3.3× 10-7(25°C)的条件下,25°C时,向0.10 mol/L K2Cr2O7溶液中加入NaOH,溶液中
(aq) +H+(aq) K2=3.3× 10-7(25°C)的条件下,25°C时,向0.10 mol/L K2Cr2O7溶液中加入NaOH,溶液中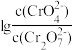 ,随pH的变化关系如图所示,溶液体积变化可忽略。下列说法中正确的是
,随pH的变化关系如图所示,溶液体积变化可忽略。下列说法中正确的是
| A.已知Ka1(H2SO3) = 1.29× 10-2,由②可知向K2CrO4溶液中通SO2可制得KHCrO4 |
B.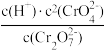 的值随溶液 pH的增大逐渐减小 的值随溶液 pH的增大逐渐减小 |
C.当溶液pH=9时,溶液中的 平衡浓度约为6 × 10-4mol/L 平衡浓度约为6 × 10-4mol/L |
D.当溶液pH=7时,c(K+) =c ( ) +c( ) +c(  ) +2c ( ) +2c ( ) ) |
您最近一年使用:0次



