2020·浙江·模拟预测
1 . 下列说法正确的是
| A.同一原子中,在离核较远的区域运动的电子能量较高 |
| B.原子核外电子排布,先排满K层再排L层、先排满M层再排N层 |
| C.同一周期中,随着核电荷数的增加,元素的原子半径逐渐增大 |
| D.同一周期中,ⅡA与ⅢA族元素原子的核电荷数都相差1 |
您最近一年使用:0次
2022-09-30更新
|
1498次组卷
|
46卷引用:天津市河东区2020届高三学业水平等级性考试模拟测试化学试题
天津市河东区2020届高三学业水平等级性考试模拟测试化学试题(已下线)浙江省2020年1月选考(学考)化学试题2020年浙江省高考化学试卷(1月选考)(已下线)第8单元 原子结构 元素周期律(B卷 滚动提升检测)-2021年高考化学一轮复习单元滚动双测卷广东省深圳外国语学校2021届高三第二次月考化学试题(人教版2019)选择性必修2 第一章 原子结构与性质 C高考挑战区(已下线)解密05 物质结构元素周期律(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)(已下线)解密05 物质结构元素周期律(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(已下线)课时26 元素周期表(律)及其应用-2022年高考化学一轮复习小题多维练(全国通用)(已下线)考点07 元素周期律和元素周期表-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点07 元素周期律和元素周期表-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)专题07.物质结构 元素周期律-十年(2012-2021)高考化学真题分项汇编(浙江专用)(已下线)解密05 物质结构 元素周期律(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)解密05 物质结构 元素周期律(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)(已下线)考点07 元素周期律和元素周期表-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)第09练 原子结构与元素周期表-2023年高考化学一轮复习小题多维练(全国通用)(已下线)第14讲 元素周期律和元素周期表(练)-2023年高考化学一轮复习讲练测(新教材新高考)广东省广州市执信中学2022-2023学年高三上学期第二次月考 化学试题(已下线)第36讲 原子结构与性质(练)-2023年高考化学一轮复习讲练测(全国通用)(已下线)专题八 物质结构与元素周期律-实战高考·二轮复习核心突破广东省广州市白云中学2023-2024学年高三上学期9月月考化学试题2024年江苏省常州市普通高中学业水平合格性考试适应性训练化学试题浙江省丽水市松阳县第二中学2019-2020学年高二4月线上教学检测化学试题鲁科版(新)必修第二册第一章检测题河南省洛阳市2019-2020学年高一下学期期末考试化学试题(已下线)【浙江新东方】50.山东省泰安肥城市2020-2021学年高一下学期期中考试化学试题河北省/唐山市第十一中学2020-2021学年高一下学期期中考试化学试题四川省内江市2020-2021学年高一下学期期末检测题化学(理)试题四川省资阳中学2021-2022学年高二上学期开学考试化学试题四川省遂宁市射洪中学2021—2022学年高二上学期第一次月考化学试题浙江省绍兴市诸暨中学2021-2022学年高二上学期期中考试(实验班)化学试题浙江省绍兴市诸暨中学2021-2022学年高二上学期期中考试(平行班)化学试题(已下线)第1.2.1讲 原子结构与元素周期表-2021-2022学年高二化学链接教材精准变式练(人教版2019选择性必修2)山西省晋城市第一中学2021-2022学年高二上学期第五次调研化学试题广东省云浮市云安区云安中学2021-2022学年高二下学期第一次统测化学试题(已下线)4.2.1 元素性质的周期性变化规律-2021-2022学年高一化学课后培优练(人教版2019必修第一册)广东省汕头市金山中学2021-2022学年高二上学期期末考试化学试题江苏省苏州市2021-2022学年高二上学期期末模块测评化学试题四川省南充市嘉陵第一中学2021-2022学年高二上学期第二次月考化学试题湖北省襄阳市第一中学2022-2023学年高二下学期3月月考化学试题四川省广安市第二中学校2022-2023学年高二下学期第一次月考化学试题安徽省合肥市第一中学 2022-2023 学年高一下学期第一次素质拓展训练化学试题浙江省杭州市周边四校2022-2023学年高二上学期期末联考化学试题浙江省湖州市吴兴高级中学2023-2024学年高一上学期12月月考化学试题甘肃省酒泉市实验中学2023-2024学年高二下学期3月月考化学试卷
解题方法
2 . 完成下列填空:
(1)研究发现,在 低压合成甲醇反应(
低压合成甲醇反应(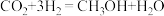 )中,Co氧化物负载的Mn氧化物纳米粒子催化剂具有高活性,显示出良好的应用前景。Co基态原子核外电子排布式为
)中,Co氧化物负载的Mn氧化物纳米粒子催化剂具有高活性,显示出良好的应用前景。Co基态原子核外电子排布式为_______ ;元素Mn与O中,第一电离能较大的是_______ ,基态原子核外未成对电子数较多的是_______ 。
(2)我国科学家成功合成了世界上首个五氮阴离子盐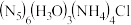 。
。
①氮原子的价电子轨道表示式为_______ ;
②元素的基态气态原子得到一个电子形成气态负一价离子时所放出的能量称作第一电子亲和能 。第二周期部分元素的
。第二周期部分元素的 变化趋势如图所示:
变化趋势如图所示:
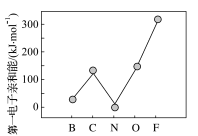
其中除氮元素外,其他元素的 自左而右依次增大的原因是
自左而右依次增大的原因是_______ ;氮元素的 呈现异常的原因是
呈现异常的原因是_______ 。
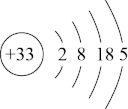
(3)已知As元素的相关信息如图所示,下列说法不正确的是_______
(4) 的结构中Se为面心立方最密堆积,晶胞结构如图所示。
的结构中Se为面心立方最密堆积,晶胞结构如图所示。

① 中Mn的配位数为
中Mn的配位数为_______ ;
②若该晶体的晶胞参数为apm,阿伏加德罗常数的值为NA,则距离最近的两个锰原子之间的距离为_______ pm; 的密度
的密度
____  (列出表达式即可)。
(列出表达式即可)。
(1)研究发现,在
 低压合成甲醇反应(
低压合成甲醇反应(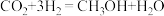 )中,Co氧化物负载的Mn氧化物纳米粒子催化剂具有高活性,显示出良好的应用前景。Co基态原子核外电子排布式为
)中,Co氧化物负载的Mn氧化物纳米粒子催化剂具有高活性,显示出良好的应用前景。Co基态原子核外电子排布式为(2)我国科学家成功合成了世界上首个五氮阴离子盐
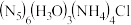 。
。①氮原子的价电子轨道表示式为
②元素的基态气态原子得到一个电子形成气态负一价离子时所放出的能量称作第一电子亲和能
 。第二周期部分元素的
。第二周期部分元素的 变化趋势如图所示:
变化趋势如图所示:
其中除氮元素外,其他元素的
 自左而右依次增大的原因是
自左而右依次增大的原因是 呈现异常的原因是
呈现异常的原因是(3)已知As元素的相关信息如图所示,下列说法不正确的是_______

| A.推测As能形成多种氧化物 |
B.热稳定性: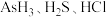 逐渐增强 逐渐增强 |
C.As的一种核素表示为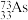 ,中子数为40 ,中子数为40 |
| D.原子半径由大到小的顺序:As、Cl、Si |
 的结构中Se为面心立方最密堆积,晶胞结构如图所示。
的结构中Se为面心立方最密堆积,晶胞结构如图所示。
①
 中Mn的配位数为
中Mn的配位数为②若该晶体的晶胞参数为apm,阿伏加德罗常数的值为NA,则距离最近的两个锰原子之间的距离为
 的密度
的密度
 (列出表达式即可)。
(列出表达式即可)。
您最近一年使用:0次
解题方法
3 . 化学与生产、生活、科技、环境等关系密切。下列说法正确的是
A.汽车尾气催化转化器可有效减少 ,的排放,实现“碳中和” ,的排放,实现“碳中和” |
| B.制造焊锡时,把铅加入锡,形成原电池,从而增加锡的抗腐蚀能力 |
| C.2022年冬奥会衣物采用石墨烯纺织物柔性发热材料,石墨烯属于原子晶体 |
| D.硅酸钠的水溶液俗名为水玻璃,可用于制备硅胶和木材防火剂 |
您最近一年使用:0次
名校
4 . 下列对装置或仪器的使用或操作规范的是
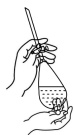 | 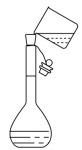 |  | 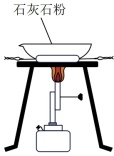 |
| A.振荡分液漏斗中混合液 | B.向容量瓶中转移溶液 | C.称量5.1g固体 | D.煅烧石灰石 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2022-08-23更新
|
257次组卷
|
4卷引用:天津市2023届普通高中学业水平等级性考试模拟化学试题
名校
解题方法
5 . 用还原法可以将硝酸厂烟气中的大量氮氧化物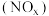 转化为无害物质。常温下,将NO与
转化为无害物质。常温下,将NO与 的混合气体通入
的混合气体通入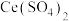 与
与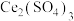 的混合溶液中,其物质的转化过程如图所示。下列说法错误的是
的混合溶液中,其物质的转化过程如图所示。下列说法错误的是

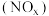 转化为无害物质。常温下,将NO与
转化为无害物质。常温下,将NO与 的混合气体通入
的混合气体通入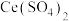 与
与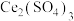 的混合溶液中,其物质的转化过程如图所示。下列说法错误的是
的混合溶液中,其物质的转化过程如图所示。下列说法错误的是
A.反应Ⅱ的离子方程式为 |
B.反应Ⅰ中氧化剂与还原剂的物质的量之比为 |
C. 为该转化过程的中间产物 为该转化过程的中间产物 |
D.反应前后溶液中 和 和 的总数保持不变 的总数保持不变 |
您最近一年使用:0次
2022-08-22更新
|
394次组卷
|
4卷引用:天津市2023届普通高中学业水平等级性考试模拟化学试题
名校
解题方法
6 . 常温下,下列各组离子在指定溶液中一定能大量共存的是
A.pH=12的溶液中: 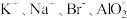 |
B.c(OH-)/c(H+)=10-12的溶液中: 、Cu2+、 、Cu2+、 、 、 |
C.滴加KSCN溶液显红色的溶液中:NH 、K+、Cl-、I- 、K+、Cl-、I- |
| D.水电离的c(OH−)=1×10−13mol·L-1的溶液中:K+、Cl-、CH3COO-、Cu2+ |
您最近一年使用:0次
2022-08-13更新
|
1379次组卷
|
11卷引用:天津市2023届普通高中学业水平等级性考试模拟化学试题
天津市2023届普通高中学业水平等级性考试模拟化学试题天津市天津外国语大学附属外国语学校2022-2023学年高三上学期期末线上质量监测化学试题吉林省吉林市2021届高三上学期第一次调研考试化学试题甘肃省天水市第一中学2021-2022高三上学期第三次考试化学试题山东省青岛市2023届高三上学期模拟考试化学试题(已下线)专题04 离子反应山东省青岛市第二中学2022-2023学年高二上学期期末考试化学试题山东省泰安第一中学2023-2024学年高二上学期12月月考化学试题辽宁省葫芦岛市普通高中2023-2024学年高二上学期学业质量监测考试化学试题吉林省通化市梅河口市博文学校2022-2023学年高二下学期期末考试化学试题内蒙古赤峰实验中学2023-2024学年高二下学期开学化学试题
解题方法
7 . 下列操作能达到目的的是
| 选项 | 操作 | 目的 |
| A | 向10 mL0.1 mol·L-1草酸溶液中先滴加1 mL0.1 mol·L-1KMnO4溶液,再滴加1 mL 0.2 mol·L-1KMnO4溶液 | 探究浓度对反应速率的影响 |
| B | 分别用pH计测定0.1 mol·L-1的HOCH2COOH溶液在25 °C、45 °C时的pH(浓度变化不考虑) | 探究温度对电离平衡的影响 |
| C | 将铁、铜片插入浓硝酸(常温)构成原电池,并连接电流计 | 验证原电池中较活泼金属为负极 |
| D | 向物质的量浓度均为1 mol·L-1的Na2CO3和Na2SO4混合液中加入等体积的过量AgNO3溶液 | 探究 Ag2CO3和Ag2SO4溶度积的大小 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2022-07-15更新
|
948次组卷
|
4卷引用:天津市2023届普通高中学业水平等级性考试模拟化学试题
名校
解题方法
8 . 下列说法不正确 的是
| A.棉短绒中的纤维素可在铜氨溶液中溶解,将形成的溶液压入酸中可得到质量更高的纤维 |
| B.用纸层析法分离Fe3+和Cu2+,将滤纸上的试样点完全浸入展开剂可提高分离效果 |
| C.实验室制备阿司匹林过程中加入饱和NaHCO3溶液的主要目的是除去水杨酸 |
| D.将CoCl2•6H2O晶体溶于95%乙醇,逐滴滴加蒸馏水,溶液颜色由蓝色逐渐转变为粉红色 |
您最近一年使用:0次
2022-06-25更新
|
1101次组卷
|
3卷引用:天津市2023届普通高中学业水平等级性考试模拟化学试题
解题方法
9 . 乙酸硅[ (CH3COO)4Si,熔点:110°C,沸点:148°C]是白色至米色晶体。某校同学设计实验先制备SiCl4(熔点:-70℃,沸点:57.6℃,极易水解),再由SiCl4与乙酸酐[(CH3CO)2O(熔点:-73℃,沸点:140℃反应制备乙酸硅。回答下列问题:
(1)制备SiCl4装置(部分夹持仪器已省路)如下:
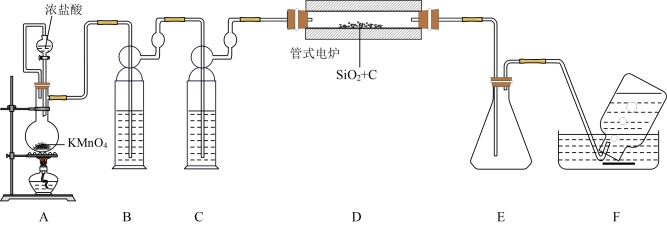
①A中制取Cl2反应的离子方程式为_______ 。
②B中盛放的试剂是_______ 。
③F中收集到的气体是CO,制备SiCl4的化学方程式为_______ 。
④上述设计的装置有一处明显不妥,改进的方法是_______ 。
(2)制备(CH3COO)4Si的反应装置如图所示。将一定量的SiCl4放入仪器a中,在电磁搅拌下,由滴液漏斗滴入过量的乙酸酐,关闭活塞。SiCl4和(CH3CO)2O的反应为放热反应,反应后反应混合物带色,并开始析出(CH3COO)4Si晶体。
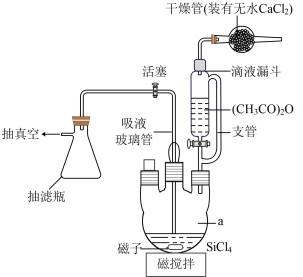
①仪器a的名称为_______ ;图中支管的作用是_______ 。
②写出生成(CH3COO)4Si的化学方程式:_______ (生成物有两种)。
③完成反应后,将反应混合液放置数日,再用干冰-丙酮浴冷却后,将导管伸入液面以下,_______ (结合装置图填写操作),获得(CH3COO)4Si晶体粗品,若得到较纯 (CH3COO)4Si,则下一步操作为_______ 。
(1)制备SiCl4装置(部分夹持仪器已省路)如下:

①A中制取Cl2反应的离子方程式为
②B中盛放的试剂是
③F中收集到的气体是CO,制备SiCl4的化学方程式为
④上述设计的装置有一处明显不妥,改进的方法是
(2)制备(CH3COO)4Si的反应装置如图所示。将一定量的SiCl4放入仪器a中,在电磁搅拌下,由滴液漏斗滴入过量的乙酸酐,关闭活塞。SiCl4和(CH3CO)2O的反应为放热反应,反应后反应混合物带色,并开始析出(CH3COO)4Si晶体。

①仪器a的名称为
②写出生成(CH3COO)4Si的化学方程式:
③完成反应后,将反应混合液放置数日,再用干冰-丙酮浴冷却后,将导管伸入液面以下,
您最近一年使用:0次
2022-06-10更新
|
593次组卷
|
2卷引用:天津市2023届普通高中学业水平等级性考试模拟化学试题
10 . 设NA为阿伏加德罗常数的值。下列说法 正确的是
| A.44.8 L丙烯和44.8 L丙烷中含有的碳原子数均为6NA |
| B.将1mol明矾完全溶于水,所得溶液中阴离子总数小于2NA |
| C.12.8g铜完全溶于未知浓度的硝酸中,转移的电子数为0.4NA |
D.1 mol苯乙烯(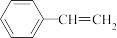 )与足量H2在催化剂和加热条件下反应,形成C- H键的数目最多为2 NA )与足量H2在催化剂和加热条件下反应,形成C- H键的数目最多为2 NA |
您最近一年使用:0次
2022-06-09更新
|
867次组卷
|
2卷引用:天津市2023届普通高中学业水平等级性考试模拟化学试题



