解题方法
1 . 有机玻璃(聚甲基丙烯酸甲酯)可按下列路线合成:
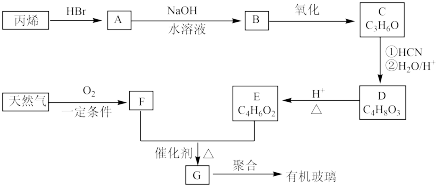
已知:C的核磁共振氢谱只有一组峰。回答下列问题:
(1)A的化学名称为_______ ,D的结构简式为_______ 。
(2)B→C的反应试剂及条件为_______ 。
(3)丙烯→A和A→B的反应类型分别属于_______ 、_______ 。
(4)E和F生成G的化学方程式为_______ 。
(5)满足下列条件的E的同分异构体的数目为_______ 种。(考虑立体异构)
①能发生银镜反应和水解反应
②不含环状结构

已知:C的核磁共振氢谱只有一组峰。回答下列问题:
(1)A的化学名称为
(2)B→C的反应试剂及条件为
(3)丙烯→A和A→B的反应类型分别属于
(4)E和F生成G的化学方程式为
(5)满足下列条件的E的同分异构体的数目为
①能发生银镜反应和水解反应
②不含环状结构
您最近一年使用:0次
解题方法
2 . 新型材料在生活和工业生产中有着广泛的应用。
(1)聚氯化硫(SN)x是重要的超导材料,目前已成为全球材料行业研究的热点。
①下列电子排布图能表示氮原子的最低能量状态的是_______ (填字母)。
A. B.
B. 
C. D.
D. 
②基态S原子的原子核外有_______ 种空间运动状态不同的电子,其能量最高的电子的电子云轮廓图为_______ 形。
(2)离子液体熔点很低,常温下呈液态,阴阳离子可自由移动,因此离子液体在电池中可作为_______ ,某离子液体的结构如图所示,其中碳原子杂化方式为_______ ,该离子液体中阴离子 的空间构型为
的空间构型为_______ ,已知其阳离子的环状结构中含有大π键,该大π键应表示为_______ 。

(3)硅酸盐是地壳岩石的主要成分,硅酸盐的阴离子结构丰富多样,既有有限数目的硅氧四面体构建的简单阴离子,也有以硅氧四面体为结构单元构成一维、二维、三维无限伸展的共价键骨架。图a表示硅酸根的阴离子的化学式为_______ ,图b无限长链的硅酸根中硅氧原子数目之比为_______ 。

(○硅原子在上氧原子在下 硅原子在下氧原子在上)
硅原子在下氧原子在上)
(1)聚氯化硫(SN)x是重要的超导材料,目前已成为全球材料行业研究的热点。
①下列电子排布图能表示氮原子的最低能量状态的是
A.
 B.
B. 
C.
 D.
D. 
②基态S原子的原子核外有
(2)离子液体熔点很低,常温下呈液态,阴阳离子可自由移动,因此离子液体在电池中可作为
 的空间构型为
的空间构型为
(3)硅酸盐是地壳岩石的主要成分,硅酸盐的阴离子结构丰富多样,既有有限数目的硅氧四面体构建的简单阴离子,也有以硅氧四面体为结构单元构成一维、二维、三维无限伸展的共价键骨架。图a表示硅酸根的阴离子的化学式为

(○硅原子在上氧原子在下
 硅原子在下氧原子在上)
硅原子在下氧原子在上)
您最近一年使用:0次
解题方法
3 . 游离态氮称为惰性氮,游离态氮转化为化合态氮称之为氮的活化,在氮的循环系统中,氮的过量“活化”会导致氮向大气和水体过量迁移,氮的循环平衡被打破,导致全球环境问题。
已知:SO2、CO、NH3等都可以催化还原氮氧化物生成惰性氮。
在25℃,101kPa时,
a.
b.
c.
(1)结合以上热化学方程式,写出NO与NH3反应生成惰性氮的热化学方程式_______ 。
(2)工业合成氨是氮的活化重要途径之一,在一定条件下,将N2和H2通入到体积为1L的恒容容器中,下列说法能说明该可逆反应达到平衡状态的是_______(填字母)。
(3)在合成氨工业中,为提高化学反应速率并提高原料的平衡转化率可采取的措施为_____(填字母)。
(4)在有氧条件下,新型催化剂M能催化CO与 反应生成N2,该反应的方程式为
反应生成N2,该反应的方程式为 。
。
①现向某密闭容器中充入等物质的量浓度的 和CO气体,维持恒温恒容,在催化剂作用下发生反应。相关数据如下:
和CO气体,维持恒温恒容,在催化剂作用下发生反应。相关数据如下:
在0~5min内,以CO2的浓度变化表示的反应速率为_______ mol/(L·min),在10min时,CO的转化率为_______ 。此温度下,该反应的化学平衡常数K=_______ (保留两位有效数字)。
②该反应的正、逆反应的平衡常数(K)与温度(T)的关系如图所示,其中表示正反应的平衡常数(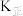 )的是
)的是_______ (填“A”或“B”),原因是_______ 。
已知:SO2、CO、NH3等都可以催化还原氮氧化物生成惰性氮。
在25℃,101kPa时,
a.

b.

c.

(1)结合以上热化学方程式,写出NO与NH3反应生成惰性氮的热化学方程式
(2)工业合成氨是氮的活化重要途径之一,在一定条件下,将N2和H2通入到体积为1L的恒容容器中,下列说法能说明该可逆反应达到平衡状态的是_______(填字母)。
| A.容器中气体密度不变 | B. |
| C.容器中压强不变 | D.N2、H2、NH3分子数之比为1:3:2 |
| A.升高温度 | B.将氨液化从体系中分离 |
| C.加入催化剂 | D.增大压强 |
 反应生成N2,该反应的方程式为
反应生成N2,该反应的方程式为 。
。①现向某密闭容器中充入等物质的量浓度的
 和CO气体,维持恒温恒容,在催化剂作用下发生反应。相关数据如下:
和CO气体,维持恒温恒容,在催化剂作用下发生反应。相关数据如下:| 0min | 5min | 10min | 15min | 20min | |
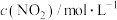 | 2.0 | 1.7 | 1.56 | 1.5 | 1.5 |
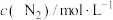 | 0 | 0.15 | 0.22 | 0.25 | 0.25 |
②该反应的正、逆反应的平衡常数(K)与温度(T)的关系如图所示,其中表示正反应的平衡常数(
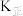 )的是
)的是
您最近一年使用:0次
4 . 溴及其化合物在医药、农药、燃料和阻燃剂等的生产中有广泛应用。目前,人们主要从海水和盐湖水中提取溴。工业上常用的一种海水提取溴的流程如下:

I.回答下列问题:
(1)向淡化海水中通入氯气时,同时加入酸的作用是_______ 。
(2)X为一种常见的大气污染物,写出吸收塔中发生反应的化学方程式_______ 。
(3)设备Y的名称为_______ ,若去除吹出和吸收的步骤,可能带来的问题是_______ 。
II.某化学课外小组在实验室中模拟上述流程,回答下列问题:
(4)用蒸馏法模拟海水淡化过程中,不需要用到的仪器有_______ (填序号)。
①漏斗②直形冷凝管③蒸馏烧瓶④玻璃棒⑤球形冷凝管⑥锥形瓶
(5)实验室制取纯净的氯气的装置如下图:
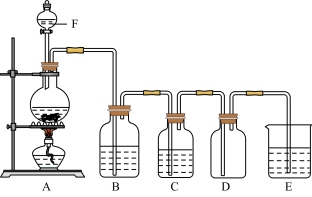
①仪器F的名称为_______ ,装置C中的试剂为_______ 。
②E中发生反应的离子方程式为_______ 。
③若使用足量MnO2与50mL12mol/LHCl反应,充分反应后测得生成Cl2的物质的量小于0.15mol,可能的原因为_______ 。

I.回答下列问题:
(1)向淡化海水中通入氯气时,同时加入酸的作用是
(2)X为一种常见的大气污染物,写出吸收塔中发生反应的化学方程式
(3)设备Y的名称为
II.某化学课外小组在实验室中模拟上述流程,回答下列问题:
(4)用蒸馏法模拟海水淡化过程中,不需要用到的仪器有
①漏斗②直形冷凝管③蒸馏烧瓶④玻璃棒⑤球形冷凝管⑥锥形瓶
(5)实验室制取纯净的氯气的装置如下图:

①仪器F的名称为
②E中发生反应的离子方程式为
③若使用足量MnO2与50mL12mol/LHCl反应,充分反应后测得生成Cl2的物质的量小于0.15mol,可能的原因为
您最近一年使用:0次
名校
解题方法
5 . 25℃时,向20mL0.1mol/LH2R(二元弱酸)溶液中滴加0.1mol/LNaOH溶液,溶液pH与加入NaOH溶液体积的关系如图所示。下列说法正确的是


A.a点对应的溶液中: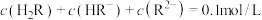 |
B.b点对应的溶液中: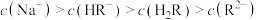 |
| C.a、b、c、d四点中,d点对应的溶液中水的电离程度最大 |
D.a、b、c、d各点溶液中均有: |
您最近一年使用:0次
2022-08-24更新
|
388次组卷
|
5卷引用:黑龙江省哈尔滨市2022-2023学年高三上学期学业质量监测化学试题
黑龙江省哈尔滨市2022-2023学年高三上学期学业质量监测化学试题(已下线)河南省湘豫名校2023届高三下学期第一次模拟化学试题变式题(选择题11-13)四川省泸县第四中学2022-2023学年高二上学期期末考试化学试题重庆市铜梁一中等三校2022-2023学年高二上学期期末考试化学试题湖南省 邵阳市第二中学2023-2024学年高二上学期1月期末化学试题
解题方法
6 . 铅酸电池是一种可充电电池,其放电时的总反应为:Pb+PbO2+2H2SO4=2PbSO4+2H2O。如图所示,利用铅酸电池电解Na2SO4溶液(a、b均为石墨电极),可以制得H2、O2较浓的H2SO4和NaOH溶液。下列说法不正确的是


| A.铅酸电池放电一段时间后,正、负极的质量均增加 |
| B.M和N溶液分别为稀H2SO4和稀NaOH溶液 |
| C.a电极的电极反应式为2H2O+2e-=H2↑+2OH- |
| D.当电路中有1 mol电子通过时,b电极收集到的O2体积为5.6 L |
您最近一年使用:0次
解题方法
7 . 下列实验误差分析不正确的是
| A.配制一定物质的量浓度的溶液定容时俯视容量瓶刻度线,所配溶液浓度偏大 |
| B.用湿润的pH试纸测某酸雨样品的pH,所测pH数值偏大 |
| C.测定中和反应的反应热时,将碱缓慢倒入酸中,所测温度值偏低 |
| D.滴定前滴定管尖嘴内有气泡,终点读数时气泡消失,所测体积偏小 |
您最近一年使用:0次
解题方法
8 . 物质的类别和核心元素的化合价是研究物质性质的重要视角。部分含S物质的价类二维图如下,下列推断不正确的是


| A.d的浓溶液可用于干燥c,但不可用于干燥a |
| B.b难溶于水,微溶于酒精,易溶于CS2 |
| C.金属冶炼时产生的c,工业上可用于制备d |
| D.a和c反应可生成b,氧化产物与还原产物质量之比为1:2 |
您最近一年使用:0次
名校
解题方法
9 . 已知X、Y、Z、W、M是同一短周期的五种主族元素。单质W3具有强氧化性,可用于杀菌消毒。五种元素组成的盐是一种新型电池的电解质,结构如图所示。下列说法正确的是
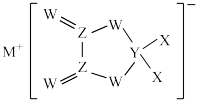

| A.原子半径:Y>Z>W>X>M |
| B.最高价氧化物水化物的酸性:Y>Z |
| C.简单气态氢化物的稳定性:W>X |
| D.阴离子中四种元素的原子均满足8电子稳定结构 |
您最近一年使用:0次
2022-08-24更新
|
311次组卷
|
2卷引用:黑龙江省哈尔滨市2022-2023学年高三上学期学业质量监测化学试题
10 . 下列图示实验方案能达到相应实验目的的是
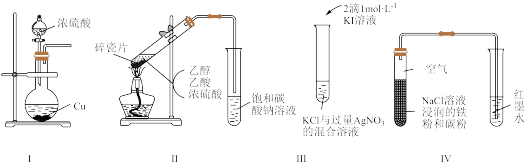

| A.用图I验证浓硫酸的强氧化性 |
| B.用图II制取乙酸乙酯 |
C.用图III证明AgI的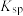 小于AgCl 小于AgCl |
| D.用图IV验证铁粉发生了析氢腐蚀 |
您最近一年使用:0次



