名校
1 . 空气污染物NO通常用含 的溶液吸收,生成
的溶液吸收,生成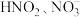 ,再利用电解法将上述吸收液中的
,再利用电解法将上述吸收液中的 转化为无毒物质,同时生成
转化为无毒物质,同时生成 ,其原理如图所示。下列说法正确的是
,其原理如图所示。下列说法正确的是
 的溶液吸收,生成
的溶液吸收,生成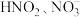 ,再利用电解法将上述吸收液中的
,再利用电解法将上述吸收液中的 转化为无毒物质,同时生成
转化为无毒物质,同时生成 ,其原理如图所示。下列说法正确的是
,其原理如图所示。下列说法正确的是
A. 由右室进入左室 由右室进入左室 |
B. 从电解槽的c口流出,且可循环使用 从电解槽的c口流出,且可循环使用 |
C.阴极的电极反应式: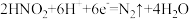 |
D.若用甲烷燃料电池作为电源,当消耗33.6L甲烷时,理论上可转化 |
您最近一年使用:0次
名校
2 . 某学习小组欲利用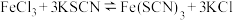 平衡体系探究影响平衡的因素,将
平衡体系探究影响平衡的因素,将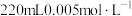
 溶液和
溶液和 溶液混合,得血红色溶液X,进行下列实验:
溶液混合,得血红色溶液X,进行下列实验:
实验Ⅰ.改变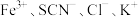 等离子浓度对平衡的影响
等离子浓度对平衡的影响
(1)取2mL溶液X,加入5滴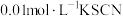 溶液,溶液红色
溶液,溶液红色_______ (填“变深”、“变浅”或“不变”,下同):取2mL溶液X,插入经砂纸打磨过的铁丝,溶液红色_______ 。
(2)取2mL溶液X,加入5滴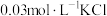 溶液,观察到溶液红色变浅,产生该现象的原因可能是
溶液,观察到溶液红色变浅,产生该现象的原因可能是_______ 或者不直接参与平衡体系的 或
或 对平衡产生了影响。
对平衡产生了影响。
实验Ⅱ.探究KCl对平衡体系的影响,为了确定KCl是否对平衡产生影响,学习小组同学进行如下探究:各取2mL溶液X放入3支比色皿中,分别滴加5滴不同浓度的KCl溶液,并测定各溶液的透射率随时间的变化(已知溶液颜色越深,透射率越小),结果如图所示。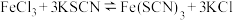 平衡有影响,且KCl浓度越大,影响
平衡有影响,且KCl浓度越大,影响_______ ,二是_______ 。
(4)针对产生上述影响的可能原因,学习小组同学提出以下猜想:
猜想①: 产生的影响。
产生的影响。
猜想②: 产生的影响。
产生的影响。
猜想③:_______ 。
实验Ⅲ.探究盐对 和
和 平衡体系产生的影响
平衡体系产生的影响
资料信息:
a.溶液中的离子会受到周围带有异性电荷离子的屏蔽,使该离子的有效浓度降低,这种影响称为盐效应。
b.在 溶液中存在反应
溶液中存在反应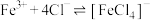 。
。
(5)根据上述信息,学习小组同学各取2mL溶液X,分别加入5滴①去离子水、②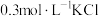 溶液、溶液、③
溶液、溶液、③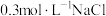 溶液、④
溶液、④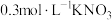 溶液、⑤
溶液、⑤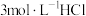 溶液进行实验,测得各溶液的透射率随时间的变化如图所示。
溶液进行实验,测得各溶液的透射率随时间的变化如图所示。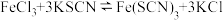 平衡体系的实验组是
平衡体系的实验组是____ ,盐效应影响较大的阳离子是_______ 。
A.实验①②③ B.实验①②④ C.实验①③④
(6)解释出现实验⑤现象的原因:_______ 。
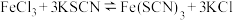 平衡体系探究影响平衡的因素,将
平衡体系探究影响平衡的因素,将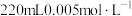
 溶液和
溶液和 溶液混合,得血红色溶液X,进行下列实验:
溶液混合,得血红色溶液X,进行下列实验:实验Ⅰ.改变
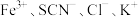 等离子浓度对平衡的影响
等离子浓度对平衡的影响(1)取2mL溶液X,加入5滴
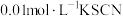 溶液,溶液红色
溶液,溶液红色(2)取2mL溶液X,加入5滴
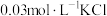 溶液,观察到溶液红色变浅,产生该现象的原因可能是
溶液,观察到溶液红色变浅,产生该现象的原因可能是 或
或 对平衡产生了影响。
对平衡产生了影响。实验Ⅱ.探究KCl对平衡体系的影响,为了确定KCl是否对平衡产生影响,学习小组同学进行如下探究:各取2mL溶液X放入3支比色皿中,分别滴加5滴不同浓度的KCl溶液,并测定各溶液的透射率随时间的变化(已知溶液颜色越深,透射率越小),结果如图所示。
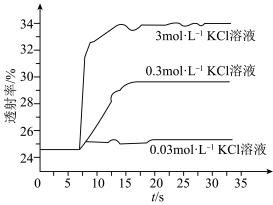
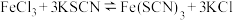 平衡有影响,且KCl浓度越大,影响
平衡有影响,且KCl浓度越大,影响(4)针对产生上述影响的可能原因,学习小组同学提出以下猜想:
猜想①:
 产生的影响。
产生的影响。猜想②:
 产生的影响。
产生的影响。猜想③:
实验Ⅲ.探究盐对
 和
和 平衡体系产生的影响
平衡体系产生的影响资料信息:
a.溶液中的离子会受到周围带有异性电荷离子的屏蔽,使该离子的有效浓度降低,这种影响称为盐效应。
b.在
 溶液中存在反应
溶液中存在反应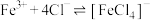 。
。(5)根据上述信息,学习小组同学各取2mL溶液X,分别加入5滴①去离子水、②
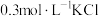 溶液、溶液、③
溶液、溶液、③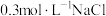 溶液、④
溶液、④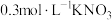 溶液、⑤
溶液、⑤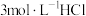 溶液进行实验,测得各溶液的透射率随时间的变化如图所示。
溶液进行实验,测得各溶液的透射率随时间的变化如图所示。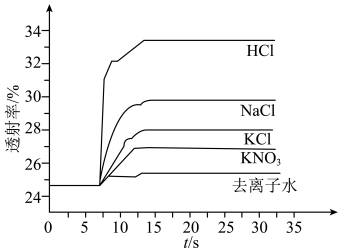
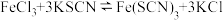 平衡体系的实验组是
平衡体系的实验组是A.实验①②③ B.实验①②④ C.实验①③④
(6)解释出现实验⑤现象的原因:
您最近一年使用:0次
名校
3 . 金属及其化合物广泛应用于生产、生活、国防等多个领域。回答下列问题:
(1)基态Cu原子的价层电子轨道表示式为_______ 。
(2)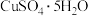 简单的平面结构如图,则该晶体的化学式应表示为
简单的平面结构如图,则该晶体的化学式应表示为_______ 。_______ (填标号)。
a.离子键 b.氢键 c.非极性共价键 d.极性共价键
(4)水分子①的键角_______ 104.5°(填“大于”、“小于”或“等于”),原因为_______ 。
(5)金属Hf溴化物离子八面体钾盐晶胞结构如图,化学式为_______ ,已知晶胞参数为anm,则该晶体的密度为_______  (设
(设 为阿伏加德罗常数的值,该化合物摩尔质量为Mg/mol)。
为阿伏加德罗常数的值,该化合物摩尔质量为Mg/mol)。
(1)基态Cu原子的价层电子轨道表示式为
(2)
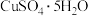 简单的平面结构如图,则该晶体的化学式应表示为
简单的平面结构如图,则该晶体的化学式应表示为
a.离子键 b.氢键 c.非极性共价键 d.极性共价键
(4)水分子①的键角
(5)金属Hf溴化物离子八面体钾盐晶胞结构如图,化学式为
 (设
(设 为阿伏加德罗常数的值,该化合物摩尔质量为Mg/mol)。
为阿伏加德罗常数的值,该化合物摩尔质量为Mg/mol)。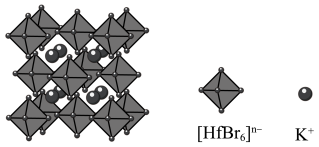
您最近一年使用:0次
名校
4 . 下列根据实验方案设计及现象得出结论错误的是
| 选项 | 实验设计及现象 | 结论 |
| A | 往碘的 溶液中加入等体积浓KI溶液,振荡。溶液分层,下层紫红色变浅粉红色,上层呈棕黄色 溶液中加入等体积浓KI溶液,振荡。溶液分层,下层紫红色变浅粉红色,上层呈棕黄色 | 碘在浓KI溶液中溶解能力大于在 中溶解能力 中溶解能力 |
| B | 有机物A加入NaOH乙醇溶液中,充分加热:冷却后,取混合液加足量硝酸酸化,滴加硝酸银溶液,未产生白色沉淀 | 有机物A不可能是氯代烃 |
| C | 向 溶液中,先加NaOH溶液调节 溶液中,先加NaOH溶液调节 ,有红褐色沉淀生成,再加入足量的KSCN溶液,沉淀不溶解 ,有红褐色沉淀生成,再加入足量的KSCN溶液,沉淀不溶解 | 在 时, 时, 结合 结合 的能力比 的能力比 强 强 |
| D | 常温下,用pH计分别测定浓度均为 的KCl溶液和 的KCl溶液和 溶液的pH,测得pH均为7.0 溶液的pH,测得pH均为7.0 | 但两溶液中水的电离程度不相同 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
5 . 设 为阿伏加德罗常数的值。下列说法正确的是
为阿伏加德罗常数的值。下列说法正确的是
 为阿伏加德罗常数的值。下列说法正确的是
为阿伏加德罗常数的值。下列说法正确的是A.0.1mol 固体与足量的 固体与足量的 充分反应,转移 充分反应,转移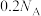 个电子 个电子 |
B.1mol 中含有 中含有 键的数目约为 键的数目约为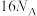 |
C.1L0.1mol/L 酸性溶液中所含 酸性溶液中所含 的数目为 的数目为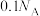 |
D.0.05mol/L的 溶液中含有 溶液中含有 的数目为 的数目为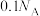 |
您最近一年使用:0次
名校
解题方法
6 .  、
、 是新型磁性材料的成分,设
是新型磁性材料的成分,设 为阿伏加德罗常数的值,依据其中有关元素回答问题:
为阿伏加德罗常数的值,依据其中有关元素回答问题:
(1)钕(Nd)属于镧系元素,则其在元素周期表中处于___________ 区, 的价电子排布图为
的价电子排布图为___________ 。
(2) 的立体构型为
的立体构型为___________ ;F原子核外有___________ 种不同空间运动状态的电子。
(3) 是一种还原剂,B原子的杂化方式为
是一种还原剂,B原子的杂化方式为___________ 。该物质中是否存在配位键___________ (填“是”或“否”)。
(4) 的钙钛矿型晶胞结构如图所示,其中Co填充在F形成的正八面体中心。
的钙钛矿型晶胞结构如图所示,其中Co填充在F形成的正八面体中心。___________ 。
②该晶体密度为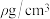 ,则K和Co之间的最短距离为
,则K和Co之间的最短距离为___________ pm。
(5) 的制备:称取研细的
的制备:称取研细的 和
和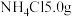 于烧杯中溶解;将溶液转入三颈烧瓶,分液漏斗中分别装有25mL浓氨水、5mL30%的
于烧杯中溶解;将溶液转入三颈烧瓶,分液漏斗中分别装有25mL浓氨水、5mL30%的 溶液,控制反应温度为60℃,打开分液漏斗,反应一段时间后,得
溶液,控制反应温度为60℃,打开分液漏斗,反应一段时间后,得 溶液。写出该反应的离子方程式
溶液。写出该反应的离子方程式___________ 。若上述实验过程中得到 ,则其中所含的
,则其中所含的 键数目为
键数目为___________ 。
(6)已知某温度下 的电离平衡常数:
的电离平衡常数: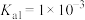 、
、 ,
,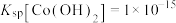 、
、 。写出该温度时向
。写出该温度时向 碳酸钠溶液中逐滴加入
碳酸钠溶液中逐滴加入 溶液,生成沉淀的离子方程式:
溶液,生成沉淀的离子方程式:___________ 。
 、
、 是新型磁性材料的成分,设
是新型磁性材料的成分,设 为阿伏加德罗常数的值,依据其中有关元素回答问题:
为阿伏加德罗常数的值,依据其中有关元素回答问题:(1)钕(Nd)属于镧系元素,则其在元素周期表中处于
 的价电子排布图为
的价电子排布图为(2)
 的立体构型为
的立体构型为(3)
 是一种还原剂,B原子的杂化方式为
是一种还原剂,B原子的杂化方式为(4)
 的钙钛矿型晶胞结构如图所示,其中Co填充在F形成的正八面体中心。
的钙钛矿型晶胞结构如图所示,其中Co填充在F形成的正八面体中心。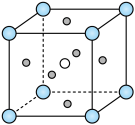
②该晶体密度为
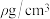 ,则K和Co之间的最短距离为
,则K和Co之间的最短距离为(5)
 的制备:称取研细的
的制备:称取研细的 和
和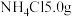 于烧杯中溶解;将溶液转入三颈烧瓶,分液漏斗中分别装有25mL浓氨水、5mL30%的
于烧杯中溶解;将溶液转入三颈烧瓶,分液漏斗中分别装有25mL浓氨水、5mL30%的 溶液,控制反应温度为60℃,打开分液漏斗,反应一段时间后,得
溶液,控制反应温度为60℃,打开分液漏斗,反应一段时间后,得 溶液。写出该反应的离子方程式
溶液。写出该反应的离子方程式 ,则其中所含的
,则其中所含的 键数目为
键数目为(6)已知某温度下
 的电离平衡常数:
的电离平衡常数: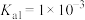 、
、 ,
,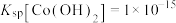 、
、 。写出该温度时向
。写出该温度时向 碳酸钠溶液中逐滴加入
碳酸钠溶液中逐滴加入 溶液,生成沉淀的离子方程式:
溶液,生成沉淀的离子方程式:
您最近一年使用:0次
7 . 完成下列问题。
(1)如图表示在密闭容器中反应: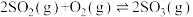 达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,a→b过程中改变的条件可能是
达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,a→b过程中改变的条件可能是______ ;b→c过程中改变的条件可能是______ ;若增大压强时,反应速度变化情况画在c~d处______ 。 、4.5mol
、4.5mol ,经10min后反应达平衡时有3mol
,经10min后反应达平衡时有3mol 发生了反应。试填写下列空格:
发生了反应。试填写下列空格:
① 的转化率为
的转化率为______ 。
②平衡常数K为______ 。
(1)如图表示在密闭容器中反应:
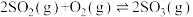 达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,a→b过程中改变的条件可能是
达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,a→b过程中改变的条件可能是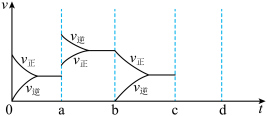
 、4.5mol
、4.5mol ,经10min后反应达平衡时有3mol
,经10min后反应达平衡时有3mol 发生了反应。试填写下列空格:
发生了反应。试填写下列空格:①
 的转化率为
的转化率为②平衡常数K为
您最近一年使用:0次
8 . 有效去除大气中的 是环境保护的重要课题。
是环境保护的重要课题。
(1)用水吸收 的相关热化学方程式如下:
的相关热化学方程式如下:
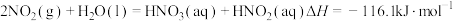
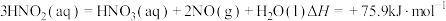
反应 的
的
___________  。
。
(2)用稀硝酸吸收 ,得到
,得到 和
和 的混合溶液,电解该混合溶液可获得较浓的硝酸,写出电解时阳极的电极反应式:
的混合溶液,电解该混合溶液可获得较浓的硝酸,写出电解时阳极的电极反应式:___________ 。( 是弱酸)
是弱酸)
(3)用酸性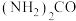 水溶液吸收
水溶液吸收 ,吸收过程中存在
,吸收过程中存在 与
与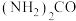 生成
生成 和
和 的反应,写出该反应的化学方程式:
的反应,写出该反应的化学方程式:___________ 。
(4)在有氧条件下,新型催化剂 能催化
能催化 与
与 反应生成
反应生成 。
。
① 与
与 生成
生成 的反应中,当生成
的反应中,当生成 时,转移的电子数为
时,转移的电子数为___________  。
。
②将一定比例的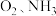 和
和 的混合气体,匀速通入装有催化剂
的混合气体,匀速通入装有催化剂 的反应器中反应(装置见图):
的反应器中反应(装置见图): 的去除率随反应温度的变化曲线如图所示,在
的去除率随反应温度的变化曲线如图所示,在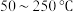 范围内随着温度的升高,
范围内随着温度的升高, 的去除率先迅速上升后缓慢上升的主要原因是
的去除率先迅速上升后缓慢上升的主要原因是___________ 。 (氯的化合价为
(氯的化合价为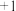 价),其原理是
价),其原理是
 接电源的
接电源的___________ (填“正”或“负”)极。
②阳极反应式是___________ 。
 是环境保护的重要课题。
是环境保护的重要课题。(1)用水吸收
 的相关热化学方程式如下:
的相关热化学方程式如下: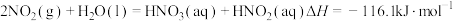
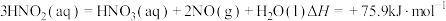
反应
 的
的
 。
。(2)用稀硝酸吸收
 ,得到
,得到 和
和 的混合溶液,电解该混合溶液可获得较浓的硝酸,写出电解时阳极的电极反应式:
的混合溶液,电解该混合溶液可获得较浓的硝酸,写出电解时阳极的电极反应式: 是弱酸)
是弱酸)(3)用酸性
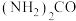 水溶液吸收
水溶液吸收 ,吸收过程中存在
,吸收过程中存在 与
与 生成
生成 和
和 的反应,写出该反应的化学方程式:
的反应,写出该反应的化学方程式:(4)在有氧条件下,新型催化剂
 能催化
能催化 与
与 反应生成
反应生成 。
。①
 与
与 生成
生成 的反应中,当生成
的反应中,当生成 时,转移的电子数为
时,转移的电子数为 。
。②将一定比例的
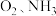 和
和 的混合气体,匀速通入装有催化剂
的混合气体,匀速通入装有催化剂 的反应器中反应(装置见图):
的反应器中反应(装置见图):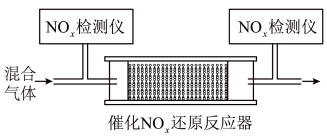
 的去除率随反应温度的变化曲线如图所示,在
的去除率随反应温度的变化曲线如图所示,在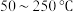 范围内随着温度的升高,
范围内随着温度的升高, 的去除率先迅速上升后缓慢上升的主要原因是
的去除率先迅速上升后缓慢上升的主要原因是
 (氯的化合价为
(氯的化合价为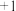 价),其原理是
价),其原理是
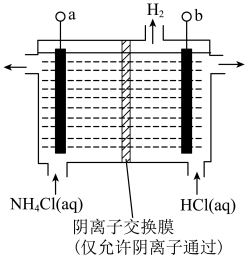
 接电源的
接电源的②阳极反应式是
您最近一年使用:0次
9 . 实验小组制备高铁酸钾 并探究其性质。资料:
并探究其性质。资料: 为紫色固体,微溶于
为紫色固体,微溶于 溶液;具有强氧化性,在酸性或中性溶液中快速产生
溶液;具有强氧化性,在酸性或中性溶液中快速产生 ,在碱性溶液中较稳定。
,在碱性溶液中较稳定。
(1)制备 (夹持装置略)
(夹持装置略) 中反应的化学方程式是
中反应的化学方程式是 ___________ (锰被还原为 )。
)。
②将除杂装置 补充完整并标明所用试剂。
补充完整并标明所用试剂。___________
③ 中得到紫色固体和溶液。
中得到紫色固体和溶液。 中
中 发生的反应有
发生的反应有 ,另外还有
,另外还有___________ (离子方程式)。
(2)探究 的性质
的性质
①取 中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液
中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液 ,经检验气体中含有
,经检验气体中含有 。为证明是否
。为证明是否 氧化了
氧化了 而产生
而产生 ,设计以下方案:
,设计以下方案:
i.由方案 中溶液变红可知
中溶液变红可知 中含有
中含有___________ 离子,但该离子的产生不能判断一定是 将
将 氧化,还可能由
氧化,还可能由___________ 产生(用离子方程式表示)。
ii.方案 可证明
可证明 氧化了
氧化了 。用
。用 溶液洗涤的目的是
溶液洗涤的目的是___________ 。
②根据 的制备实验得出:氧化性
的制备实验得出:氧化性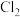
___________ 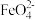 (填“
(填“ ”或“
”或“ ”),而方案
”),而方案 实验表明,
实验表明, 和
和 的氧化性强弱关系相反,原因是
的氧化性强弱关系相反,原因是___________ 。
③资料表明,酸性溶液中的氧化性
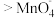 ,验证实验如下:将溶液
,验证实验如下:将溶液 滴入
滴入 和足量
和足量 的混合溶液中,振荡后溶液呈浅紫色,该现象能证明氧化性
的混合溶液中,振荡后溶液呈浅紫色,该现象能证明氧化性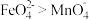 ,请说明理由:
,请说明理由:___________ 。
 并探究其性质。资料:
并探究其性质。资料: 为紫色固体,微溶于
为紫色固体,微溶于 溶液;具有强氧化性,在酸性或中性溶液中快速产生
溶液;具有强氧化性,在酸性或中性溶液中快速产生 ,在碱性溶液中较稳定。
,在碱性溶液中较稳定。(1)制备
 (夹持装置略)
(夹持装置略)
 中反应的化学方程式是
中反应的化学方程式是  )。
)。②将除杂装置
 补充完整并标明所用试剂。
补充完整并标明所用试剂。③
 中得到紫色固体和溶液。
中得到紫色固体和溶液。 中
中 发生的反应有
发生的反应有 ,另外还有
,另外还有(2)探究
 的性质
的性质①取
 中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液
中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液 ,经检验气体中含有
,经检验气体中含有 。为证明是否
。为证明是否 氧化了
氧化了 而产生
而产生 ,设计以下方案:
,设计以下方案:方案 | 取少量 ,滴加 ,滴加 溶液至过量,溶液呈红色。 溶液至过量,溶液呈红色。 |
方案 | 用 溶液充分洗涤C中所得固体,再用 溶液充分洗涤C中所得固体,再用 溶液将 溶液将 溶出,得到紫色溶液b。取少量 溶出,得到紫色溶液b。取少量 ,滴加盐酸,有 ,滴加盐酸,有 产生。 产生。 |
 中溶液变红可知
中溶液变红可知 中含有
中含有 将
将 氧化,还可能由
氧化,还可能由ii.方案
 可证明
可证明 氧化了
氧化了 。用
。用 溶液洗涤的目的是
溶液洗涤的目的是②根据
 的制备实验得出:氧化性
的制备实验得出:氧化性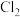
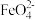 (填“
(填“ ”或“
”或“ ”),而方案
”),而方案 实验表明,
实验表明, 和
和 的氧化性强弱关系相反,原因是
的氧化性强弱关系相反,原因是③资料表明,酸性溶液中的氧化性

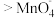 ,验证实验如下:将溶液
,验证实验如下:将溶液 滴入
滴入 和足量
和足量 的混合溶液中,振荡后溶液呈浅紫色,该现象能证明氧化性
的混合溶液中,振荡后溶液呈浅紫色,该现象能证明氧化性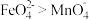 ,请说明理由:
,请说明理由:
您最近一年使用:0次
名校
10 . 在普通铝中加入少量 和
和 后,形成一种称为拉维斯相的
后,形成一种称为拉维斯相的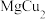 微小晶粒,其分散在
微小晶粒,其分散在 中可使得铝材的硬度增加、延展性减小,形成所谓“坚铝”,是制造飞机的主要材料。回答下列问题:
中可使得铝材的硬度增加、延展性减小,形成所谓“坚铝”,是制造飞机的主要材料。回答下列问题:
(1)下列状态的镁中,电离最外层一个电子所需能量最大的是___________(填标号)。
(2)乙二胺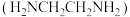 是一种有机化合物,分子中氮、碳的杂化类型分别是
是一种有机化合物,分子中氮、碳的杂化类型分别是___________ 、___________ 。乙二胺能与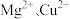 等金属离子形成稳定环状离子,乙二胺中提供孤电子对的是
等金属离子形成稳定环状离子,乙二胺中提供孤电子对的是___________ 原子(填名称),其中与乙二胺形成的化合物稳定性相对较高的是___________ (填“ ”或“
”或“ ”)。
”)。
(3)一些氧化物的熔点如下表所示:
请解释表中非金属氧化物之间熔点差异的原因___________ 。
(4)图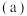 是
是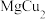 的拉维斯结构,
的拉维斯结构, 以金刚石方式堆积,八面体空隙和半数的四面体空隙中,填入以四面体方式排列的
以金刚石方式堆积,八面体空隙和半数的四面体空隙中,填入以四面体方式排列的 。图
。图 是沿立方格子对角面取得的截图。可见,
是沿立方格子对角面取得的截图。可见, 原子之间最短距离
原子之间最短距离
___________  。设阿伏加德罗常数的值为
。设阿伏加德罗常数的值为 ,则
,则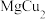 的密度是
的密度是___________  (列出计算表达式)。
(列出计算表达式)。
 和
和 后,形成一种称为拉维斯相的
后,形成一种称为拉维斯相的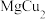 微小晶粒,其分散在
微小晶粒,其分散在 中可使得铝材的硬度增加、延展性减小,形成所谓“坚铝”,是制造飞机的主要材料。回答下列问题:
中可使得铝材的硬度增加、延展性减小,形成所谓“坚铝”,是制造飞机的主要材料。回答下列问题:(1)下列状态的镁中,电离最外层一个电子所需能量最大的是___________(填标号)。
A.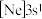 | B.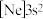 | C.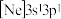 | D.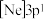 |
(2)乙二胺
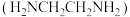 是一种有机化合物,分子中氮、碳的杂化类型分别是
是一种有机化合物,分子中氮、碳的杂化类型分别是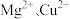 等金属离子形成稳定环状离子,乙二胺中提供孤电子对的是
等金属离子形成稳定环状离子,乙二胺中提供孤电子对的是 ”或“
”或“ ”)。
”)。(3)一些氧化物的熔点如下表所示:
| 氧化物 |  |  | 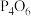 |  |
熔点 | 1570 | 2800 | 23.8 | 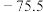 |
(4)图
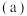 是
是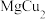 的拉维斯结构,
的拉维斯结构, 以金刚石方式堆积,八面体空隙和半数的四面体空隙中,填入以四面体方式排列的
以金刚石方式堆积,八面体空隙和半数的四面体空隙中,填入以四面体方式排列的 。图
。图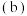 是沿立方格子对角面取得的截图。可见,
是沿立方格子对角面取得的截图。可见, 原子之间最短距离
原子之间最短距离
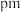 。设阿伏加德罗常数的值为
。设阿伏加德罗常数的值为 ,则
,则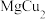 的密度是
的密度是 (列出计算表达式)。
(列出计算表达式)。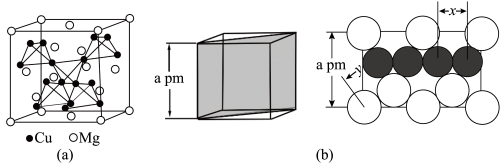
您最近一年使用:0次



