名校
1 . 氯亚铂酸钾(K2PtCl4)广泛用作制造各种铂配合物和药物的起始原料,—种以氯亚铂酸钾为原料制备有机物iv的合成路线如图所示,[PtCl4]2-为平面结构,下列说法正确的是
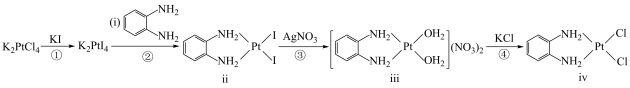
| A.ii的配体为Pt2+ |
| B.iii中Pt2+和O的杂化方式均为sp3 |
C.1mol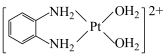 的非金属原子中共含有6mol孤电子对 的非金属原子中共含有6mol孤电子对 |
D.反应3的离子方程式为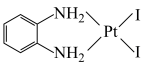 +2H2O+2Ag+→ +2H2O+2Ag+→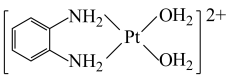 +2AgI↓ +2AgI↓ |
您最近一年使用:0次
2024-05-17更新
|
81次组卷
|
2卷引用: 河北省邢台市2023-2024学年高二下学期期中考试化学试卷
名校
2 . CNTSH/S作为锂硫电池硫的载体材料,具有机械强度高、导电性佳、比表面积和孔隙率大等特点,其合成过程如图所示,下列说法正确的是

| A.碳纳米管属于有机高分子材料 |
B.CNT-COOH与 发生了取代反应生成CNTSH 发生了取代反应生成CNTSH |
C. 能与水分子形成氢键,可表示为 能与水分子形成氢键,可表示为 |
D. 中S-S-S的键角为120° 中S-S-S的键角为120° |
您最近一年使用:0次
2024-05-17更新
|
92次组卷
|
2卷引用: 河北省邢台市2023-2024学年高二下学期期中考试化学试卷
名校
解题方法
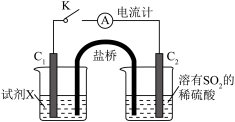
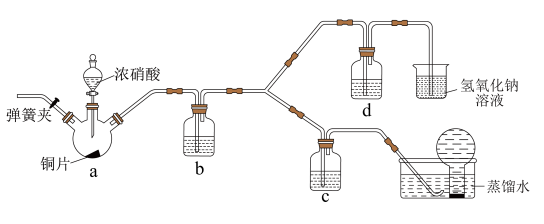
3 . 某小组按如下步骤探究二氧化硫与铜单质、Cu2+的反应:
ⅰ.按图示连接好装置。
ⅲ.关闭活塞b,打开活塞a.光亮的紫红色铜片很快变暗,并有黑色的Cu2S生成,同时溶液变为棕色,此时溶液中的铜元素以[CuCl3]2-(棕黄色)的形式存在。
ⅳ.静置后,取上层棕色的清液于试管中,加入一定量蒸馏水稀释,溶液中有白色沉淀CuCl析出。
(1)装置A中发生反应的化学方程式为___________ ,该反应中硫酸体现出的化学性质为___________ ;装置C的作用是___________ ,试剂m可选择___________ (填标号)。
a.饱和NaCl溶液 b.浓硫酸 c.NaOH浓溶液
(2)步骤ⅲ中,SO2在盐酸中与Cu反应的离子方程式为___________ ;步骤ⅳ中发生反应的离子方程式为[CuCl3]2-⇌CuCl↓+2Cl-,下列有关该反应的说法正确的是___________ (填标号)。
A.该反应中有电子的转移
B.反应经过足够长的时间后,[CuCl3]2-中的Cu元素能全部沉淀
C.溶液中,[CuCl3]2-和Cl-能同时存在
D.其他条件不变,当溶液的颜色不再改变时,表明该反应在该条件下达到最大限度
(3)在通风橱中利用如下装置进一步探究SO2与Cu2+的反应,盐桥(内有琼脂和饱和氯化钾溶液)用于连接两电极的电解质溶液。实验②中,闭合K后,C2电极上发生的电极反应为___________ ;不考虑其他副反应及Cu2+进入盐桥,实验②中,电路中转移0.02mole-时,左侧烧杯溶液中Cu2+的质量减少___________ g。
ⅰ.按图示连接好装置。
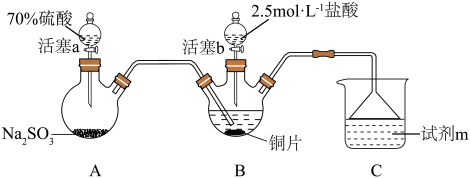
ⅲ.关闭活塞b,打开活塞a.光亮的紫红色铜片很快变暗,并有黑色的Cu2S生成,同时溶液变为棕色,此时溶液中的铜元素以[CuCl3]2-(棕黄色)的形式存在。
ⅳ.静置后,取上层棕色的清液于试管中,加入一定量蒸馏水稀释,溶液中有白色沉淀CuCl析出。
(1)装置A中发生反应的化学方程式为
a.饱和NaCl溶液 b.浓硫酸 c.NaOH浓溶液
(2)步骤ⅲ中,SO2在盐酸中与Cu反应的离子方程式为
A.该反应中有电子的转移
B.反应经过足够长的时间后,[CuCl3]2-中的Cu元素能全部沉淀
C.溶液中,[CuCl3]2-和Cl-能同时存在
D.其他条件不变,当溶液的颜色不再改变时,表明该反应在该条件下达到最大限度
(3)在通风橱中利用如下装置进一步探究SO2与Cu2+的反应,盐桥(内有琼脂和饱和氯化钾溶液)用于连接两电极的电解质溶液。实验②中,闭合K后,C2电极上发生的电极反应为
| 实验装置图 |
| ||
| 序号 | 试剂X | 实验现象 | |
| 电流计 | C1附近溶液 | ||
| ① | 0.1mol·L-1CuSO4溶液 | 指针几乎不偏转 | 无明显现象 |
| ② | 0.1mol·L-1NaCl和0.1mol·L-1CuSO4的混合溶液(足量) | 指针明显偏转 | 溶液变棕黄色 |
您最近一年使用:0次
4 . 下图是某元素的价类二维图,G为正盐,通常条件下Z是无色溶液,C的相对分子质量比D大16,各物质转化关系如图所示。下列说法不正确的是

| A.B可能是硫酸,也可能是硝酸 |
| B.F与过量Cl2反应有白烟生成 |
| C.B和F在一定条件下能反应生成盐 |
| D.F在一定条件下可直接与Y反应生成D |
您最近一年使用:0次
名校
解题方法
5 . 某药物中间体G的一种合成路线如图:
(1)已知A的沸点为161℃,B的沸点为155.6℃,其沸点差异的主要原因是___________ 。
(2)F中官能团的名称为___________ ;E的名称是___________ 。
(3)C→D的反应类型是___________ 。
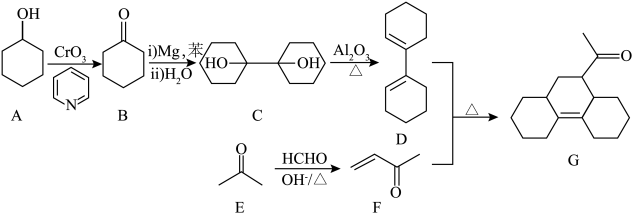
(4)已知吡啶(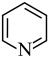 )分子中氮原子电子密度越大,碱性越强。下列几种有机物中,碱性由强到弱排序为
)分子中氮原子电子密度越大,碱性越强。下列几种有机物中,碱性由强到弱排序为___________ (填标号)。___________ 种(包括立体异构体)。其中,在核磞共振氢谱上有3组峰的结构简式为___________ 。
(6)已知:在常温常压下,苯乙烯与氢气在镍催化剂作用下,加成生成乙苯。以苯甲醛、乙醛为原料合成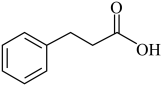 (氢化肉桂酸),设计合成路线:
(氢化肉桂酸),设计合成路线:___________ (其他无机试剂任选)。
(1)已知A的沸点为161℃,B的沸点为155.6℃,其沸点差异的主要原因是
(2)F中官能团的名称为
(3)C→D的反应类型是
(4)已知吡啶(
 )分子中氮原子电子密度越大,碱性越强。下列几种有机物中,碱性由强到弱排序为
)分子中氮原子电子密度越大,碱性越强。下列几种有机物中,碱性由强到弱排序为a.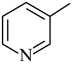 b.
b.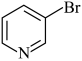 c.
c.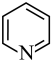 d.
d.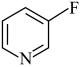
(6)已知:在常温常压下,苯乙烯与氢气在镍催化剂作用下,加成生成乙苯。以苯甲醛、乙醛为原料合成
 (氢化肉桂酸),设计合成路线:
(氢化肉桂酸),设计合成路线:
您最近一年使用:0次
名校
6 . 化学反应中的能量变化,通常表现为热量的变化,研究化学反应中的热量变化具有重要的意义。
(1)下列变化属于吸热反应的是___________ (填序号)。
①钢铁生锈 ②脂肪燃烧 ③液态水气化 ④灼热的木炭与CO2的反应
⑤Ba(OH)2·8H2O晶体与NH4Cl晶体的反应 ⑥氢氧化钾和稀硝酸反应 ⑦硝酸铵溶解
(2)已知:S(s)+O2(g,空气)=SO2(g) ΔH1,S(S)+O2(g,氧气)=SO2(g) ΔH2,则ΔH1___________ ΔH2(填“>”、“<”或“=”)。
(3)在微生物作用的条件下, 经过两步反应被氧化成
经过两步反应被氧化成 。两步反应的能量变化示意图如下:
。两步反应的能量变化示意图如下:___________ (填“放热”或“吸热”)反应;
②1mol (aq)全部氧化成
(aq)全部氧化成 (aq)的热化学方程式是
(aq)的热化学方程式是___________ 。
(4)甲醇(CH3OH, )既是重要的化工原料,又可作为燃料,利用合成气(主要成分为CO、CO2和H2)在催化剂作用下合成甲醇,发生的主要反应如下:
)既是重要的化工原料,又可作为燃料,利用合成气(主要成分为CO、CO2和H2)在催化剂作用下合成甲醇,发生的主要反应如下:
①CO(g)+2H2(g)=CH3OH(g) ΔH1
②CO2(g)+3H2(g)=CH3OH(g)+H2O(g) ΔH2
③CO2(g)+H2(g)=CO(g)+H2O(g) ΔH3
已知反应①中相关的化学键键能数据如下表:
由此计算ΔH1=___________ kJ/mol,已知ΔH3=+41kJ/mol,则ΔH2=___________ kJ/mol。
(5)已知
①H2的燃烧热的ΔH1=-285.8kJ/mol;
②H2O(g)=H2O(l) ΔH2=-44kJ/mol;
③CH3OH(g)=CH3OH(l) ΔH3=-37.5kJ/mol;
请再结合上述(4)题中的部分数据写出CH3OH(l)燃烧热的热化学方程式___________ 。
(6)热值指单位质量的燃料在氧气中完全燃烧生成稳定的氧化物时放出的热量,下表中热值最大的物质是___________ 。
(1)下列变化属于吸热反应的是
①钢铁生锈 ②脂肪燃烧 ③液态水气化 ④灼热的木炭与CO2的反应
⑤Ba(OH)2·8H2O晶体与NH4Cl晶体的反应 ⑥氢氧化钾和稀硝酸反应 ⑦硝酸铵溶解
(2)已知:S(s)+O2(g,空气)=SO2(g) ΔH1,S(S)+O2(g,氧气)=SO2(g) ΔH2,则ΔH1
(3)在微生物作用的条件下,
 经过两步反应被氧化成
经过两步反应被氧化成 。两步反应的能量变化示意图如下:
。两步反应的能量变化示意图如下:
②1mol
 (aq)全部氧化成
(aq)全部氧化成 (aq)的热化学方程式是
(aq)的热化学方程式是(4)甲醇(CH3OH,
 )既是重要的化工原料,又可作为燃料,利用合成气(主要成分为CO、CO2和H2)在催化剂作用下合成甲醇,发生的主要反应如下:
)既是重要的化工原料,又可作为燃料,利用合成气(主要成分为CO、CO2和H2)在催化剂作用下合成甲醇,发生的主要反应如下:①CO(g)+2H2(g)=CH3OH(g) ΔH1
②CO2(g)+3H2(g)=CH3OH(g)+H2O(g) ΔH2
③CO2(g)+H2(g)=CO(g)+H2O(g) ΔH3
已知反应①中相关的化学键键能数据如下表:
| H-H | C-O | C≡O(CO的化学键) | H-O | C-H | |
| 化学键 | 436 | 343 | 1076 | 465 | 413 |
(5)已知
①H2的燃烧热的ΔH1=-285.8kJ/mol;
②H2O(g)=H2O(l) ΔH2=-44kJ/mol;
③CH3OH(g)=CH3OH(l) ΔH3=-37.5kJ/mol;
请再结合上述(4)题中的部分数据写出CH3OH(l)燃烧热的热化学方程式
(6)热值指单位质量的燃料在氧气中完全燃烧生成稳定的氧化物时放出的热量,下表中热值最大的物质是
| 可燃物 | H2(g) | CH4(g) | C2H5OH(l) | CO(g) |
| 燃烧热(kJ/mol) | -285.8 | -890.3 | -1366.8 | -283.0 |
您最近一年使用:0次
名校
解题方法
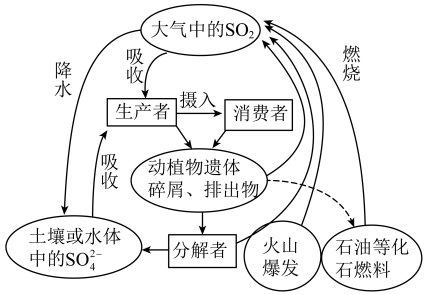
7 . 硫是生物必需的大量营养元素之一,下图是自然界中硫的循环图,在循环过程中S的价态变化在-2价至+6价之间,请分析此图并回答有关问题:______ 。
A.硫化氢分子很稳定,受热难分解
B.硫化氢分子中所有原子的最外层都达到8电子结构
C.将硫化氢通入硫酸亚铁溶液,产生沉淀
D.硫化氢中硫元素为-2价,因此只有还原性,没有氧化性
E.硫化氢可在空气中燃烧生成二氧化硫
(2)大中的SO2经过一系列转化最终生成H2SO4,导致降水具有较强酸性,称为酸雨。收集某次酸雨样品,发现8小时内,样品pH一直在减小,其原因可能是___________ (用化学方程式表示)。
(3)研究发现,空气中少量的NO2也能参与硫酸型酸雨的形成,反应过程如下:
①SO+NO2→SO3+NO ②SO3+H2O→H2SO4 ③2NO+O2→2NO2
NO2在上述过程中的作用,与H2SO4在下列变化中的作用不符的是___________。
(4)在制葡萄酒时可以人工添加SO2,有两个目的:抗氧化和抗菌,实验室模拟二氧化硫抗氧化过程,向溴水中通入SO2,请用离子方程式表示该反应原理___________ 。发酵酒卫生标准中对葡萄酒中的二氧化硫含量有要求:总SO2小于250mg/L,若在室温下。每升溶液中最多通入___________ mL SO2.(室温下Vm=24.5L/mol,结果保留3位有效数字,体积变化忽略不计)
(5)明代《徐光启手迹》记载了用硫酸盐制备硝酸的方法,其主要流程(部分产物已省略)如下:___________ 。
②关于整个制备过程,下列说法正确的是___________ 。
A.本流程涉及复分解反应
B.由H2SO4制HNO3利用了强酸制弱酸原理
C.制备使用的铁锅易损坏
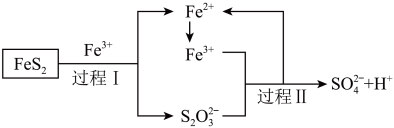
(6)工业上为了防止制硫酸过程中产生污染,可以利用氧化亚铁硫杆菌(T·f)对硫铁矿进行催化脱硫,该过程如图所示:___________ 。
②脱硫过程中产生的 在酸性溶液中会形成淡黄色沉淀并产生刺激性气味的气体,写出其离子方程式
在酸性溶液中会形成淡黄色沉淀并产生刺激性气味的气体,写出其离子方程式___________ 。
③从氧化还原角度分析,若要制备Na2S2O3应选择___________ (填字母)。
A.SO2+Na2SO4 B.Na2S+S C.Na2SO3+Na2SO4 D.Na2SO3+S
A.硫化氢分子很稳定,受热难分解
B.硫化氢分子中所有原子的最外层都达到8电子结构
C.将硫化氢通入硫酸亚铁溶液,产生沉淀
D.硫化氢中硫元素为-2价,因此只有还原性,没有氧化性
E.硫化氢可在空气中燃烧生成二氧化硫
(2)大中的SO2经过一系列转化最终生成H2SO4,导致降水具有较强酸性,称为酸雨。收集某次酸雨样品,发现8小时内,样品pH一直在减小,其原因可能是
(3)研究发现,空气中少量的NO2也能参与硫酸型酸雨的形成,反应过程如下:
①SO+NO2→SO3+NO ②SO3+H2O→H2SO4 ③2NO+O2→2NO2
NO2在上述过程中的作用,与H2SO4在下列变化中的作用不符的是___________。
| A.潮湿的氯气通过盛有浓H2SO4的洗气瓶 |
| B.硫化氢通入浓H2SO4中 |
| C.浓H2SO4滴入萤石中,加热 |
| D.向盐酸中加入浓硫酸产生白雾 |
(4)在制葡萄酒时可以人工添加SO2,有两个目的:抗氧化和抗菌,实验室模拟二氧化硫抗氧化过程,向溴水中通入SO2,请用离子方程式表示该反应原理
(5)明代《徐光启手迹》记载了用硫酸盐制备硝酸的方法,其主要流程(部分产物已省略)如下:

②关于整个制备过程,下列说法正确的是
A.本流程涉及复分解反应
B.由H2SO4制HNO3利用了强酸制弱酸原理
C.制备使用的铁锅易损坏
(6)工业上为了防止制硫酸过程中产生污染,可以利用氧化亚铁硫杆菌(T·f)对硫铁矿进行催化脱硫,该过程如图所示:
②脱硫过程中产生的
 在酸性溶液中会形成淡黄色沉淀并产生刺激性气味的气体,写出其离子方程式
在酸性溶液中会形成淡黄色沉淀并产生刺激性气味的气体,写出其离子方程式③从氧化还原角度分析,若要制备Na2S2O3应选择
A.SO2+Na2SO4 B.Na2S+S C.Na2SO3+Na2SO4 D.Na2SO3+S
您最近一年使用:0次
名校
8 . “环境就是民生,青山就是美丽,蓝天也是幸福。”拥有天蓝、地绿、水净的美好家园,是每个中国人的梦想。回答下列问题:
(1)汽车尾气(含CO、N2、SO2和NO等)是城市空气污染源之一,治理的方法之一是在汽车的排气管上装一个“催化转化器”,它能使一氧化碳跟一氧化氮反应生成可参与大气生态循环的无毒气体。写出在催化剂的作用下CO跟NO反应的化学方程式___________ 。
(2)化肥、炼油、稀土、钢铁等工业都会排放出高浓度的氨氮废水。氨氮废水是造成河流及湖泊富营养化的主要因素。某氮肥厂产生的氨氮废水中的氮元素多以 和NH3·H2O形式存在,为达到变废为宝回收利用的目的某团队设计处理流程如下:
和NH3·H2O形式存在,为达到变废为宝回收利用的目的某团队设计处理流程如下:___________ 。
②过程Ⅱ为硝化过程,在微生物的作用下实现 →
→ →
→ 的转化,在碱性条件下,
的转化,在碱性条件下, 被氧气氧化成
被氧气氧化成 的总反应的离子方程式为
的总反应的离子方程式为___________ 。
③过程Ⅲ为反硝化过程,向一定条件下的废水中加入甲醇(CH3OH)实现HNO3→ →N2的转化,将0.5mol
→N2的转化,将0.5mol 完全转化为N2,转移电子的物质的量为
完全转化为N2,转移电子的物质的量为___________ 。
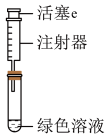
(3)按如图所示装置探究浓、稀硝酸氧化性的相对强弱(夹持仪器已略去)。实验表明浓硝酸能将NO氧化成NO2,而稀硝酸不能氧化NO。由此得出的结论是浓硝酸的氧化性强于稀硝酸。
①装置b、c、d中盛放的药品依次是___________ 、___________ 、___________ 。其中装置a中发生反应的化学方程式是___________ 。
②实验结束后,同学们发现装置a中溶液呈绿色,而不显蓝色。针对溶液呈绿色的原因,提出以下假设:
假设1:Cu2+的浓度较大所致;
假设2:溶解了生成的NO2。
探究如下:取装置a中绿色溶液,分为两等份。
取一份于如图所示装置中,___________ (填“操作”和“现象”),证实装置a中溶解了NO2。___________ (填化学试剂),溶液变为蓝色。证实假设1不成立,假设2成立。
(1)汽车尾气(含CO、N2、SO2和NO等)是城市空气污染源之一,治理的方法之一是在汽车的排气管上装一个“催化转化器”,它能使一氧化碳跟一氧化氮反应生成可参与大气生态循环的无毒气体。写出在催化剂的作用下CO跟NO反应的化学方程式
(2)化肥、炼油、稀土、钢铁等工业都会排放出高浓度的氨氮废水。氨氮废水是造成河流及湖泊富营养化的主要因素。某氮肥厂产生的氨氮废水中的氮元素多以
 和NH3·H2O形式存在,为达到变废为宝回收利用的目的某团队设计处理流程如下:
和NH3·H2O形式存在,为达到变废为宝回收利用的目的某团队设计处理流程如下: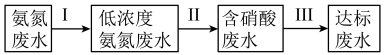
②过程Ⅱ为硝化过程,在微生物的作用下实现
 →
→ →
→ 的转化,在碱性条件下,
的转化,在碱性条件下, 被氧气氧化成
被氧气氧化成 的总反应的离子方程式为
的总反应的离子方程式为③过程Ⅲ为反硝化过程,向一定条件下的废水中加入甲醇(CH3OH)实现HNO3→
 →N2的转化,将0.5mol
→N2的转化,将0.5mol 完全转化为N2,转移电子的物质的量为
完全转化为N2,转移电子的物质的量为(3)按如图所示装置探究浓、稀硝酸氧化性的相对强弱(夹持仪器已略去)。实验表明浓硝酸能将NO氧化成NO2,而稀硝酸不能氧化NO。由此得出的结论是浓硝酸的氧化性强于稀硝酸。
①装置b、c、d中盛放的药品依次是
②实验结束后,同学们发现装置a中溶液呈绿色,而不显蓝色。针对溶液呈绿色的原因,提出以下假设:
假设1:Cu2+的浓度较大所致;
假设2:溶解了生成的NO2。
探究如下:取装置a中绿色溶液,分为两等份。
取一份于如图所示装置中,
您最近一年使用:0次
名校
解题方法
9 . 由SiO2制备高纯度硅的工业流程如图所示:

| A.利用硅的半导体性能可以制成计算机芯片及光伏电站的太阳能电池 |
B.石英砂与过量焦炭发生的主要反应的化学方程式为SiO2+2C Si+2CO↑ Si+2CO↑ |
| C.标准状况下体积为11.2L的H2完全反应时转移1mol电子 |
| D.气体H2、HCl可循环使用 |
您最近一年使用:0次
名校
解题方法
10 . 我国高含硫天然气资源丰富,天然气脱硫有重要的现实意义。天然飞脱硫工艺涉及如下反应:
①2H2S(g)+SO2(g)= S2(g)+2H2O(g) ΔH1=akJ·mol-1
S2(g)+2H2O(g) ΔH1=akJ·mol-1
②2H2S(g)+3O2(g)=2SO2(g)+2H2O(g) ΔH2=bkJ·mol-1
③2H2(g)+O2(g)=2H2O(g) ΔH3=ckJ·mol-1
④2H2S(g)=S2(g)+2H2(g) ΔH4,则ΔH4的正确表达式为
①2H2S(g)+SO2(g)=
 S2(g)+2H2O(g) ΔH1=akJ·mol-1
S2(g)+2H2O(g) ΔH1=akJ·mol-1②2H2S(g)+3O2(g)=2SO2(g)+2H2O(g) ΔH2=bkJ·mol-1
③2H2(g)+O2(g)=2H2O(g) ΔH3=ckJ·mol-1
④2H2S(g)=S2(g)+2H2(g) ΔH4,则ΔH4的正确表达式为
A. | B. | C. | D. |
您最近一年使用:0次