1 . 实验室中经常用酸碱中和滴定的方法测定溶液的浓度。
I.NaOH标准溶液的配制
(1)用托盘天平称取2.0gNaOH固体,加500mL蒸馏水配成溶液,并放置冷却。实验过程中用到的玻璃仪器有量筒、烧杯、___________ 。
(2)现欲测定上述溶液的准确浓度,用准确称取的0.4080g邻苯二甲酸氢钾(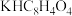 ,摩尔质量为
,摩尔质量为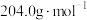 )溶于20mL水所得的溶液与该NaOH溶液反应,测得恰好完全反应时消耗该NaOH溶液的体积为20.20mL。则该溶液中NaOH的物质的量浓度为
)溶于20mL水所得的溶液与该NaOH溶液反应,测得恰好完全反应时消耗该NaOH溶液的体积为20.20mL。则该溶液中NaOH的物质的量浓度为___________  (已知:
(已知: ;计算结果保留4位有效数字,下同)。
;计算结果保留4位有效数字,下同)。
II.若用 的标准NaOH溶液滴定未知浓度的盐酸,其操作可分为如下几步:
的标准NaOH溶液滴定未知浓度的盐酸,其操作可分为如下几步:
①用蒸馏水洗涤碱式滴定管,注入 的标准NaOH溶液至“0”刻度线以上;
的标准NaOH溶液至“0”刻度线以上;
②固定好滴定管并使滴定管尖嘴充满液体,调节液面至“0”或“0”刻度线以下,并记下读数;
③量取20.00mL待测液注入洁净的锥形瓶中,并加入2滴甲基橙溶液;
④用标准液滴定至终点,记下滴定管液面读数;
⑤重复以上滴定操作2~3次。
(3)步骤①存在的错误是___________ 。
(4)步骤③中,量取20.00mL待测液应使用___________ (填标号)。
a.酸式滴定管 b.碱式滴定管 c.量筒
(5)步骤④中,判断到达滴定终点的依据是___________ 。
(6)若步骤①中操作正确,以下是实验数据记录表:
从表中可以看出,第1次滴定记录的NaOH溶液体积明显小于后两次的体积,其可能的原因是___________(填标号)。
(7)根据表中记录数据,通过计算可得盐酸浓度为___________  。
。
I.NaOH标准溶液的配制
(1)用托盘天平称取2.0gNaOH固体,加500mL蒸馏水配成溶液,并放置冷却。实验过程中用到的玻璃仪器有量筒、烧杯、
(2)现欲测定上述溶液的准确浓度,用准确称取的0.4080g邻苯二甲酸氢钾(
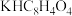 ,摩尔质量为
,摩尔质量为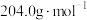 )溶于20mL水所得的溶液与该NaOH溶液反应,测得恰好完全反应时消耗该NaOH溶液的体积为20.20mL。则该溶液中NaOH的物质的量浓度为
)溶于20mL水所得的溶液与该NaOH溶液反应,测得恰好完全反应时消耗该NaOH溶液的体积为20.20mL。则该溶液中NaOH的物质的量浓度为 (已知:
(已知: ;计算结果保留4位有效数字,下同)。
;计算结果保留4位有效数字,下同)。II.若用
 的标准NaOH溶液滴定未知浓度的盐酸,其操作可分为如下几步:
的标准NaOH溶液滴定未知浓度的盐酸,其操作可分为如下几步:①用蒸馏水洗涤碱式滴定管,注入
 的标准NaOH溶液至“0”刻度线以上;
的标准NaOH溶液至“0”刻度线以上;②固定好滴定管并使滴定管尖嘴充满液体,调节液面至“0”或“0”刻度线以下,并记下读数;
③量取20.00mL待测液注入洁净的锥形瓶中,并加入2滴甲基橙溶液;
④用标准液滴定至终点,记下滴定管液面读数;
⑤重复以上滴定操作2~3次。
(3)步骤①存在的错误是
(4)步骤③中,量取20.00mL待测液应使用
a.酸式滴定管 b.碱式滴定管 c.量筒
(5)步骤④中,判断到达滴定终点的依据是
(6)若步骤①中操作正确,以下是实验数据记录表:
| 滴定次数 | 盐酸体积/mL | NaOH溶液体积/mL | |
| 滴定前 | 滴定后 | ||
| 1 | 20.00 | 0.00 | 14.10 |
| 2 | 20.00 | 0.00 | 16.20 |
| 3 | 20.00 | 0.00 | 16.22 |
| A.锥形瓶装液前,留有少量蒸馏水 |
| B.取待测液时,有部分液体洒在锥形瓶外壁上 |
| C.滴定前滴定管尖嘴无气泡,滴定结束后有气泡 |
| D.NaOH标准液保存时间过长,有部分变质 |
 。
。
您最近一年使用:0次
名校
解题方法
2 . 丙酮在HCl催化条件下发生溴化反应的化学方程式为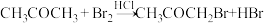 ,已知该反应的速率方程为
,已知该反应的速率方程为 ,其中k为与温度有关的常数。下列说法正确的是
,其中k为与温度有关的常数。下列说法正确的是
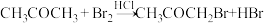 ,已知该反应的速率方程为
,已知该反应的速率方程为 ,其中k为与温度有关的常数。下列说法正确的是
,其中k为与温度有关的常数。下列说法正确的是| A.该反应为加成反应 | B.升高温度,k增大,化学反应速率加快 |
C.减小 ,化学反应速率减慢 ,化学反应速率减慢 | D.增大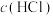 ,化学反应速率不变 ,化学反应速率不变 |
您最近一年使用:0次
2024-03-28更新
|
176次组卷
|
2卷引用:安徽省淮北市树人高级中学2023-2024学年上学期高二11月期中考试化学试题
解题方法
3 . 一定条件下,反应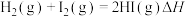 的能量变化如图所示:
的能量变化如图所示:

下列说法错误的是
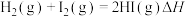 的能量变化如图所示:
的能量变化如图所示:
下列说法错误的是
A.该反应的焓变 | B.该反应的速控步为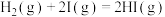 |
C.逆反应速控步的活化能为 | D.反应物的键能之和小于生成物的键能之和 |
您最近一年使用:0次
4 . 化学与资源回收、生产活动息息相关。
I.废旧印刷电路板的回收利用可实现资源再生,并减少污染。废旧印刷电路板经粉碎分离,能得到非金属粉末和金属粉末。
(1)工业上,用 和
和 的混合溶液可溶出印刷电路板金属粉末中的铜。已知常温常压下:
的混合溶液可溶出印刷电路板金属粉末中的铜。已知常温常压下:
①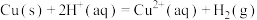

②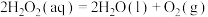

③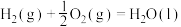

则在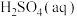 溶液中Cu(s)与
溶液中Cu(s)与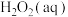 反应生成
反应生成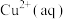 和
和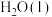 的热化学方程式为
的热化学方程式为___________ 。
(2)控制其他条件不变,废旧印刷电路板的金属粉末用10% 和
和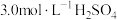 溶液处理,测得不同温度下
溶液处理,测得不同温度下 的平均生成速率v如下表所示:
的平均生成速率v如下表所示:
当温度高于40℃时, 的平均生成速率随着反应温度的升高而下降,其主要原因是
的平均生成速率随着反应温度的升高而下降,其主要原因是___________ (用化学方程式表示)。
(3)若 溶液中含有
溶液中含有 ,可加入CuO粉末将其转化为
,可加入CuO粉末将其转化为 沉淀除去,反应的离子方程式为
沉淀除去,反应的离子方程式为___________ 。为加快除杂反应的速率,可采取的措施有___________ (任意答出两条)。
Ⅱ.以合成气为原料生产甲醇的化学方程式为 。
。
(4)在恒温、恒压密闭容器中充入2molCO,4mol 和2molHe(代替合成气中的杂质,不参与反应),测得压强为pMPa,加入催化剂后开始反应,测得容器的体积变化如表:
和2molHe(代替合成气中的杂质,不参与反应),测得压强为pMPa,加入催化剂后开始反应,测得容器的体积变化如表:
则氢气的平衡转化率为___________ ,平衡体系中 的分压为
的分压为___________ MPa(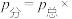 物质的量分数;请用含p的式子表示)。若其他条件不变,充入He物质的量变为8mol,则
物质的量分数;请用含p的式子表示)。若其他条件不变,充入He物质的量变为8mol,则 的转化率
的转化率___________ (填“增大”“减小”或“不变”)。
I.废旧印刷电路板的回收利用可实现资源再生,并减少污染。废旧印刷电路板经粉碎分离,能得到非金属粉末和金属粉末。
(1)工业上,用
 和
和 的混合溶液可溶出印刷电路板金属粉末中的铜。已知常温常压下:
的混合溶液可溶出印刷电路板金属粉末中的铜。已知常温常压下:①
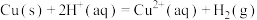

②
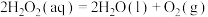

③
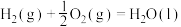

则在
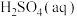 溶液中Cu(s)与
溶液中Cu(s)与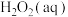 反应生成
反应生成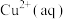 和
和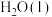 的热化学方程式为
的热化学方程式为(2)控制其他条件不变,废旧印刷电路板的金属粉末用10%
 和
和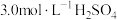 溶液处理,测得不同温度下
溶液处理,测得不同温度下 的平均生成速率v如下表所示:
的平均生成速率v如下表所示:| 温度/℃ | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
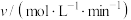 | 7.34 | 8.01 | 9.25 | 7.98 | 7.24 | 6.73 | 5.76 |
 的平均生成速率随着反应温度的升高而下降,其主要原因是
的平均生成速率随着反应温度的升高而下降,其主要原因是(3)若
 溶液中含有
溶液中含有 ,可加入CuO粉末将其转化为
,可加入CuO粉末将其转化为 沉淀除去,反应的离子方程式为
沉淀除去,反应的离子方程式为Ⅱ.以合成气为原料生产甲醇的化学方程式为
 。
。(4)在恒温、恒压密闭容器中充入2molCO,4mol
 和2molHe(代替合成气中的杂质,不参与反应),测得压强为pMPa,加入催化剂后开始反应,测得容器的体积变化如表:
和2molHe(代替合成气中的杂质,不参与反应),测得压强为pMPa,加入催化剂后开始反应,测得容器的体积变化如表:| 反应时间/min | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
| 容器体积/L | 8 | 7 | 6.4 | 6 | 5.8 | 5.6 | 5.6 |
 的分压为
的分压为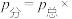 物质的量分数;请用含p的式子表示)。若其他条件不变,充入He物质的量变为8mol,则
物质的量分数;请用含p的式子表示)。若其他条件不变,充入He物质的量变为8mol,则 的转化率
的转化率
您最近一年使用:0次
解题方法
5 . 氮及其化合物在生产、生活中具有广泛的应用。
(1)已知一定条件下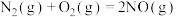
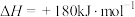 。1mol
。1mol 分子中的化学键断裂时需吸收498kJ的能量,1molNO分子中的化学键断裂时需吸收632kJ的能量。则
分子中的化学键断裂时需吸收498kJ的能量,1molNO分子中的化学键断裂时需吸收632kJ的能量。则 的键能为
的键能为___________ 。
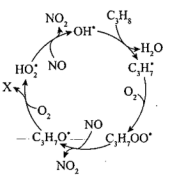
(2)某些过氧由基可以将NO氧化为 ,其反应机理如图所示(标*的为自由基)。X的分子式为
,其反应机理如图所示(标*的为自由基)。X的分子式为___________ ,总反应的化学方程式为___________ 。
(3)反应 的速率方程可表示为
的速率方程可表示为 ,其中k是与温度有关的常数,实验测得反应在650K时的数据如表:
,其中k是与温度有关的常数,实验测得反应在650K时的数据如表:
根据表中数据计算,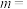
___________ ,
___________ 。温度为650K时该反应的速率常数
___________ 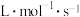 。
。
(4) 储存还原技术法(NSR)利用催化剂消除汽车尾气中的
储存还原技术法(NSR)利用催化剂消除汽车尾气中的 ,反应的化学方程式:
,反应的化学方程式: 。在一定温度下,向2L恒容密闭容器中充入等物质的S的NO和CO模拟NSR反应,在有催化剂和无催化剂条件下测得c(NO)随时间变化的曲线如图所示:
。在一定温度下,向2L恒容密闭容器中充入等物质的S的NO和CO模拟NSR反应,在有催化剂和无催化剂条件下测得c(NO)随时间变化的曲线如图所示:
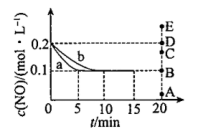
①曲线a和b中,表示在该温度下使用NSR催化技术的是曲线___________ 。
②曲线b表示的反应前10min内CO的平均反应速率
___________  。
。
③若保持其他条件不变,15min时将容器的体积压缩至1L,20min时反应重新达到平衡,NO的物质的量浓度对应的点可能是___________ 点。
(1)已知一定条件下
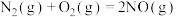
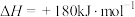 。1mol
。1mol 分子中的化学键断裂时需吸收498kJ的能量,1molNO分子中的化学键断裂时需吸收632kJ的能量。则
分子中的化学键断裂时需吸收498kJ的能量,1molNO分子中的化学键断裂时需吸收632kJ的能量。则 的键能为
的键能为(2)某些过氧由基可以将NO氧化为
 ,其反应机理如图所示(标*的为自由基)。X的分子式为
,其反应机理如图所示(标*的为自由基)。X的分子式为
(3)反应
 的速率方程可表示为
的速率方程可表示为 ,其中k是与温度有关的常数,实验测得反应在650K时的数据如表:
,其中k是与温度有关的常数,实验测得反应在650K时的数据如表:| 实验编号 | 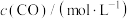 | 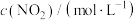 | 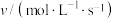 |
| ① | 0.025 | 0.040 | 2.2×10-4 |
| ② | 0.050 | 0.040 | 4.4×10-4 |
| ③ | 0.025 | 0.120 | 6.6×10-4 |
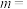


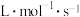 。
。(4)
 储存还原技术法(NSR)利用催化剂消除汽车尾气中的
储存还原技术法(NSR)利用催化剂消除汽车尾气中的 ,反应的化学方程式:
,反应的化学方程式: 。在一定温度下,向2L恒容密闭容器中充入等物质的S的NO和CO模拟NSR反应,在有催化剂和无催化剂条件下测得c(NO)随时间变化的曲线如图所示:
。在一定温度下,向2L恒容密闭容器中充入等物质的S的NO和CO模拟NSR反应,在有催化剂和无催化剂条件下测得c(NO)随时间变化的曲线如图所示:
①曲线a和b中,表示在该温度下使用NSR催化技术的是曲线
②曲线b表示的反应前10min内CO的平均反应速率

 。
。③若保持其他条件不变,15min时将容器的体积压缩至1L,20min时反应重新达到平衡,NO的物质的量浓度对应的点可能是
您最近一年使用:0次
6 . 弱电解质的电离平衡在生产、生活、科学研究中具有重要的意义。
Ⅰ.已知25℃时,物质的量浓度为 的MOH溶液中,
的MOH溶液中,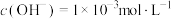 。
。
(1)MOH的电离方程式为___________ 。
(2)已知电离度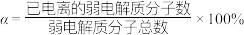 ,MOH的电离度
,MOH的电离度
___________ ,其电离平衡常数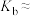
___________ 。
Ⅱ.已知T℃时,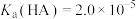
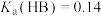 。
。
(3)在该温度下,将20mL HA溶液和20mL
HA溶液和20mL HB溶液分别与20mL
HB溶液分别与20mL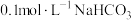 溶液混合,实验测得产生气体的体积V随时间t变化的曲线如图所示。两种溶液产生
溶液混合,实验测得产生气体的体积V随时间t变化的曲线如图所示。两种溶液产生 气体的速率存在明显差异的原因是
气体的速率存在明显差异的原因是___________ 。
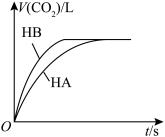
(4)向NaA溶液中滴加HB溶液,发生反应: ,该反应的平衡常数
,该反应的平衡常数
___________ 。
Ⅲ.水是弱电解质,电离程度很小,其电离平衡曲线如图所示。
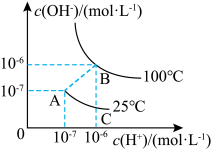
(5)图中A、B、C三点的 大小关系是
大小关系是___________ 。
(6)向B点溶液中加入NaOH固体,保持温度不变,使溶液中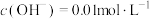 ,该溶液的pH为
,该溶液的pH为___________ ,溶液中由水电离产生的
___________ 。
Ⅰ.已知25℃时,物质的量浓度为
 的MOH溶液中,
的MOH溶液中,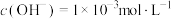 。
。(1)MOH的电离方程式为
(2)已知电离度
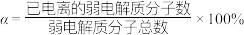 ,MOH的电离度
,MOH的电离度
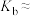
Ⅱ.已知T℃时,
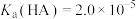
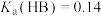 。
。(3)在该温度下,将20mL
 HA溶液和20mL
HA溶液和20mL HB溶液分别与20mL
HB溶液分别与20mL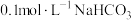 溶液混合,实验测得产生气体的体积V随时间t变化的曲线如图所示。两种溶液产生
溶液混合,实验测得产生气体的体积V随时间t变化的曲线如图所示。两种溶液产生 气体的速率存在明显差异的原因是
气体的速率存在明显差异的原因是
(4)向NaA溶液中滴加HB溶液,发生反应:
 ,该反应的平衡常数
,该反应的平衡常数
Ⅲ.水是弱电解质,电离程度很小,其电离平衡曲线如图所示。

(5)图中A、B、C三点的
 大小关系是
大小关系是(6)向B点溶液中加入NaOH固体,保持温度不变,使溶液中
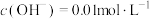 ,该溶液的pH为
,该溶液的pH为
您最近一年使用:0次
7 . 常温下,浓度均为 体积均为
体积均为 的HX、HY溶液,分别加水稀释至体积变为V,溶液的pH随
的HX、HY溶液,分别加水稀释至体积变为V,溶液的pH随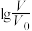 的变化关系如图所示。下列说法错误的是
的变化关系如图所示。下列说法错误的是

 体积均为
体积均为 的HX、HY溶液,分别加水稀释至体积变为V,溶液的pH随
的HX、HY溶液,分别加水稀释至体积变为V,溶液的pH随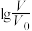 的变化关系如图所示。下列说法错误的是
的变化关系如图所示。下列说法错误的是
| A.HX是弱酸,HY是强酸 |
| B.溶液中水的电离程度:a点<b点 |
| C.中和等体积两种溶液,消耗NaOH的物质的量相同 |
D.若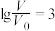 ,同时微热两种溶液,则 ,同时微热两种溶液,则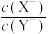 减小 减小 |
您最近一年使用:0次
8 . 人体血液的正常pH范围是7.35~7.45.血浆“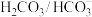 ”缓冲体系对稳定体系酸碱度有重要作用
”缓冲体系对稳定体系酸碱度有重要作用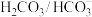 的缓冲作用可用下列平衡表示:
的缓冲作用可用下列平衡表示: 。下列说法错误的是
。下列说法错误的是
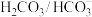 ”缓冲体系对稳定体系酸碱度有重要作用
”缓冲体系对稳定体系酸碱度有重要作用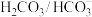 的缓冲作用可用下列平衡表示:
的缓冲作用可用下列平衡表示: 。下列说法错误的是
。下列说法错误的是A.人体血浆中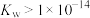 |
B.运动后血液中的 增加,血液的pH降低 增加,血液的pH降低 |
C.当人体血液中pH升高时,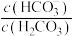 的值减小 的值减小 |
D.人体血浆中的 可以消耗无氧呼吸产生的乳酸 可以消耗无氧呼吸产生的乳酸 |
您最近一年使用:0次
解题方法
9 . 在容积不变的密闭容器中,一定量的 与
与 发生反应:
发生反应: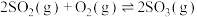 。温度分别为
。温度分别为 和
和 时,
时,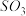 的体积分数随时间的变化如图所示。下列判断错误的是
的体积分数随时间的变化如图所示。下列判断错误的是
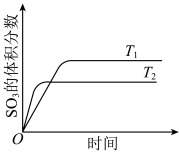
 与
与 发生反应:
发生反应: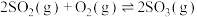 。温度分别为
。温度分别为 和
和 时,
时,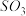 的体积分数随时间的变化如图所示。下列判断错误的是
的体积分数随时间的变化如图所示。下列判断错误的是
A.反应温度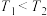 |
B.该反应的 |
C.若 和 和 时的平衡常数分别为 时的平衡常数分别为 和 和 ,则 ,则 |
D.若 和 和 时使用相同的催化剂,其催化效果可能不同 时使用相同的催化剂,其催化效果可能不同 |
您最近一年使用:0次
10 . 干重整反应可将两种相对廉价的含碳化合物 和
和 转变成具有高附加值的合成气,其主要反应为
转变成具有高附加值的合成气,其主要反应为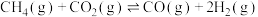
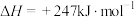 。一定温度下,将1mol
。一定温度下,将1mol 和1mol
和1mol 充入容积为2L的恒容密闭容器中充分反应。下列说法错误的是
充入容积为2L的恒容密闭容器中充分反应。下列说法错误的是
 和
和 转变成具有高附加值的合成气,其主要反应为
转变成具有高附加值的合成气,其主要反应为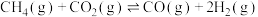
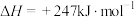 。一定温度下,将1mol
。一定温度下,将1mol 和1mol
和1mol 充入容积为2L的恒容密闭容器中充分反应。下列说法错误的是
充入容积为2L的恒容密闭容器中充分反应。下列说法错误的是| A.体系的压强不再变化时,反应达到化学平衡状态 |
B.平衡后充入0.2molCH4,再次达到平衡时,转化率: |
C.若升高温度, 和 和 均增大,再次达到平衡时, 均增大,再次达到平衡时, 的产率增大 的产率增大 |
| D.若增大容器体积,再次达到平衡时,反应混合物的平均摩尔质量减小 |
您最近一年使用:0次



