10-11高二上·河南新乡·阶段练习
名校
解题方法
1 . 下列溶液一定呈中性的是
A. mol⋅L mol⋅L 的溶液 的溶液 |
B. 的溶液 的溶液 |
| C.使石蕊试液呈紫色的溶液 |
| D.酸与碱恰好完全反应生成正盐的溶液 |
您最近一年使用:0次
2024-04-12更新
|
89次组卷
|
55卷引用:甘肃省定西市文峰中学2021-2022学年高二上学期期中考试化学(理科)试题
甘肃省定西市文峰中学2021-2022学年高二上学期期中考试化学(理科)试题(已下线)2011—2012河北省南宫中学高二期中考试化学(理)试卷(已下线)2011-2012学年陕西省宝鸡中学高二下学期期中考试化学试题(已下线)2012-2013学年呼伦贝尔牙林一中高二上学期期中理科考试化学试卷(已下线)2014-2015学年浙江省东阳外国语学校高二上学期期中化学试卷【校级联考】浙江省温州市“十五校联合体”2018-2019学年高二上学期期中联考化学试题内蒙古自治区包头市第六中学2018-2019学年高二上学期期中考试化学试题宁夏贺兰县景博中学2019-2020学年高二上学期期中考试化学试题黑龙江省齐齐哈尔三立高级中学有限公司2019-2020学年高二上学期期中考试化学试题内蒙古自治区乌兰察布市集宁一中(西校区)2020-2021学年高二上学期期中考试化学试题广东省广州市第八十九中学2020-2021学年高二上学期期中考试化学试题湖北省宜城市第三高级中学2020-2021学年高二上学期期中考试化学试题重庆市朝阳中学高2020-2021学年高二上学期期中考试化学试题北京东城区2019-2020学年高二下学期期中考试化学试题山东省淄博市高青县第一中学2021-2022学年高二上学期期中考试化学试题浙江省嘉兴市第五高级中学2021-2022学年高二上学期期中考试化学试题浙江省北斗联盟2022-2023学年高二上学期期中联考化学试题湖北省十堰市汉江中学2021-2022学年高二上学期期中考试化学试题广东省广州市广雅集团2023-2024学年高二上学期11月期中考试化学试题山东省烟台爱华高级中学2023-2024学年高二上学期期中考试化学试题(已下线)2011年河南省卫辉市第一中学高二1月月考化学试卷(已下线)2010—2011学年湖北省黄冈中学高二上学期期末考试化学试卷(已下线)2010-2011年云南省玉溪一中高二下学期期末考试化学试卷(已下线)2011-2012学年天津市青光中学高二第一学期期末考试化学试卷(已下线)2012-2013学年陕西省宝鸡中学高二下学期期末考试化学试卷(已下线)2013-2014学年贵州省遵义四中高二上学期期末考试化学试卷(已下线)2013-2014学年安徽省宿州市高二上学期期末考试化学试卷2014-2015学年河北省高阳中学高二12月月考化学试卷河北省永年县第二中学2017-2018学年高二12月月考化学试题【全国百强校】黑龙江省牡丹江市第一高级中学2018-2019学年高二(理)10月月考化学试题【全国百强校】贵州省思南中学2018-2019学年高二上学期第二次月考化学试题吉林省白城市第一中学2018-2019学年高一6月月考化学试题河北省邢台市第八中学2017-2018学年高二上学期期末考试化学试题安徽省阜阳市颍上二中2019-2020学年高二上学期第二次段考化学试题甘肃省永昌四中2019-2020学年高二上学期期末考试化学试题黑龙江省安达市第七中学2019-2020学年高二3月月考化学试题广东省珠海市北京师范大学珠海分校附属外国语学校2019-2020学年高二上学期期末考试化学试题(已下线)【南昌新东方】4. 莲塘一中 孙晖洪(已下线)全册综合检测(一)-2020-2021学年高二化学选择性必修1同步单元AB卷(新教材鲁科版)山东省烟台市中英文学校2020-2021学年高二10月月考化学试题新疆乌鲁木齐市第四中学2020-2021学年高二上学期期末考试化学试题宁夏青铜峡市高级中学2020-2021学年高二上学期期末考试化学试题云南省保山第九中学2021届高三上学期开学考试化学试题江苏省南京市中华中学2020-2021学年高二上学期9月测试化学试题(已下线)【浙江新东方】高中化学20210304-002北京市平谷区2021-2022学年高二上学期期末化学试题宁夏青铜峡市高级中学2021-2022学年高二上学期11月测试化学试题新疆乌苏市第一中学2021-2022学年高二12月月考化学试题甘肃省武威市凉州区2021-2022学年高二上学期期末考试化学试题新疆乌鲁木齐市第三十一中学2021-2022学年高二上学期期末考试化学试题 湖南省常德市西洞庭管理区第一中学2022-2023学年高二上学期第二次月考化学试题天津市河东区 2022-2023 学年高二上学期期末质量检测化学试题北京市清华大学附属中学2023-2024学年高二上学期第三单元化学统练青海省西宁市海湖中学2023-2024学年高二上学期第二次阶段考试化学试题天津北京师范大学静海附属学校2023-2024学年高二上学期第三次月考化学试题
13-14高二上·河南漯河·期中
2 . 可逆反应 进行过程中,当其他条件不变时,
进行过程中,当其他条件不变时, 的体积分数
的体积分数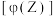 与温度
与温度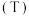 、压强
、压强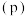 的关系如图所示。下列叙述正确的是
的关系如图所示。下列叙述正确的是
 进行过程中,当其他条件不变时,
进行过程中,当其他条件不变时, 的体积分数
的体积分数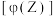 与温度
与温度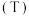 、压强
、压强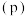 的关系如图所示。下列叙述正确的是
的关系如图所示。下列叙述正确的是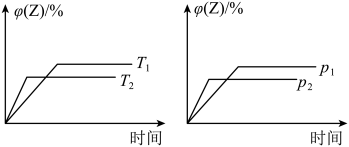
A.达到平衡后,加入催化剂, 的体积分数增大 的体积分数增大 |
| B.达到平衡后,升高温度,平衡向逆反应方向移动 |
C.化学方程式中,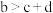 |
D.达到平衡后,增加 的量,平衡向正反应方向移动 的量,平衡向正反应方向移动 |
您最近一年使用:0次
2024-03-11更新
|
107次组卷
|
22卷引用:甘肃省岷县一中2018-2019学年高二上学期期中考试化学试题
甘肃省岷县一中2018-2019学年高二上学期期中考试化学试题(已下线)2013-2014学年河南省漯河市高二上学期期中考试化学试卷吉林省实验中学2017-2018学年高二上学期期中考试化学试题四川省自贡市田家炳中学2019-2020学年高二上学期期中考试化学试题广东省深圳市福田区外国语高级中学2021-2022学年高二上学期期中考试化学试题浙江省温州新力量联盟2021-2022学年高二上学期期中联考化学试题安徽省合肥市第一中学2022-2023学年高一下学期5月期中考试化学试题湖南省岳阳市岳阳县第一中学2023-2024学年高一下学期4月期中考试化学试题(已下线)2013-2014学年江苏省南师附中江宁分校高二上学期选修期末化学试卷河北省大名县第一中学2017-2018学年高二上学期第一次月考化学试题(已下线)解密10 化学反应速率与化学平衡(教师版)——备战2018年高考化学之高频考点解密江西省宜春市宜丰中学2018-2019学年高二上学期期末考试化学试题浙江省丽水四校联考2019年6月高二阶段性考试化学试题河北省沧州市泊头市第一中学2019-2020学年高二月考检测化学试题河北省泊头市第一中学2019-2020学年高二上学期期末模拟考试化学试卷黑龙江省哈尔滨师范大学青冈实验中学校2018-2019学年高二上学期开学考试化学试题湖北省华中师范大学潜江附属中学2019-2020学年高一5月月考化学试题新疆乌鲁木齐市第八中学2021-2022学年高二上学期第二次月考化学试题黑龙江省鹤岗市第一中学2021-2022学年高二上学期期末考试化学试题陕西省宝鸡市渭滨区2021-2022学年高二上学期期末考试化学试题浙江省东阳中学2021-2022学年高二下学期期末考试化学试题广东省佛山市顺德区勒流中学、均安中学、龙江中学等十五校2023-2024学年高二上学期12月联考化学试题
名校
3 . 2018年是哈伯因发明用氮气和氢气合成氨的方法而获得诺贝尔奖100周年。氨是重要的化学品之一,我国目前的生产能力位居世界首位,回答下列问题:
(1)工业上通常采用铁触媒作催化剂,在400℃~500℃、10~30MPa,原料气中 和
和 物质的量之比为1∶2.8的条件下合成氨。分析说明原料气中
物质的量之比为1∶2.8的条件下合成氨。分析说明原料气中 过量的理由是
过量的理由是___________ 。
(2)若在1L的密闭容器中,一定量的氮气和氢气进行如下反应:
 ,其化学平衡常数K与温度T的关系如表所示。
,其化学平衡常数K与温度T的关系如表所示。
①试比较 、
、 的大小,
的大小,
___________  (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
②400℃时,反应 的化学平衡常数为
的化学平衡常数为___________ 。
③400℃时, 反应中,当测得
反应中,当测得 、
、 和
和 物质的量分别为3mol、2mol和1mol时,则该反应
物质的量分别为3mol、2mol和1mol时,则该反应___________ (填“达到平衡状态”或“正向进行”或“逆向进行”)。
(3)在一定条件下,甲、乙体积相同的密闭容器中,开始均投入1mol 和3mol
和3mol 。相对于乙,甲容器中仅改变一个条件,测得甲、乙体积中
。相对于乙,甲容器中仅改变一个条件,测得甲、乙体积中 的转化率与时间关系如图所示。
的转化率与时间关系如图所示。

①相对于乙,甲改变的条件是___________ (填字母),判断依据是___________ 。
A.加入催化剂 B.升高温度 C.增大压强 D.分离氨
②在甲条件下,平衡时体积为0.5L,则该反应的平衡常数K为________ (结果保留两位有效数字)。
(1)工业上通常采用铁触媒作催化剂,在400℃~500℃、10~30MPa,原料气中
 和
和 物质的量之比为1∶2.8的条件下合成氨。分析说明原料气中
物质的量之比为1∶2.8的条件下合成氨。分析说明原料气中 过量的理由是
过量的理由是(2)若在1L的密闭容器中,一定量的氮气和氢气进行如下反应:

 ,其化学平衡常数K与温度T的关系如表所示。
,其化学平衡常数K与温度T的关系如表所示。| T/℃ | 200 | 300 | 400 |
| K |  |  | 0.5 |
 、
、 的大小,
的大小,
 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。②400℃时,反应
 的化学平衡常数为
的化学平衡常数为③400℃时,
 反应中,当测得
反应中,当测得 、
、 和
和 物质的量分别为3mol、2mol和1mol时,则该反应
物质的量分别为3mol、2mol和1mol时,则该反应(3)在一定条件下,甲、乙体积相同的密闭容器中,开始均投入1mol
 和3mol
和3mol 。相对于乙,甲容器中仅改变一个条件,测得甲、乙体积中
。相对于乙,甲容器中仅改变一个条件,测得甲、乙体积中 的转化率与时间关系如图所示。
的转化率与时间关系如图所示。
①相对于乙,甲改变的条件是
A.加入催化剂 B.升高温度 C.增大压强 D.分离氨
②在甲条件下,平衡时体积为0.5L,则该反应的平衡常数K为
您最近一年使用:0次
2023-11-05更新
|
167次组卷
|
2卷引用:甘肃省定西市临洮中学2023-2024学年高二上学期期中考试化学试题
名校
4 . 某学生通过测定反应过程中所放出的热量来计算中和反应的反应热,将50mL0.5 的盐酸与50mL0.55
的盐酸与50mL0.55 的NaOH溶液在如图所示的装置中进行中和反应(在稀溶液中,可以近似地认为酸、碱的密度、比热容与水的相等)。回答下列问题:
的NaOH溶液在如图所示的装置中进行中和反应(在稀溶液中,可以近似地认为酸、碱的密度、比热容与水的相等)。回答下列问题:
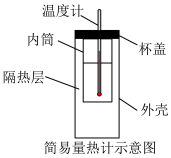
(1)从实验装置上看,图中缺少的一种玻璃仪器是___________ ,其作用是___________ 。
(2)实验数据如表所示:
①请填写表格中的空白:
②根据上表中所测数据进行计算,则该实验测得的中和热
________ [计算结果保留三位有效数字,所用盐酸和NaOH溶液的密度按1 计算,反应后混合溶液的比热容(c)按4.18J/(g·℃)计算]。
计算,反应后混合溶液的比热容(c)按4.18J/(g·℃)计算]。
(3)简易量热计如果不盖杯盖,生成1mol (l)时所测得中和反应反应热(△H)将
(l)时所测得中和反应反应热(△H)将___________ (填“偏大”“偏小”或“不变”),判断的理由是___________ 。
(4)实验中改用80mL0.50 的盐酸和80mL0.55
的盐酸和80mL0.55 的NaOH溶液进行反应,与上述实验相比,二者所放出的热量
的NaOH溶液进行反应,与上述实验相比,二者所放出的热量___________ (填“相等”或“不相等”)。
 的盐酸与50mL0.55
的盐酸与50mL0.55 的NaOH溶液在如图所示的装置中进行中和反应(在稀溶液中,可以近似地认为酸、碱的密度、比热容与水的相等)。回答下列问题:
的NaOH溶液在如图所示的装置中进行中和反应(在稀溶液中,可以近似地认为酸、碱的密度、比热容与水的相等)。回答下列问题:
(1)从实验装置上看,图中缺少的一种玻璃仪器是
(2)实验数据如表所示:
①请填写表格中的空白:
| 实验次数 | 起始温度 /℃ /℃ | 终止温度 /℃ /℃ | 温度差平均值 /℃ /℃ | |
| 盐酸 | NaOH溶液 | |||
| 1 | 20.2 | 20.3 | 23.7 | |
| 2 | 20.3 | 20.5 | 23.8 | |
| 3 | 21.5 | 21.6 | 24.9 | |
| 4 | 21.2 | 21.4 | 26.3 | |

 计算,反应后混合溶液的比热容(c)按4.18J/(g·℃)计算]。
计算,反应后混合溶液的比热容(c)按4.18J/(g·℃)计算]。(3)简易量热计如果不盖杯盖,生成1mol
 (l)时所测得中和反应反应热(△H)将
(l)时所测得中和反应反应热(△H)将(4)实验中改用80mL0.50
 的盐酸和80mL0.55
的盐酸和80mL0.55 的NaOH溶液进行反应,与上述实验相比,二者所放出的热量
的NaOH溶液进行反应,与上述实验相比,二者所放出的热量
您最近一年使用:0次
2023-11-05更新
|
49次组卷
|
2卷引用:甘肃省定西市临洮中学2023-2024学年高二上学期期中考试化学试题
名校
5 . 2030年前实现碳达峰的承诺,体现了中国的大国风范。天然气的综合利用是各国科学家研究的重要课题。
(1)天然气的主要成分为甲烷,甲烷的结构式是___________ ,甲烷燃烧反应过程中的能量变化,符合下图中的___________ (填字母)。
a.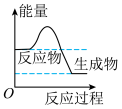 b.
b.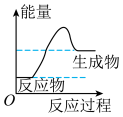 c.
c.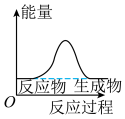
(2)ag 燃烧生成二氧化碳气体和液态水,放出热量44.5kJ。经测定,生成的
燃烧生成二氧化碳气体和液态水,放出热量44.5kJ。经测定,生成的 与足量澄清石灰水反应得到5g沉淀,则
与足量澄清石灰水反应得到5g沉淀,则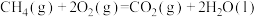

___________  ,其中
,其中
___________ 。
(3)甲烷和二氧化碳重整制合成气的研究是实现碳达峰的手段之一、甲烷和二氧化碳重整制合成气的反应为

副反应I:
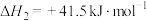
副反应Ⅱ:

已知:部分化学键键能数据如下表(1molCO中含有1molC≡O键)。
则
___________  ,
,
___________  。
。
(4)用 催化还原
催化还原 可以消除氮氧化物的污染。例如:
可以消除氮氧化物的污染。例如:

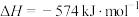
 △
△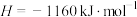
若标准状况下用1.12L 还原
还原 至
至 ,整个过程中转移电子总数为
,整个过程中转移电子总数为___________ (阿伏加德罗常数的值用 表示),放出的热量为
表示),放出的热量为___________ kJ。
(1)天然气的主要成分为甲烷,甲烷的结构式是
a.
 b.
b. c.
c.
(2)ag
 燃烧生成二氧化碳气体和液态水,放出热量44.5kJ。经测定,生成的
燃烧生成二氧化碳气体和液态水,放出热量44.5kJ。经测定,生成的 与足量澄清石灰水反应得到5g沉淀,则
与足量澄清石灰水反应得到5g沉淀,则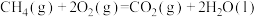

 ,其中
,其中
(3)甲烷和二氧化碳重整制合成气的研究是实现碳达峰的手段之一、甲烷和二氧化碳重整制合成气的反应为


副反应I:

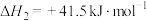
副反应Ⅱ:


已知:部分化学键键能数据如下表(1molCO中含有1molC≡O键)。
| 化学键 | C-H | C=O | H-H | C≡O |
键能/( ) ) | 413 | 745 | 436 | 1011 |

 ,
,
 。
。(4)用
 催化还原
催化还原 可以消除氮氧化物的污染。例如:
可以消除氮氧化物的污染。例如:
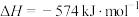
 △
△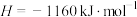
若标准状况下用1.12L
 还原
还原 至
至 ,整个过程中转移电子总数为
,整个过程中转移电子总数为 表示),放出的热量为
表示),放出的热量为
您最近一年使用:0次
2023-11-05更新
|
100次组卷
|
4卷引用:甘肃省定西市临洮中学2023-2024学年高二上学期期中考试化学试题
名校
6 . 在容积为2L的密闭容器中发生反应: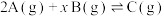 。图甲表示200℃时容器中A、B、C物质的量随时间的变化,图乙表示温度100℃和200℃平衡时C的体积分数随起始
。图甲表示200℃时容器中A、B、C物质的量随时间的变化,图乙表示温度100℃和200℃平衡时C的体积分数随起始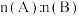 的变化关系,下列说法正确的是
的变化关系,下列说法正确的是

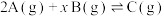 。图甲表示200℃时容器中A、B、C物质的量随时间的变化,图乙表示温度100℃和200℃平衡时C的体积分数随起始
。图甲表示200℃时容器中A、B、C物质的量随时间的变化,图乙表示温度100℃和200℃平衡时C的体积分数随起始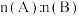 的变化关系,下列说法正确的是
的变化关系,下列说法正确的是
A.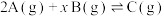 中, 中, |
B.200℃,反应从开始到平衡的平均速率 |
C.由图乙可知,反应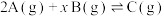 的 的 ,且 ,且 |
| D.当外界条件由200℃降温到100℃,原平衡一定被破坏,且正、逆反应速率均增大 |
您最近一年使用:0次
2023-11-05更新
|
165次组卷
|
2卷引用:甘肃省定西市临洮中学2023-2024学年高二上学期期中考试化学试题
名校
7 . 一定温度下,10mL0.8
 溶液发生催化分解。不同时刻测得生成的
溶液发生催化分解。不同时刻测得生成的 的体积(已折算为标准状况下)如表。
的体积(已折算为标准状况下)如表。
下列叙述正确的是(溶液体积变化忽略不计)

 溶液发生催化分解。不同时刻测得生成的
溶液发生催化分解。不同时刻测得生成的 的体积(已折算为标准状况下)如表。
的体积(已折算为标准状况下)如表。| t/min | 0 | 2 | 4 | 6 | 8 | 10 |
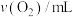 | 0.0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.9 |
A.反应到6min时,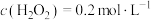 |
| B.第4min时的瞬时速率小于第6min时的瞬时速率 |
C.反应至6min时, 分解率为50% 分解率为50% |
D.0~6min的平均反应速率: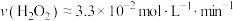 |
您最近一年使用:0次
2023-11-05更新
|
218次组卷
|
4卷引用:甘肃省定西市临洮中学2023-2024学年高二上学期期中考试化学试题
甘肃省定西市临洮中学2023-2024学年高二上学期期中考试化学试题甘肃省酒泉市四校联考2023-2024学年高二上学期11月期中化学试题(已下线)期中测试卷一【测试范围:第五、六章】-2023-2024学年高一化学下学期期中考点大串讲(人教版2019必修第二册)河南省新乡市原阳县第一高级中学2023-2024学年高一下学期4月月考化学试题
名校
解题方法
8 . 标准状态下,气态反应物和生成物的相对能量与反应历程示意图如下,已知 (g)和
(g)和 (g)的相对能量为0,下列说法不正确的是
(g)的相对能量为0,下列说法不正确的是

 (g)和
(g)和 (g)的相对能量为0,下列说法不正确的是
(g)的相对能量为0,下列说法不正确的是
A.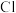 (g)在历程Ⅱ中作催化剂 (g)在历程Ⅱ中作催化剂 |
B.相同条件下, 的平衡转化率:历程Ⅱ>历程I 的平衡转化率:历程Ⅱ>历程I |
C.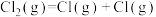 的 的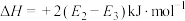 |
D.历程I、历程Ⅱ中速率最快的一步反应的热化学方程式为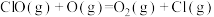  |
您最近一年使用:0次
2023-11-05更新
|
154次组卷
|
4卷引用:甘肃省定西市临洮中学2023-2024学年高二上学期期中考试化学试题
名校
9 . 下列表格中对实验操作和实验现象所做的解释或结论错误的是选项
| 选项 | 实验操作 | 实验现象 | 解释或结论 |
| A | 将装有红棕色 气体的注射器由10mL压缩至5mL 气体的注射器由10mL压缩至5mL | 压缩后的气体颜色比压缩前的深 |  平衡向左移动 平衡向左移动 |
| B | 向含有 的红色溶液中加入少量铁粉,振荡静置 的红色溶液中加入少量铁粉,振荡静置 | 溶液红色变浅 |  平衡向左移动 平衡向左移动 |
| C | 给2mL0.5  溶液加热 溶液加热 | 溶液变为黄绿色 | 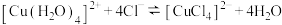 该反应 该反应 |
| D | 向2mL0.1  溶液中滴加5~10滴6 溶液中滴加5~10滴6 NaOH溶液 NaOH溶液 | 溶液变为黄色 |  平衡向右移动 平衡向右移动 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-11-05更新
|
100次组卷
|
3卷引用:甘肃省定西市临洮中学2023-2024学年高二上学期期中考试化学试题
名校
解题方法
10 . 某同学设计以下实验探究外界条件对化学反应速率的影响,已知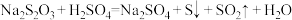 。下列说法错误的是
。下列说法错误的是
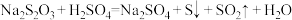 。下列说法错误的是
。下列说法错误的是| 组号 | 反应温度/℃ | Na2S2O3 | H2SO4 | H2O | 开始出现浑浊的时间/s | ||
| V/mL | 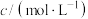 | V/mL | 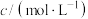 | V/mL | |||
| I | 10 | 10 | 0.1 | 10 | 0.1 | 0 |  |
| II | 10 | 5 | 0.1 | 10 | 0.1 | x |  |
| III | 20 | 10 | 0.1 | 10 | 0.1 | y |  |
| IV | 20 | 10 | 0.2 | 10 | 0.1 | z |  |
A. 、 、 、 、 |
B. |
| C.实验III、IV可用于探究浓度对化学反应速率的影响 |
| D.实验I、III可用于探究温度对化学反应速率的影响 |
您最近一年使用:0次
2023-11-05更新
|
95次组卷
|
2卷引用:甘肃省定西市临洮中学2023-2024学年高二上学期期中考试化学试题



