名校
解题方法
1 . 第112号化学元素元素符号为“Cn”,以纪念著名天文学家哥白尼,该元素的一种核素含有的中子数为165。下列关于Cn的说法不正确 的是
| A.Cn是第七周期元素 | B.Cn属于ds区元素 |
| C.Cn是金属元素 | D.Cn的一种核素可表示为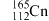 |
您最近一年使用:0次
2024-05-06更新
|
29次组卷
|
3卷引用:甘肃省定西市临洮中学2023-2024学年高二下学期3月第一次考试化学试题
甘肃省定西市临洮中学2023-2024学年高二下学期3月第一次考试化学试题黑龙江省绥化市绥棱县第一中学2023-2024学年高二上学期1月期末化学试题(已下线)1.2.1 原子结构与元素周期表课堂例题
名校
2 . 用激光将置于铁室中石墨靶上的碳原子炸松,同时用射频电火花喷射氮气,此时碳、氮原子结合成碳氮化合物薄膜,这种化合物可以比金刚石更坚硬,其原因可能是
| A.碳、氮原子构成具有共价键三维骨架结构的共价晶体 |
| B.该晶体为分子晶体 |
| C.碳氮键的键长比金刚石中碳碳键的键长长 |
| D.氮原子最外层电子数比碳原子最外层电子数多 |
您最近一年使用:0次
名校
解题方法
3 . 碱金属及其化合物在科学研究、生产生活中有广泛应用。请回答下列问题:
(1)基态钠原子核外电子占据能级数为________ ,核外电子共有________ 种不同的运动状态。
(2)与K同周期的元素中,最外层电子数与K相同的为________ (写元素符号)。
(3)在同周期元素中,碱金属元素的________ (填“电负性”“原子半径”或“第一电离能”)最小。
(4)氢化钠晶胞类似氯化钠晶胞(晶胞结构如图1所示)。设氢化钠晶体中钠离子半径为 ,氢离子半径为
,氢离子半径为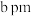 ,并且它们在晶体中紧密堆积,则氢化钠晶胞中离子的空间利用率为
,并且它们在晶体中紧密堆积,则氢化钠晶胞中离子的空间利用率为________ 。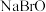 、
、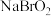 、
、 、
、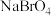 四种钠盐中,Br的杂化方式均为
四种钠盐中,Br的杂化方式均为________ 。
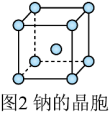
(6)钠晶胞结构如图2所示,配位数为________ 。若钠晶胞的边长为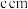 ,
, 代表阿伏加德罗常数的值,则钠晶体的密度为
代表阿伏加德罗常数的值,则钠晶体的密度为________  。
。
(1)基态钠原子核外电子占据能级数为
(2)与K同周期的元素中,最外层电子数与K相同的为
(3)在同周期元素中,碱金属元素的
(4)氢化钠晶胞类似氯化钠晶胞(晶胞结构如图1所示)。设氢化钠晶体中钠离子半径为
 ,氢离子半径为
,氢离子半径为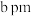 ,并且它们在晶体中紧密堆积,则氢化钠晶胞中离子的空间利用率为
,并且它们在晶体中紧密堆积,则氢化钠晶胞中离子的空间利用率为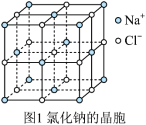
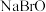 、
、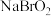 、
、 、
、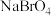 四种钠盐中,Br的杂化方式均为
四种钠盐中,Br的杂化方式均为(6)钠晶胞结构如图2所示,配位数为
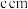 ,
, 代表阿伏加德罗常数的值,则钠晶体的密度为
代表阿伏加德罗常数的值,则钠晶体的密度为 。
。
您最近一年使用:0次
名校
解题方法
4 . 锗(Ge)是典型的半导体元素,在电子、材料等领域应用广泛。回答下列问题:
(1)基态Ge原子的核外电子排布式为[Ar]________ ,有________ 个未成对电子。
(2)Ge与C是同族元素,C原子之间可以形成双键、三键,但Ge原子之间难以形成双键或三键。从原子结构角度分析,原因是__________________ 。
(3)比较下列锗卤化物的熔点和沸点,分析其变化规律及原因___________________ 。
(4)光催化还原 制备
制备 反应中,带状纳米
反应中,带状纳米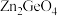 是该反应的良好催化剂。Zn、Ge、O电负性由大至小的顺序是
是该反应的良好催化剂。Zn、Ge、O电负性由大至小的顺序是________________ 。
(5) 分子的空间构形为
分子的空间构形为________ ,其中Ge原子的杂化方式为________ 。
(1)基态Ge原子的核外电子排布式为[Ar]
(2)Ge与C是同族元素,C原子之间可以形成双键、三键,但Ge原子之间难以形成双键或三键。从原子结构角度分析,原因是
(3)比较下列锗卤化物的熔点和沸点,分析其变化规律及原因
 | 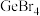 | 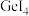 | |
| 熔点/℃ | 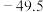 | 26 | 146 |
| 沸点/℃ | 83.1 | 186 | 约400 |
 制备
制备 反应中,带状纳米
反应中,带状纳米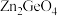 是该反应的良好催化剂。Zn、Ge、O电负性由大至小的顺序是
是该反应的良好催化剂。Zn、Ge、O电负性由大至小的顺序是(5)
 分子的空间构形为
分子的空间构形为
您最近一年使用:0次
名校
5 . 共价键、金属键、离子键和分子间作用力都是构成物质粒子间的作用力,含有以上所说的两种作用力的晶体是
A. 晶体 晶体 | B.铁晶体 | C. 晶体 晶体 | D. 晶体 晶体 |
您最近一年使用:0次
名校
6 . 回答下列问题:
(1)新型固体燃料电池的电解质是体氧化锆和氧化钇,高温下允许氧离子( )在其间通过。如图所示,其中多孔电极不参与电极反应。写出该反应的负极电极反应式:
)在其间通过。如图所示,其中多孔电极不参与电极反应。写出该反应的负极电极反应式:____________ ,当有16g甲醇发生反应时,则理论上提供的电量表达式为______ (1个电子的电量为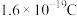 )。
)。____________ ,若过程中产生 ,则消耗标准状况下
,则消耗标准状况下 的体积为
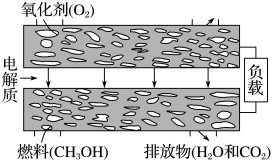
的体积为______ L。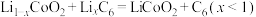 。负极电极反应式:
。负极电极反应式:____________ 。
(4)以 为燃料可以设计甲烷燃料电池,该电池以稀
为燃料可以设计甲烷燃料电池,该电池以稀 作电解质溶液,写出该电池正极电极反应式:
作电解质溶液,写出该电池正极电极反应式:____________ 。
(1)新型固体燃料电池的电解质是体氧化锆和氧化钇,高温下允许氧离子(
 )在其间通过。如图所示,其中多孔电极不参与电极反应。写出该反应的负极电极反应式:
)在其间通过。如图所示,其中多孔电极不参与电极反应。写出该反应的负极电极反应式: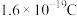 )。
)。
 ,则消耗标准状况下
,则消耗标准状况下 的体积为
的体积为
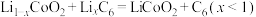 。负极电极反应式:
。负极电极反应式:(4)以
 为燃料可以设计甲烷燃料电池,该电池以稀
为燃料可以设计甲烷燃料电池,该电池以稀 作电解质溶液,写出该电池正极电极反应式:
作电解质溶液,写出该电池正极电极反应式:
您最近一年使用:0次
名校
7 . 硫元素是动植物生长不可缺少的元素,图1是自然界中硫元素的存在示意图。图2是硫元素的常见化合价与部分物质类别的对应关系,回答下列问题。____________ 。
(2)X与Y能发生反应,还原剂与氧化剂的物质的量之比为______ 。
(3) 溶液易变质,实验室检验
溶液易变质,实验室检验 溶液是否变质的基本操作是
溶液是否变质的基本操作是____________ 。
(4)硫酸是用途广泛的化工原料,可作脱水剂,吸水剂、氧化剂和催化剂等。甲、乙两位同学用铜和硫酸为原料,设计了两种制取硫酸铜的方案。
方案甲:铜与浓硫酸加热直接反应,即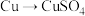
方案乙:由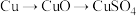
①方案甲中铜和浓硫酸反应的化学方程式是____________ 。该反应体现了浓硫酸的____________ 。
②这两种方案,你认为哪一种方案更合理?______ ,理由是____________ 。

(2)X与Y能发生反应,还原剂与氧化剂的物质的量之比为
(3)
 溶液易变质,实验室检验
溶液易变质,实验室检验 溶液是否变质的基本操作是
溶液是否变质的基本操作是(4)硫酸是用途广泛的化工原料,可作脱水剂,吸水剂、氧化剂和催化剂等。甲、乙两位同学用铜和硫酸为原料,设计了两种制取硫酸铜的方案。
方案甲:铜与浓硫酸加热直接反应,即
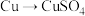
方案乙:由
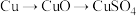
①方案甲中铜和浓硫酸反应的化学方程式是
②这两种方案,你认为哪一种方案更合理?
您最近一年使用:0次
名校
解题方法
8 . 我国著名化工实业家侯德榜提出了“联合制碱法”,该生产工艺流程如图所示。下列说法不正确 的是
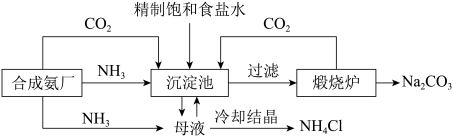
A.沉淀池发生反应: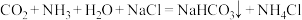 |
B.向饱和食盐水先通 ,再通 ,再通 ,更有利于 ,更有利于 析出 析出 |
C.该过程充分利用了合成氨提供的 和 和 |
D.吸收 可使母液中的 可使母液中的 转化为 转化为 ,以提高 ,以提高 纯度 纯度 |
您最近一年使用:0次
9 . 回答下列问题:
(1)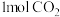 中含有的
中含有的 键数目为
键数目为___________ , 键数目为
键数目为___________ 。
(2)已知CO和 与
与 结构相似,CO分子内
结构相似,CO分子内 键与
键与 键个数之比为
键个数之比为___________ 。 分子中
分子中 键与
键与 键数目之比为
键数目之比为___________ 。
(3)肼 分子可视为
分子可视为 分子中的一个氢原子被
分子中的一个氢原子被 (氨基)取代形成的另一种氮的氢化物。肼可用作火箭燃料,燃烧时发生的反应:
(氨基)取代形成的另一种氮的氢化物。肼可用作火箭燃料,燃烧时发生的反应:
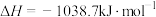 ,若该反应中有
,若该反应中有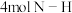 键断裂,则形成的
键断裂,则形成的 键有
键有___________ mol。
(4)Co基态原子核外电子排布式为___________ ; 的价电子轨道表示式为
的价电子轨道表示式为___________ ; 核外电子未成对电子数为
核外电子未成对电子数为___________ 。
(5) 、
、 、
、 、
、 分子中共价键的极性由强到弱的顺序是
分子中共价键的极性由强到弱的顺序是___________ 。
(1)
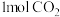 中含有的
中含有的 键数目为
键数目为 键数目为
键数目为(2)已知CO和
 与
与 结构相似,CO分子内
结构相似,CO分子内 键与
键与 键个数之比为
键个数之比为 分子中
分子中 键与
键与 键数目之比为
键数目之比为(3)肼
 分子可视为
分子可视为 分子中的一个氢原子被
分子中的一个氢原子被 (氨基)取代形成的另一种氮的氢化物。肼可用作火箭燃料,燃烧时发生的反应:
(氨基)取代形成的另一种氮的氢化物。肼可用作火箭燃料,燃烧时发生的反应:
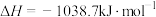 ,若该反应中有
,若该反应中有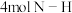 键断裂,则形成的
键断裂,则形成的 键有
键有(4)Co基态原子核外电子排布式为
 的价电子轨道表示式为
的价电子轨道表示式为 核外电子未成对电子数为
核外电子未成对电子数为(5)
 、
、 、
、 、
、 分子中共价键的极性由强到弱的顺序是
分子中共价键的极性由强到弱的顺序是
您最近一年使用:0次
2024-04-27更新
|
60次组卷
|
2卷引用:甘肃省定西市临洮中学2023-2024学年高二下学期3月第一次考试化学试题
10 . 按要求回答下列问题:
(1)已知A和B为第三周期元素,其第一至第四电离能如表所示:
A通常显___________ 价,B的基态原子核外电子排布式为___________ 。
(2)如图为元素周期表中部分元素某种性质(X值)随原子序数变化的关系:___________ (填元素符号)。
②同主族内不同元素的X值变化的特点是___________ ;同周期内,随着原子序数的增大,X值的变化总趋势是___________ 。周期表中X值的这种变化特点体现了元素性质的___________ 变化规律。
③X值较小的元素集中在元素周期表的___________ (填字母)。
a.左下角 b.右上角 c.分界线附近
④下列关于元素此性质的说法正确的是___________ (填字母)。
a.X值可反映元素最高正化合价的变化规律
b.X值可反映原子在分子中吸引电子的能力
c.X值的大小可用来衡量元素金属性和非金属性的强弱
(1)已知A和B为第三周期元素,其第一至第四电离能如表所示:
电离能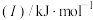 |  | 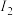 | 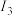 | 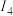 |
| A | 578 | 1817 | 2745 | 11578 |
| B | 738 | 1451 | 7733 | 10540 |
(2)如图为元素周期表中部分元素某种性质(X值)随原子序数变化的关系:
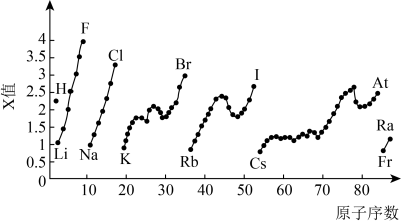
②同主族内不同元素的X值变化的特点是
③X值较小的元素集中在元素周期表的
a.左下角 b.右上角 c.分界线附近
④下列关于元素此性质的说法正确的是
a.X值可反映元素最高正化合价的变化规律
b.X值可反映原子在分子中吸引电子的能力
c.X值的大小可用来衡量元素金属性和非金属性的强弱
您最近一年使用:0次
2024-04-27更新
|
34次组卷
|
2卷引用:甘肃省定西市临洮中学2023-2024学年高二下学期3月第一次考试化学试题



