解题方法
1 . 下列有关物质结构与性质的说法正确的是
A. 和 和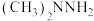 中C、O、N杂化方式均相同 中C、O、N杂化方式均相同 |
| B.含有手性碳原子的分子叫做手性分子 |
| C.NaClO和NaCl均为离子化合物,他们所含的化学键类型相同 |
D. 的空间结构为V形 的空间结构为V形 |
您最近一年使用:0次
解题方法
2 . 2023年9月23日晚,第19届亚运会在杭州开幕。下列有关说法错误的是
| A.火炬“薪火”使用的铝合金熔点比纯铝低 |
| B.“亚运莲花尊”的青瓷是以黏土为主要原料,经高温烧结而成 |
| C.会馆使用的防滑剂主要成分石墨烯与乙烯互为同系物 |
| D.主火炬塔的燃料首次使用废碳再生的绿色甲醇,有利于实现碳中和 |
您最近一年使用:0次
名校
3 . 已知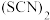 为拟卤素,性质与卤素类似。老师将学生分为四组,做如下探究实验:甲组:分别配制500mL
为拟卤素,性质与卤素类似。老师将学生分为四组,做如下探究实验:甲组:分别配制500mL KSCN溶液、
KSCN溶液、 溶液;乙组:向
溶液;乙组:向 的KSCN溶液中滴加酸性
的KSCN溶液中滴加酸性 溶液,酸性
溶液,酸性 溶液褪色;丙组:向
溶液褪色;丙组:向 的
的 溶液中滴加酸性
溶液中滴加酸性 溶液,酸性
溶液,酸性 溶液褪色;丁组:分别取50mL
溶液褪色;丁组:分别取50mL KSCN溶液和50mL
KSCN溶液和50mL
 溶液,混合,向混合液中滴加酸性
溶液,混合,向混合液中滴加酸性 溶液,溶液先变红后褪色,下列说法
溶液,溶液先变红后褪色,下列说法错误 的是
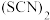 为拟卤素,性质与卤素类似。老师将学生分为四组,做如下探究实验:甲组:分别配制500mL
为拟卤素,性质与卤素类似。老师将学生分为四组,做如下探究实验:甲组:分别配制500mL KSCN溶液、
KSCN溶液、 溶液;乙组:向
溶液;乙组:向 的KSCN溶液中滴加酸性
的KSCN溶液中滴加酸性 溶液,酸性
溶液,酸性 溶液褪色;丙组:向
溶液褪色;丙组:向 的
的 溶液中滴加酸性
溶液中滴加酸性 溶液,酸性
溶液,酸性 溶液褪色;丁组:分别取50mL
溶液褪色;丁组:分别取50mL KSCN溶液和50mL
KSCN溶液和50mL
 溶液,混合,向混合液中滴加酸性
溶液,混合,向混合液中滴加酸性 溶液,溶液先变红后褪色,下列说法
溶液,溶液先变红后褪色,下列说法| A.甲组同学用到500mL容量瓶、玻璃棒、烧杯、胶头滴管等玻璃仪器 |
B.乙组实验中 将 将 氧化为 氧化为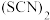 |
C.丙组实验发生反应的离子方程式: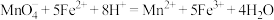 |
D.丁组实验说明还原性: |
您最近一年使用:0次
7日内更新
|
184次组卷
|
4卷引用:2024届山西省晋中市和诚高中高三下学期理综冲刺卷(二)-高中化学
4 . 乙醛(CH3CHO)是一种常见的有机物,在生产、生活中用途广泛。回答下列问题:
(1)已知:①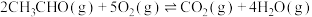 ;ΔH1
;ΔH1
② ;ΔH2
;ΔH2
③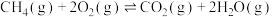 ;ΔH3
;ΔH3
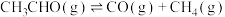 ;ΔH=
;ΔH=___________ (用含ΔH1、ΔH2、ΔH3的代数式表示)。
(2)在镍催化下,乙醛与氢气反应生成乙醇。在恒温恒容反应器中充入一定量CH3CHO(g)和H2(g)发生反应:下列叙述错误的是___________(填标号)。
(3)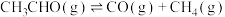 速率方程v=kcn(CH3CHO)(k为速率常数,只与温度、催化剂有关;n为反应级数)。
速率方程v=kcn(CH3CHO)(k为速率常数,只与温度、催化剂有关;n为反应级数)。
①阿伦尼乌斯就关于速率常数与活化能(Ea)、温度(T)的关系提出经验关系式:Rlnk=-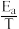 (R为常数,k为速率常数,Ea为活化能,T为温度)。一定温度下,在Cat1、Cat2(催化剂)作用下,Rlnk与
(R为常数,k为速率常数,Ea为活化能,T为温度)。一定温度下,在Cat1、Cat2(催化剂)作用下,Rlnk与 关系如图所示。催化剂效能较高的是
关系如图所示。催化剂效能较高的是___________ (填“Cat1”或“Cat2”),判断依据是___________ 。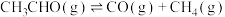 在一系列不同浓度时的初始反应速率数据如下:
在一系列不同浓度时的初始反应速率数据如下:
已知:一步进行的反应称为基元反应,基元反应中反应级数等于反应物的化学计量数之和。下列叙述正确的是___________ (填标号)。
A.该总反应为二级反应
B.速率常数k=4.00L·mol-1·s-1
C.上述反应不是基元反应
D.t(CH3CHO)=0.15mol·L-1时v=0.45mol·L-1·s-1
(4)一定温度下,保持总压强为pkPa,向反应器充入CH3CHO(g)和N2的混合气体(N2不参与反应)发生反应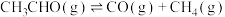 ,测得CH3CHO平衡转化率与起始投料比[n(CH3CHO)/n(N2)]的关系如图所示。
,测得CH3CHO平衡转化率与起始投料比[n(CH3CHO)/n(N2)]的关系如图所示。___________ 。该温度下,上述反应M点平衡常数Kp=___________ kPa(Kp用分压计算的平衡常数,分压=总压×物质的量分数)。
(5)T℃时,向反应器充入一定量CH3CHO(g)发生反应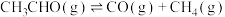 ,测得单位时间内CH3CHO转化率与压强关系如图所示。解释p=3MPa时CH3CHO的转化率达到峰值的原因:
,测得单位时间内CH3CHO转化率与压强关系如图所示。解释p=3MPa时CH3CHO的转化率达到峰值的原因:___________ 。
(1)已知:①
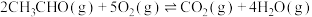 ;ΔH1
;ΔH1②
 ;ΔH2
;ΔH2③
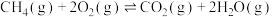 ;ΔH3
;ΔH3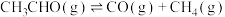 ;ΔH=
;ΔH=(2)在镍催化下,乙醛与氢气反应生成乙醇。在恒温恒容反应器中充入一定量CH3CHO(g)和H2(g)发生反应:下列叙述错误的是___________(填标号)。
| A.气体压强不随时间变化时达到平衡状态 |
| B.平衡后充入氖气,平衡向逆反应方向移动 |
| C.上述可逆反应的正反应是熵增反应 |
| D.平衡后,充入少量H2,CH3CHO平衡转化率增大 |
(3)
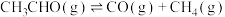 速率方程v=kcn(CH3CHO)(k为速率常数,只与温度、催化剂有关;n为反应级数)。
速率方程v=kcn(CH3CHO)(k为速率常数,只与温度、催化剂有关;n为反应级数)。①阿伦尼乌斯就关于速率常数与活化能(Ea)、温度(T)的关系提出经验关系式:Rlnk=-
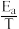 (R为常数,k为速率常数,Ea为活化能,T为温度)。一定温度下,在Cat1、Cat2(催化剂)作用下,Rlnk与
(R为常数,k为速率常数,Ea为活化能,T为温度)。一定温度下,在Cat1、Cat2(催化剂)作用下,Rlnk与 关系如图所示。催化剂效能较高的是
关系如图所示。催化剂效能较高的是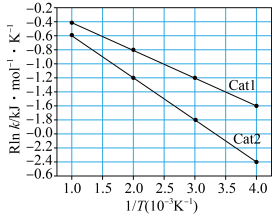
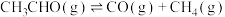 在一系列不同浓度时的初始反应速率数据如下:
在一系列不同浓度时的初始反应速率数据如下:| c(CH3CHO)/mol·L-1 | 0.1 | 0.2 | 0.3 | 0.4 |
| v/mol·L-1·s-1 | 0.020 | 0.080 | 0.182 | 0.318 |
A.该总反应为二级反应
B.速率常数k=4.00L·mol-1·s-1
C.上述反应不是基元反应
D.t(CH3CHO)=0.15mol·L-1时v=0.45mol·L-1·s-1
(4)一定温度下,保持总压强为pkPa,向反应器充入CH3CHO(g)和N2的混合气体(N2不参与反应)发生反应
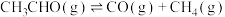 ,测得CH3CHO平衡转化率与起始投料比[n(CH3CHO)/n(N2)]的关系如图所示。
,测得CH3CHO平衡转化率与起始投料比[n(CH3CHO)/n(N2)]的关系如图所示。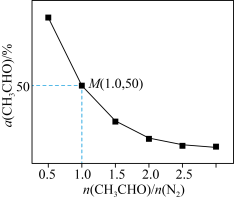
(5)T℃时,向反应器充入一定量CH3CHO(g)发生反应
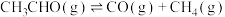 ,测得单位时间内CH3CHO转化率与压强关系如图所示。解释p=3MPa时CH3CHO的转化率达到峰值的原因:
,测得单位时间内CH3CHO转化率与压强关系如图所示。解释p=3MPa时CH3CHO的转化率达到峰值的原因: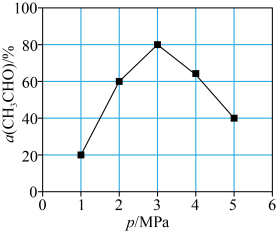
您最近一年使用:0次
解题方法
5 . 乙酸正丁酯是优良的有机溶剂,在石油加工、制药工程等领域均有广泛应用。在实验室中,乙酸正丁酯可通过正丁醇和冰醋酸在强酸催化及加热条件下合成,实验装置如图所示。反应中生成的水可以与正丁醇或乙酸正丁酯形成共沸混合物被蒸出。使用分水器可在反应进行的同时分离出生成的水,并使有机相流回反应瓶中。实验步骤如下:
②关闭分水器旋塞,并在分水器带旋塞的一侧预先加入适量的水,再向反应装置中依次加入5mL(55mmol)正丁醇、3.4mL(60mmol)冰醋酸和0.05mL浓硫酸,加入一粒沸石。
③将反应液温度控制在T1℃并保持15分钟,然后升温至回流状态。当___________,停止加热。将分水器中的液体导入分液漏斗中,将水层分出。
④依次用5mL水、5mL10%碳酸钠溶液、5mL水洗涤有机层。
⑤有机层用无水硫酸镁干燥。常压蒸馏,在T2℃时收集馏分。
已知各化合物及相关共沸物在常压下的沸点如下表所示:
回答下列问题:
(1)仪器A的名称为___________ ;仪器B中进水口为___________ (填“a”或“b”)。
(2)正丁醇的密度为___________ g·cm-3。
(3)步骤③中停止加热的标志是___________ 。
(4)T1和T2的范围分别是___________ (填标号)。
a.T1>90℃,T2>120℃ b.T1>90℃,T2<12℃
c.T1<90℃,T2>120℃ d.T1<90℃,T2<120℃
(5)冰醋酸略过量的原因是___________ ,若最终得到产品的质量为5.12g,测得纯度为98%,则反应的产率为___________ (结果保留一位小数)。
(6)步骤③中,有一处操作明显错误使得产率降低,正确做法是___________ 。
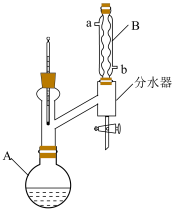
②关闭分水器旋塞,并在分水器带旋塞的一侧预先加入适量的水,再向反应装置中依次加入5mL(55mmol)正丁醇、3.4mL(60mmol)冰醋酸和0.05mL浓硫酸,加入一粒沸石。
③将反应液温度控制在T1℃并保持15分钟,然后升温至回流状态。当___________,停止加热。将分水器中的液体导入分液漏斗中,将水层分出。
④依次用5mL水、5mL10%碳酸钠溶液、5mL水洗涤有机层。
⑤有机层用无水硫酸镁干燥。常压蒸馏,在T2℃时收集馏分。
已知各化合物及相关共沸物在常压下的沸点如下表所示:
| 化合物 | 乙酸 | 正丁醇 | 乙酸丁酯醋 |
| 沸点 | 117.9℃ | 117.3℃ | 126.6℃ |
| 共沸物 | 正丁醇—水 | 乙酸正丁酯—水 | 乙酸正丁酯—正丁醇—水 |
| 沸点 | 92.7℃ | 90.7℃ | 90.7℃ |
(1)仪器A的名称为
(2)正丁醇的密度为
(3)步骤③中停止加热的标志是
(4)T1和T2的范围分别是
a.T1>90℃,T2>120℃ b.T1>90℃,T2<12℃
c.T1<90℃,T2>120℃ d.T1<90℃,T2<120℃
(5)冰醋酸略过量的原因是
(6)步骤③中,有一处操作明显错误使得产率降低,正确做法是
您最近一年使用:0次
解题方法
6 . 锂离子电池是新能源重要组成部分,废旧锂电池的回收利用意义重大。某研究小组对废弃的锂电池正极材料LiCoO2进行氯化处理以回收Li、Co等金属,工艺流程如下:
(1)已知Co的原子序数为27,则其在元素周期表中的位置是___________ 。
(2)已知“烧渣”是LiCl、CoCl2和SiO2的混合物,则“500℃焙烧”反应生成的氧化产物与还原产物的物质的量之比为___________ ;滤饼2成分的化学式为___________ 。
(3)碳酸锂的溶解度随温度变化如图所示。向滤液2中加入Na2CO3,将温度升至90℃是为了提高沉淀反应速率和___________ 。得到碳酸锂沉淀的操作为___________ (填标号)。
b.加热后,趁热过滤
c.蒸发浓缩、冷却结晶
(4)取100mL滤液2,其中c(Li+)=0.10mol·L-1,为使锂元素的回收率不低于80%,则至少应加入Na2CO3固体的物质的量为___________ mol[已知Ksp(Li2CO3)=3.6×10-4,忽略溶液体积变化]。
(5)将碳酸锂(Li2CO3)与CoCO3按n(Li):n(Co)=1:1的比例配合,然后在空气中于700℃烧结可合成锂电池正极材料LiCoO2,反应的化学方程式为___________ 。
(6)钴的某种氧化物的晶胞结构如图所示,该立方晶胞参数为apm。___________ 。
②设阿伏加德罗常数的值为NA,则该晶胞的密度为___________ g·cm-3。

(1)已知Co的原子序数为27,则其在元素周期表中的位置是
(2)已知“烧渣”是LiCl、CoCl2和SiO2的混合物,则“500℃焙烧”反应生成的氧化产物与还原产物的物质的量之比为
(3)碳酸锂的溶解度随温度变化如图所示。向滤液2中加入Na2CO3,将温度升至90℃是为了提高沉淀反应速率和
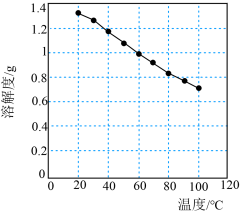
b.加热后,趁热过滤
c.蒸发浓缩、冷却结晶
(4)取100mL滤液2,其中c(Li+)=0.10mol·L-1,为使锂元素的回收率不低于80%,则至少应加入Na2CO3固体的物质的量为
(5)将碳酸锂(Li2CO3)与CoCO3按n(Li):n(Co)=1:1的比例配合,然后在空气中于700℃烧结可合成锂电池正极材料LiCoO2,反应的化学方程式为
(6)钴的某种氧化物的晶胞结构如图所示,该立方晶胞参数为apm。
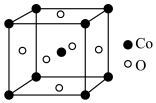
②设阿伏加德罗常数的值为NA,则该晶胞的密度为
您最近一年使用:0次
解题方法
7 . “科教兴国,创新先行”。下列新闻事件的化学解读科学的是
| 选项 | 新闻事件 | 化学解读 |
| A | 中外学者合作补齐海洋铅循环拼图 | 铅(原子序数为82)属于d区元素 |
| B | 核心舱太阳能电池采用砷化镓(GaAs)材料 | GaAs属于金属材料 |
| C | 以硅烷为气体催化剂,乙炔为碳源,在一定条件下,制备高质量的单层石墨烯 | 乙炔的空间填充模型: |
| D | 碳量子点是由类球状碳颗粒(粒度为1~10nm)组成的新型纳米碳材料,能用于光电器件 | 碳量子点能产生丁达尔现象 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
8 . 高活性杀螨剂(化合物Ⅰ)的合成路线如下:
(1)B的分子式为___________ ,H中含氧官能团的名称为___________ 。
(2)B→C反应的另一种产物为___________ ,E→F的反应类型为___________ 。
(3)A的结构简式是___________ 。
(4)F→G的化学方程式为___________ 。
(5)化合物B的同分异构体中满足下列条件的有___________ 种(不考虑立体异构);其中核磁共振氢谱有5组峰且峰面积之比为3:2:2:2:1的结构简式为___________ 。
①苯环上含有两个取代基且能发生银镜反应;
②分子中含有-NH2且-NH2与苯环直接相连。
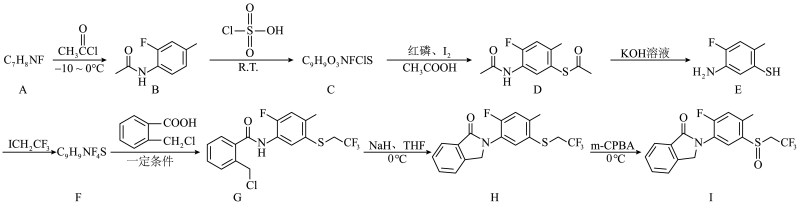
(1)B的分子式为
(2)B→C反应的另一种产物为
(3)A的结构简式是
(4)F→G的化学方程式为
(5)化合物B的同分异构体中满足下列条件的有
①苯环上含有两个取代基且能发生银镜反应;
②分子中含有-NH2且-NH2与苯环直接相连。
您最近一年使用:0次
解题方法
9 . V2O5广泛用于冶金、化工等行业,主要用于冶炼钒铁。以钒矿石为原料制备V2O5的工艺如下: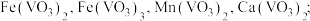 “酸浸”后钒以
“酸浸”后钒以 形式存在,“中和还原”后钒以
形式存在,“中和还原”后钒以 形式存在。
形式存在。
ii.P204对四价钒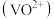 具有高选择性,且萃取
具有高选择性,且萃取 而不萃取
而不萃取 。
。
iii.多钒酸铵微溶于冷水,易溶于热水。
iv.该工艺条件下,溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
回答下列问题:
(1)“破碎”的目的是___________ 。
(2)“中和还原”时, 参与反应的离子方程式:
参与反应的离子方程式:___________ 。
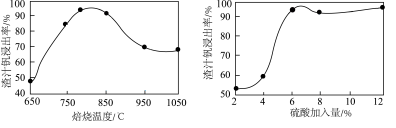
(3)钒的浸出率与焙烧温度、硫酸加入量的关系如图所示。指出适宜的工艺条件为___________ 。若在得到多钒酸铵后,使用冰水洗涤多钒酸铵的目的是___________ 。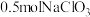 ,可得到
,可得到___________ 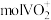 。
。
(5)流程中可偱环使用的物质有___________ 。
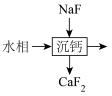
(6)萃取后的“水相”中含有丰富的金属资源,经三道工序可回收 溶液。请根据题给信息,参照上述工艺流程,将下列工艺流程补充完整
溶液。请根据题给信息,参照上述工艺流程,将下列工艺流程补充完整___________ (可选用的试剂: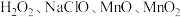 、
、 )。
)。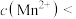
___________  。
。
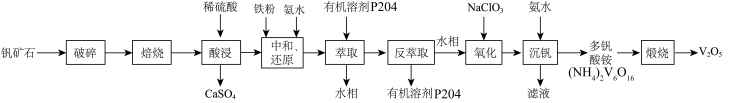
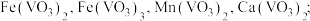 “酸浸”后钒以
“酸浸”后钒以 形式存在,“中和还原”后钒以
形式存在,“中和还原”后钒以 形式存在。
形式存在。ii.P204对四价钒
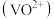 具有高选择性,且萃取
具有高选择性,且萃取 而不萃取
而不萃取 。
。iii.多钒酸铵微溶于冷水,易溶于热水。
iv.该工艺条件下,溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
| 金属离子 | Fe3+ | Fe2+ | Ca2+ | Mn2+ |
| 开始沉淀pH | 1.9 | 7.0 | 11.9 | 8.1 |
| 完全沉淀pH | 3.2 | 9.0 | 13.9 | 10.1 |
(1)“破碎”的目的是
(2)“中和还原”时,
 参与反应的离子方程式:
参与反应的离子方程式:(3)钒的浸出率与焙烧温度、硫酸加入量的关系如图所示。指出适宜的工艺条件为
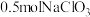 ,可得到
,可得到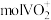 。
。(5)流程中可偱环使用的物质有
(6)萃取后的“水相”中含有丰富的金属资源,经三道工序可回收
 溶液。请根据题给信息,参照上述工艺流程,将下列工艺流程补充完整
溶液。请根据题给信息,参照上述工艺流程,将下列工艺流程补充完整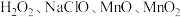 、
、 )。
)。
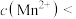
 。
。
您最近一年使用:0次
解题方法
10 . 某小组采用电化学法制备乙炔和环氧环己烷(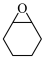 )。装置如图所示。双极膜是由阴膜和阳膜组成,双极膜中水电离出阴、阳离子在电场中向两极迁移。下列叙述正确的是
)。装置如图所示。双极膜是由阴膜和阳膜组成,双极膜中水电离出阴、阳离子在电场中向两极迁移。下列叙述正确的是
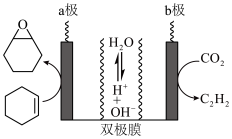
| A.电解时a极与电源负极连接 |
B.b极反应式为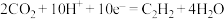 |
| C.制备1mol环氧环己烷时双极膜内质量减少18g |
| D.a、b两极环氧环己烷与乙炔的物质的量之比为1:5 |
您最近一年使用:0次




