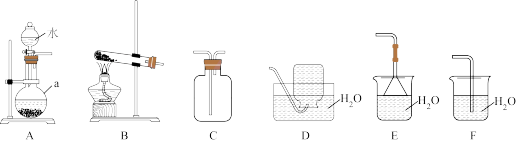
1 . 选用下图所示的装置进行实验。
(1)装置A中仪器a的名称为_______ 。
(2)实验室用 与
与 反应制取
反应制取 的发生装置为
的发生装置为_______ (填标号),该反应的化学方程式为_______ , 的尾气处理装置为
的尾气处理装置为_______ (填标号)。
(3)实验室用 与稀硝酸反应制取
与稀硝酸反应制取 ,该气体的收集装置为
,该气体的收集装置为_______ (填标号)。
(1)装置A中仪器a的名称为
(2)实验室用
 与
与 反应制取
反应制取 的发生装置为
的发生装置为 的尾气处理装置为
的尾气处理装置为(3)实验室用
 与稀硝酸反应制取
与稀硝酸反应制取 ,该气体的收集装置为
,该气体的收集装置为
您最近一年使用:0次
2023-01-05更新
|
969次组卷
|
3卷引用:山东省2022年冬季普通高中学业水平合格考试化学试题
名校
解题方法
2 . 根据原电池原理,人们研制出了性能各异的化学电池。
(1)锌铜原电池装置示意图如图1。
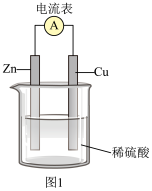
①Zn片作_______ (填“正极”或“负极”)。
②Cu片上发生反应的电极反应式为_______ 。
③电流表指针偏转,说明该装置实现了化学能向_______ 的转化。
(2)某锂-空气电池的总反应为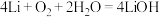 ,其工作原理示意图如图2。
,其工作原理示意图如图2。
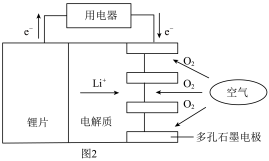
下列说法正确的是_______ (填字母)。
a.锂片作负极 b. 发生还原反应
发生还原反应
(1)锌铜原电池装置示意图如图1。

①Zn片作
②Cu片上发生反应的电极反应式为
③电流表指针偏转,说明该装置实现了化学能向
(2)某锂-空气电池的总反应为
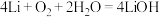 ,其工作原理示意图如图2。
,其工作原理示意图如图2。
下列说法正确的是
a.锂片作负极 b.
 发生还原反应
发生还原反应
您最近一年使用:0次
2023-03-15更新
|
791次组卷
|
3卷引用:2023年北京市第一次普通高中学业水平合格性考试化学试题
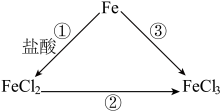
3 . 铁及其化合物之间的转化关系如图所示。
(1)反应①的离子方程式为_______ 。
(2)完成反应②还需加入_______ (填“氧化剂”或“还原剂”)。
(3)完成反应③还需用到的试剂为_______ (填化学式),检验 的试剂为
的试剂为_______ 。
(4)向 溶液中加入
溶液中加入 溶液的现象为
溶液的现象为_______ 。
(1)反应①的离子方程式为
(2)完成反应②还需加入
(3)完成反应③还需用到的试剂为
 的试剂为
的试剂为(4)向
 溶液中加入
溶液中加入 溶液的现象为
溶液的现象为
您最近一年使用:0次
2023-01-05更新
|
567次组卷
|
3卷引用:山东省2022年冬季普通高中学业水平合格考试化学试题
名校
4 . 数字化实验是化学研究的重要手段。实验小组将电导率传感器插入20.00mL 0.1mol·L-1 H2SO4溶液中,向溶液中匀速滴入等浓度的BaCl2溶液,电导率与溶液体积图像如图所示。 (已知溶液导电性越强,电导率值越大),请回答下列问题。
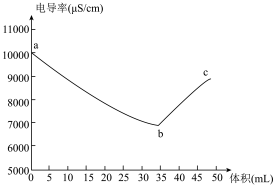
(1)按物质分类,BaCl2属于_______ (选填“强电解质”或“弱电解质”)。
(2)其它条件相同的情况下,溶的导电性由_______ 决定。
(3)用离子方程式解释图中 a→b段曲线变化的原因_______ 。
(4)对 b、c 两处溶液的c(H+)进行比较,b_______ c(选填“>”或“=”或“<”), 说明原因_______ 。
(5)用等浓度的Ba(OH)2溶液替换BaCl2溶液,则电导率最低点与图中 b 点的位置关系为
(6)向 0.1 mol·L-1氨水中,匀速滴入等浓度的醋酸溶液,下列图像正确的是
(7)在无色溶液中能大量共存的一组离子是
(8)下列物质的溶液不能将Al(OH)3溶解的是

(1)按物质分类,BaCl2属于
(2)其它条件相同的情况下,溶的导电性由
(3)用离子方程式解释图中 a→b段曲线变化的原因
(4)对 b、c 两处溶液的c(H+)进行比较,b
(5)用等浓度的Ba(OH)2溶液替换BaCl2溶液,则电导率最低点与图中 b 点的位置关系为
| A.在 b 上方 | B.与 b 重合 | C.在 b 下方 | D.无法确定 |
A.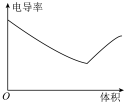 | B.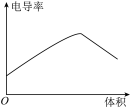 |
C.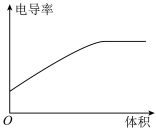 | D.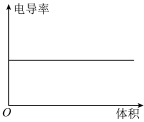 |
A.NO 、Cl-、Na+、Ca2+ 、Cl-、Na+、Ca2+ | B.Ag+、NO 、OH-、Na+ 、OH-、Na+ |
C.Mg2+、MnO 、K+、I- 、K+、I- | D.HCO 、OH-、Ca2+、Na+ 、OH-、Ca2+、Na+ |
| A.NaOH | B.NaCl | C.H2SO4 | D.HCl |
您最近一年使用:0次
名校
解题方法
5 . 下图是元素周期表的一部分,针对表中①~⑦元素,填写下列空白:

(1)⑥表示的元素是_______ (填元素符号)。
(2)②和⑥两种元素的原子半径大小为:②_______ ⑥(填“<”或“>”)。
(3)①②③三种元素对应的简单氢化物中最稳定的是_______ (填化学式)。
(4)元素④与⑦形成的化合物属于_______ (填“共价”或“离子”)化合物。
(5)写出元素⑤的氧化物与氢氧化钠溶液反应的离子方程式_______ 。

(1)⑥表示的元素是
(2)②和⑥两种元素的原子半径大小为:②
(3)①②③三种元素对应的简单氢化物中最稳定的是
(4)元素④与⑦形成的化合物属于
(5)写出元素⑤的氧化物与氢氧化钠溶液反应的离子方程式
您最近一年使用:0次
6 . 甲烷在日常生活及有机合成中用途广泛,某研究小组研究甲烷在高温下气相裂解反应的原理及其应用。
(1)已知:CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH1=-890.3kJ•mol-1
C2H2(g)+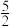 O2(g)=2CO2(g)+H2O(l) ΔH2=-1299.6kJ•mol-1
O2(g)=2CO2(g)+H2O(l) ΔH2=-1299.6kJ•mol-1
2H2(g)+O2(g)=2H2O(l) ΔH3=-571.6kJ•mol-1
则甲烷气相裂解反应:2CH4(g) C2H2(g)+3H2(g)的ΔH=
C2H2(g)+3H2(g)的ΔH=_____ 。
(2)该研究小组在研究过程中得出当甲烷分解时,几种气体平衡时分压(Pa)与温度(℃)的关系如图所示。

①T1℃时,向2L恒容密闭容器中充入0.3molCH4,只发生反应2CH4(g) C2H4(g)+2H2(g),达到平衡时,测得c(C2H4)=c(CH4)。该反应达到平衡时,CH4的转化率为
C2H4(g)+2H2(g),达到平衡时,测得c(C2H4)=c(CH4)。该反应达到平衡时,CH4的转化率为____ 。
②对上述平衡状态,若改变温度至T2℃,经10s后再次达到平衡,c(CH4)=2c(C2H4),则10s内C2H4的平均反应速率v(C2H4)=___ ,上述变化过程中T1____ (填“>”或“<”)T2,判断理由是____ 。
③在①建立的平衡状态基础上,其他条件不变,再通入0.5molCH4,平衡将____ (填“不移动”、“正向移动”或“逆向移动”),与原平衡相比,CH4的平衡转化率____ (填“不变”、“变大”或“变小”)。
(3)若容器中发生反应2CH4(g) C2H2(g)+3H2(g),计算该反应在图中A点温度时的平衡常数Kp=
C2H2(g)+3H2(g),计算该反应在图中A点温度时的平衡常数Kp=____ Pa2(用平衡分压代替平衡浓度)。
(1)已知:CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH1=-890.3kJ•mol-1
C2H2(g)+
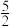 O2(g)=2CO2(g)+H2O(l) ΔH2=-1299.6kJ•mol-1
O2(g)=2CO2(g)+H2O(l) ΔH2=-1299.6kJ•mol-12H2(g)+O2(g)=2H2O(l) ΔH3=-571.6kJ•mol-1
则甲烷气相裂解反应:2CH4(g)
 C2H2(g)+3H2(g)的ΔH=
C2H2(g)+3H2(g)的ΔH=(2)该研究小组在研究过程中得出当甲烷分解时,几种气体平衡时分压(Pa)与温度(℃)的关系如图所示。

①T1℃时,向2L恒容密闭容器中充入0.3molCH4,只发生反应2CH4(g)
 C2H4(g)+2H2(g),达到平衡时,测得c(C2H4)=c(CH4)。该反应达到平衡时,CH4的转化率为
C2H4(g)+2H2(g),达到平衡时,测得c(C2H4)=c(CH4)。该反应达到平衡时,CH4的转化率为②对上述平衡状态,若改变温度至T2℃,经10s后再次达到平衡,c(CH4)=2c(C2H4),则10s内C2H4的平均反应速率v(C2H4)=
③在①建立的平衡状态基础上,其他条件不变,再通入0.5molCH4,平衡将
(3)若容器中发生反应2CH4(g)
 C2H2(g)+3H2(g),计算该反应在图中A点温度时的平衡常数Kp=
C2H2(g)+3H2(g),计算该反应在图中A点温度时的平衡常数Kp=
您最近一年使用:0次
2022-10-19更新
|
602次组卷
|
3卷引用:山东省2022-2023学年高二上学期学业水平测试化学试题
名校
解题方法
7 . 镁及其合金是一种用途很广的金属材料,目前世界上 的镁是从海水中提取的。主要步骤如下:
的镁是从海水中提取的。主要步骤如下:
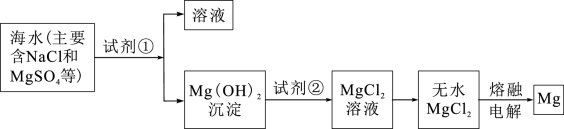
(1)为了使 转化为
转化为 ,试剂①可以选用
,试剂①可以选用_______ (填化学式)。
(2)加入试剂①后,能够分离得到 沉淀的方法是
沉淀的方法是_______ 。
(3)试剂②可以选用_______ (填化学式)。
(4) 的电子式为
的电子式为_______ ,无水 在熔融状态下,通电后会产生
在熔融状态下,通电后会产生 和
和 ,该反应的化学方程式为
,该反应的化学方程式为_______ 。
 的镁是从海水中提取的。主要步骤如下:
的镁是从海水中提取的。主要步骤如下:
(1)为了使
 转化为
转化为 ,试剂①可以选用
,试剂①可以选用(2)加入试剂①后,能够分离得到
 沉淀的方法是
沉淀的方法是(3)试剂②可以选用
(4)
 的电子式为
的电子式为 在熔融状态下,通电后会产生
在熔融状态下,通电后会产生 和
和 ,该反应的化学方程式为
,该反应的化学方程式为
您最近一年使用:0次
解题方法
8 . 钠及其重要化合物之间的转化关系如下图所示,部分物质及反应条件略去。
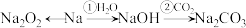

回答下列问题:
(1)少量的金属钠应保存在_______ 中。
(2) 为
为_______ 色固体。
(3)反应①的还原剂是_______ 。
(4)反应②的溶液中,NaOH实际参加反应的离子是_______ (填“ ”或“
”或“ ”)。
”)。
(5)反应③的化学方程式为_______ 。
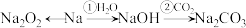

回答下列问题:
(1)少量的金属钠应保存在
(2)
 为
为(3)反应①的还原剂是
(4)反应②的溶液中,NaOH实际参加反应的离子是
 ”或“
”或“ ”)。
”)。(5)反应③的化学方程式为
您最近一年使用:0次
名校
解题方法
9 . 回答下列问题:
(1)键线式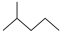 表示的物质的分子式为
表示的物质的分子式为_______ 。
(2)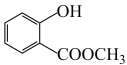 中含有的官能团的名称为
中含有的官能团的名称为_______ 、_______ 。
(3)戊烷的某种同分异构体只有一种一氯代物,试书写它的结构简式:_______ 。
(4)某芳香烃的结构为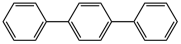 ,它的分子式为
,它的分子式为_______ ,一氯代物有_______ 种。
(1)键线式
 表示的物质的分子式为
表示的物质的分子式为(2)
 中含有的官能团的名称为
中含有的官能团的名称为(3)戊烷的某种同分异构体只有一种一氯代物,试书写它的结构简式:
(4)某芳香烃的结构为
 ,它的分子式为
,它的分子式为
您最近一年使用:0次
2023-02-25更新
|
603次组卷
|
2卷引用:陕西省2022-2023学年高二下学期化学学业水平模拟测试(一)
解题方法
10 . 工业上用FeCl3溶液作印刷电路铜板的腐蚀液。化学小组设计如下流程对腐蚀废液(阳离子主要有Fe2+、Cu2+、Fe3+和H+)进行处理,实现FeCl3溶液再生并回收Cu。_______ (填“氧化”或“还原”)为Fe3+。
(2)步骤Ⅱ中发生反应的离子方程式为_______ 。
(3)溶液C中含有大量Fe2+。取少量溶液C于试管中,滴加_______ 溶液,有白色沉淀生成,白色沉淀迅速变为灰绿色,最终变为红褐色。
(4)下列说法合理的是_______ (填字母)。
a.溶液A、溶液B和固体C中都含有铜元素
b.溶液C和溶液D可回收利用,体现“绿色化学”理念
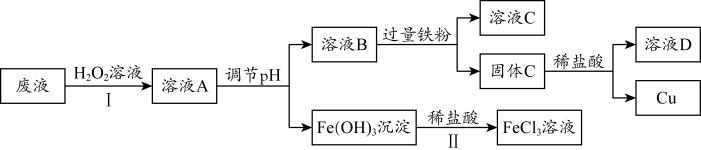
(2)步骤Ⅱ中发生反应的离子方程式为
(3)溶液C中含有大量Fe2+。取少量溶液C于试管中,滴加
(4)下列说法合理的是
a.溶液A、溶液B和固体C中都含有铜元素
b.溶液C和溶液D可回收利用,体现“绿色化学”理念
您最近一年使用:0次



