1 . 将14g氧化钠和过氧化钠的混合物放入87.6g水中,得到100g溶液。求所得溶液中溶质的质量分数为是多少?___________
您最近一年使用:0次
解题方法
2 . 请回答下列问题
(1)已知:C(石墨,s)+O2(g)=CO2(g) △H1=-akJ•mol-1
H2(g)+ O2(g)=H2O(l) △H2=-bkJ•mol-1
O2(g)=H2O(l) △H2=-bkJ•mol-1
CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H3=-ckJ•mol-1
计算C(石墨,s)与H2(g)反应生成1molCH4(g)的△H为_____ kJ•mol-1(用含a、b、c的式子表示)。
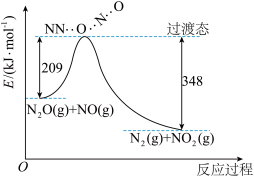
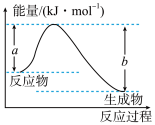
(2)由N2O和NO反应生成N2和NO2的能量变化如图所示。则反应过程中,每生成2molN2理论上放出的热量为_____ 。
(3)H2S与CO2在高温下发生反应:H2S(g)+CO2(g) COS(g)+H2O(g) △H>0。在610K时,将0.1molH2S与0.3molCO2充入2.5L的空钢瓶中,经过10min,反应达到平衡,反应平衡时水蒸气的物质的量分数为0.125。
COS(g)+H2O(g) △H>0。在610K时,将0.1molH2S与0.3molCO2充入2.5L的空钢瓶中,经过10min,反应达到平衡,反应平衡时水蒸气的物质的量分数为0.125。
①H2S的平衡转化率α=_____ %,反应平衡常数K=______ 。
②在650K重复实验,此时反应的平衡常数K=0.25,经过8min时,测得水蒸气的物质的量为0.04mol,该反应是否达到平衡______ (填“是”或“否”),此时v(正)______ v(逆)(填“>”、“<”或“=”)。
(1)已知:C(石墨,s)+O2(g)=CO2(g) △H1=-akJ•mol-1
H2(g)+
 O2(g)=H2O(l) △H2=-bkJ•mol-1
O2(g)=H2O(l) △H2=-bkJ•mol-1CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H3=-ckJ•mol-1
计算C(石墨,s)与H2(g)反应生成1molCH4(g)的△H为
(2)由N2O和NO反应生成N2和NO2的能量变化如图所示。则反应过程中,每生成2molN2理论上放出的热量为

(3)H2S与CO2在高温下发生反应:H2S(g)+CO2(g)
 COS(g)+H2O(g) △H>0。在610K时,将0.1molH2S与0.3molCO2充入2.5L的空钢瓶中,经过10min,反应达到平衡,反应平衡时水蒸气的物质的量分数为0.125。
COS(g)+H2O(g) △H>0。在610K时,将0.1molH2S与0.3molCO2充入2.5L的空钢瓶中,经过10min,反应达到平衡,反应平衡时水蒸气的物质的量分数为0.125。①H2S的平衡转化率α=
②在650K重复实验,此时反应的平衡常数K=0.25,经过8min时,测得水蒸气的物质的量为0.04mol,该反应是否达到平衡
您最近一年使用:0次
名校
解题方法
3 . 回答下列问题:
(1)常温下,将pH=9的NaOH溶液稀释1000倍,溶液中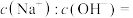
______
(2)常温下,已知醋酸的电离常数为Ka,向100mL0.1mol/L的醋酸溶液中,加入______ mL0.1mol/L的NaOH,可使反应所得的溶液pH=7(用含Ka的式子表达)
(3)常温下,100mLpH=0盐酸和硫酸的混合溶液中加入200mLpH=13的 ,恰好沉淀完全,则原溶液中c(HCl)=
,恰好沉淀完全,则原溶液中c(HCl)=______
(4)常温下,设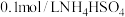 溶液的pH为a,则
溶液的pH为a,则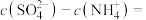
______ (用含a的精确式子表达)
(1)常温下,将pH=9的NaOH溶液稀释1000倍,溶液中
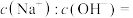
(2)常温下,已知醋酸的电离常数为Ka,向100mL0.1mol/L的醋酸溶液中,加入
(3)常温下,100mLpH=0盐酸和硫酸的混合溶液中加入200mLpH=13的
 ,恰好沉淀完全,则原溶液中c(HCl)=
,恰好沉淀完全,则原溶液中c(HCl)=(4)常温下,设
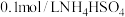 溶液的pH为a,则
溶液的pH为a,则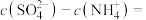
您最近一年使用:0次
名校
4 . 回答下列问题:
(1)3.01×1023个OH-的物质的量是___________ ,含有电子___________ 个;
(2)在标准状况下,CO和CO2混合气体的质量为36 g,体积为22.4 L,则其中 CO2所占的体积为___________ ,CO所占的质量为___________ 。
(3)质量分数为36.5%浓盐酸(密度为1.25 g·mL-1)的物质的量浓度为___________ ,若配制 250 mL0.1 mol·L-1 的盐酸,需要量取浓盐酸的体积为___________ mL。
(4)某无土栽培用的营养液,要求KCl、K2SO4和NH4Cl三种固体原料的物质的量之比为 1:4:8。
①配制该营养液后 c( )=0.016 mol/L,溶液中 c(K+)=
)=0.016 mol/L,溶液中 c(K+)=___________ 。
②若采用(NH4)2SO4和KCl来配制该营养液,则(NH4)2SO4和KCl物质的量之比为_____ 。
(1)3.01×1023个OH-的物质的量是
(2)在标准状况下,CO和CO2混合气体的质量为36 g,体积为22.4 L,则其中 CO2所占的体积为
(3)质量分数为36.5%浓盐酸(密度为1.25 g·mL-1)的物质的量浓度为
(4)某无土栽培用的营养液,要求KCl、K2SO4和NH4Cl三种固体原料的物质的量之比为 1:4:8。
①配制该营养液后 c(
 )=0.016 mol/L,溶液中 c(K+)=
)=0.016 mol/L,溶液中 c(K+)=②若采用(NH4)2SO4和KCl来配制该营养液,则(NH4)2SO4和KCl物质的量之比为
您最近一年使用:0次
2022-10-11更新
|
386次组卷
|
2卷引用:四川省成都高新实验中学2022-2023高一上学期期中考试化学试题
解题方法
5 . 利用相关知识填空。
(1)等物质的量的SO2和SO3所含氧原子个数之比____ 。
(2)4.8gCH4中所含氢原子个数与____ g水所含氢原子数相等。
(3)12.4gNa2R含Na+0.4mol,则Na2R的摩尔质量为____ ,R的相对原子质量是____ 。
(4)标况下,16g二氧化碳和一氧化碳组成的混合气体,其体积为8.96L,则该混合气体的密度相对氢气为____ ,一氧化碳和二氧化碳的物质的量之比为____ ,若将此混合气体通入足量的澄清石灰水中,生成的沉淀的质量是____ 。
(1)等物质的量的SO2和SO3所含氧原子个数之比
(2)4.8gCH4中所含氢原子个数与
(3)12.4gNa2R含Na+0.4mol,则Na2R的摩尔质量为
(4)标况下,16g二氧化碳和一氧化碳组成的混合气体,其体积为8.96L,则该混合气体的密度相对氢气为
您最近一年使用:0次
6 . Ⅰ.断开1 mol AB(g)分子中的化学键使其分别生成气态A原子和气态B原子所吸收的能量称为A—B的键能。下表列出了一些化学键的键能(E):
请回答下列问题:
(1)如图表示某反应的能量变化关系,则此反应为___________ (填“吸收”或“放出”) ___________ kJ能量(用含有a、b的关系式表示)。
(2)反应H2(g)+ O2(g)=H2O(g)放出241.8 kJ能量,则根据所给键能数据可得x=
O2(g)=H2O(g)放出241.8 kJ能量,则根据所给键能数据可得x=___________ 。
(3)历史上曾用“地康法”制氯气,这一方法是用CuCl2作催化剂,在450 ℃时利用空气中的氧气与氯化氢反应制氯气。反应的化学方程式为___________ 。
II.工业上用CO生产燃料甲醇,一定条件下发生反应:CO(g)+2H2(g) CH3OH(g),反应过程中的能量变化情况如图所示。曲线I和曲线II分别表示不使用催化剂和使用催化剂的两种情况。
CH3OH(g),反应过程中的能量变化情况如图所示。曲线I和曲线II分别表示不使用催化剂和使用催化剂的两种情况。
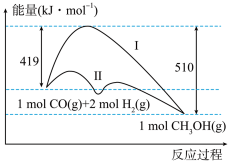
(4)计算当反应生成1.5molCH3OH(g)时,能量变化值是___________ kJ。
(5)推测反应CH3OH(g)⇌CO(g)+2H2(g)是___________ (填“吸热”或“放热”)反应。
Ⅲ.化学键的键能是形成(或断开)1 mol化学键时释放(或吸收)的能量。已知白磷和P4O6的分子结构如图所示:现提供以下化学键的键能(kJ·mol-1):P-P:198;P-O:360;O=O:498。
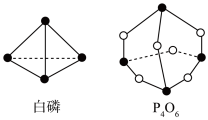
(6)则发生P4(白磷)+3O2(g)=P4O6(s)的反应,其中,生成1 mol P4O6需要___________ (“吸收或放出”)能量为___________ kJ
| 化学键 | H—H | Cl—Cl | O=O | C—Cl | C—H | O—H | H—Cl |
| E/(kJ·mol-1) | 436 | 247 | x | 330 | 413 | 463 | 431 |

(1)如图表示某反应的能量变化关系,则此反应为
(2)反应H2(g)+
 O2(g)=H2O(g)放出241.8 kJ能量,则根据所给键能数据可得x=
O2(g)=H2O(g)放出241.8 kJ能量,则根据所给键能数据可得x=(3)历史上曾用“地康法”制氯气,这一方法是用CuCl2作催化剂,在450 ℃时利用空气中的氧气与氯化氢反应制氯气。反应的化学方程式为
II.工业上用CO生产燃料甲醇,一定条件下发生反应:CO(g)+2H2(g)
 CH3OH(g),反应过程中的能量变化情况如图所示。曲线I和曲线II分别表示不使用催化剂和使用催化剂的两种情况。
CH3OH(g),反应过程中的能量变化情况如图所示。曲线I和曲线II分别表示不使用催化剂和使用催化剂的两种情况。
(4)计算当反应生成1.5molCH3OH(g)时,能量变化值是
(5)推测反应CH3OH(g)⇌CO(g)+2H2(g)是
Ⅲ.化学键的键能是形成(或断开)1 mol化学键时释放(或吸收)的能量。已知白磷和P4O6的分子结构如图所示:现提供以下化学键的键能(kJ·mol-1):P-P:198;P-O:360;O=O:498。

(6)则发生P4(白磷)+3O2(g)=P4O6(s)的反应,其中,生成1 mol P4O6需要
您最近一年使用:0次
解题方法
7 . 次氯酸 具有强氧化性,能起到杀菌消毒的作用。实验室制备
具有强氧化性,能起到杀菌消毒的作用。实验室制备 的反应原理为
的反应原理为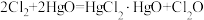 ,其制备装置如图所示,E中得到次氯酸
,其制备装置如图所示,E中得到次氯酸 。回答下列问题:
。回答下列问题:
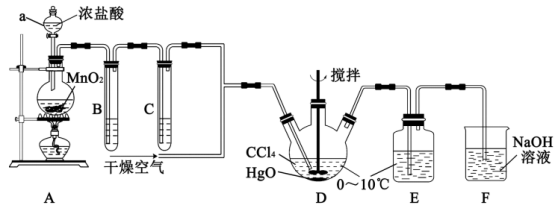
已知:① 气体
气体 时可分解,且可与水反应生成
时可分解,且可与水反应生成 ;
;
②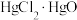 是难溶于水的固体。
是难溶于水的固体。
(1)仪器a的名称是___________ 。写出装置A中反应的离子方程式___________ 。
(2)装置B的作用是___________ ,装置C中盛装的试剂是___________ 。
(3)D中通入 与
与 反应制得
反应制得 ,则E中生成
,则E中生成 的化学反应方程式为
的化学反应方程式为___________ 。
(4)有效含氯量常用来衡量消毒剂的消毒能力,用 标准溶液滴定法测定某市售含氯消毒片的有效氯含量,实验步骤如下:
标准溶液滴定法测定某市售含氯消毒片的有效氯含量,实验步骤如下:
①称取含氯消毒片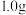 ,用容量瓶配制成
,用容量瓶配制成 溶液,定容时,用
溶液,定容时,用___________ 加蒸馏水至刻度线;
②配置 溶液及浓度标定:称取
溶液及浓度标定:称取 晶体
晶体 于烧杯中,取
于烧杯中,取 蒸馏水溶解均匀,转入
蒸馏水溶解均匀,转入___________ 色试剂瓶中,置于暗处放置7~14天后,用酸性 标准溶液标定上述
标准溶液标定上述 溶液的浓度为
溶液的浓度为 ;
;
③用滴定管量取 待测消毒溶液,置于
待测消毒溶液,置于 碘量瓶中,加入
碘量瓶中,加入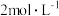 的硫酸
的硫酸 ,10%碘化钾溶液
,10%碘化钾溶液 ,此时溶液出现棕色,用
,此时溶液出现棕色,用 溶液滴定游离碘,边滴边摇匀,待溶液呈浅棕黄色时,加入1~2滴10%淀粉指示剂,继续滴定至
溶液滴定游离碘,边滴边摇匀,待溶液呈浅棕黄色时,加入1~2滴10%淀粉指示剂,继续滴定至___________ 即为终点。记录消耗的 溶液的体积;
溶液的体积;
④重复上述操作三次。四次测定的数据如下表:
根据 溶液的用量,计算消毒片的有效氯含量,已知
溶液的用量,计算消毒片的有效氯含量,已知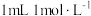 的硫代硫酸钠相当于
的硫代硫酸钠相当于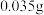 有效氯,则该市售含氯消毒片的有效氯含量为
有效氯,则该市售含氯消毒片的有效氯含量为___________ %。
 具有强氧化性,能起到杀菌消毒的作用。实验室制备
具有强氧化性,能起到杀菌消毒的作用。实验室制备 的反应原理为
的反应原理为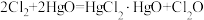 ,其制备装置如图所示,E中得到次氯酸
,其制备装置如图所示,E中得到次氯酸 。回答下列问题:
。回答下列问题:
已知:①
 气体
气体 时可分解,且可与水反应生成
时可分解,且可与水反应生成 ;
;②
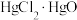 是难溶于水的固体。
是难溶于水的固体。(1)仪器a的名称是
(2)装置B的作用是
(3)D中通入
 与
与 反应制得
反应制得 ,则E中生成
,则E中生成 的化学反应方程式为
的化学反应方程式为(4)有效含氯量常用来衡量消毒剂的消毒能力,用
 标准溶液滴定法测定某市售含氯消毒片的有效氯含量,实验步骤如下:
标准溶液滴定法测定某市售含氯消毒片的有效氯含量,实验步骤如下:①称取含氯消毒片
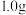 ,用容量瓶配制成
,用容量瓶配制成 溶液,定容时,用
溶液,定容时,用②配置
 溶液及浓度标定:称取
溶液及浓度标定:称取 晶体
晶体 于烧杯中,取
于烧杯中,取 蒸馏水溶解均匀,转入
蒸馏水溶解均匀,转入 标准溶液标定上述
标准溶液标定上述 溶液的浓度为
溶液的浓度为 ;
;③用滴定管量取
 待测消毒溶液,置于
待测消毒溶液,置于 碘量瓶中,加入
碘量瓶中,加入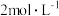 的硫酸
的硫酸 ,10%碘化钾溶液
,10%碘化钾溶液 ,此时溶液出现棕色,用
,此时溶液出现棕色,用 溶液滴定游离碘,边滴边摇匀,待溶液呈浅棕黄色时,加入1~2滴10%淀粉指示剂,继续滴定至
溶液滴定游离碘,边滴边摇匀,待溶液呈浅棕黄色时,加入1~2滴10%淀粉指示剂,继续滴定至 溶液的体积;
溶液的体积;④重复上述操作三次。四次测定的数据如下表:
| 实验序号 | 1 | 2 | 3 | 4 |
消耗 溶液的体积/ 溶液的体积/ | 20.05 | 20.00 | 19.95 | 20.45 |
 溶液的用量,计算消毒片的有效氯含量,已知
溶液的用量,计算消毒片的有效氯含量,已知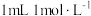 的硫代硫酸钠相当于
的硫代硫酸钠相当于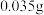 有效氯,则该市售含氯消毒片的有效氯含量为
有效氯,则该市售含氯消毒片的有效氯含量为
您最近一年使用:0次
名校
解题方法
8 . 工业制备硫酸的主要反应之一为SO2与O2反应生成SO3。请回答下列问题:
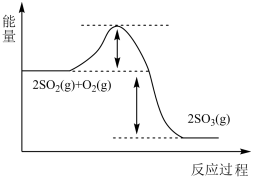
(1)SO2与O2反应生成SO3的反应过程的能量变化如图所示。由图中曲线变化可知,该反应为_______ (填“放热”或“吸热”)反应。
(2)某次实验中,在容积为2L的恒温密闭容器中通入2mol SO2和b mol O2,反应过程中部分物质的物质的量随反应时间的变化如图所示。
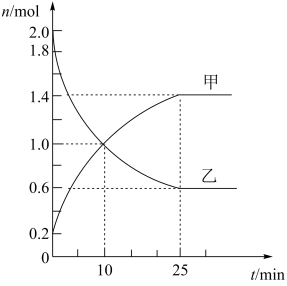
①甲为_______ (填化学式,下同),乙为_______ 。
②SO2与O2反应生成SO3的反应是_______ (填“可逆”或“不可逆”)反应。
③10 min时,v正(SO2)_______ (填“>”“<”或“=”)v逆(SO2)。
④从反应开始到平衡,反应速率v(SO3)_______ mol·L-1·min-1。
⑤反应达到平衡时,SO2的转化率为_______ 。
(1)SO2与O2反应生成SO3的反应过程的能量变化如图所示。由图中曲线变化可知,该反应为

(2)某次实验中,在容积为2L的恒温密闭容器中通入2mol SO2和b mol O2,反应过程中部分物质的物质的量随反应时间的变化如图所示。

①甲为
②SO2与O2反应生成SO3的反应是
③10 min时,v正(SO2)
④从反应开始到平衡,反应速率v(SO3)
⑤反应达到平衡时,SO2的转化率为
您最近一年使用:0次
名校
解题方法
9 . 回答下列问题:
(1)3.6gH2O的物质的量是_______ ,含有氢原子的数目是_______ 。
(2)1.5molCO2和_______ gCH4在标准状况下占有相同的体积,其体积为_______ 。
(3)100mL气体A2跟50mL气体B2恰好完全反应生成100mL气体C(体积均在相同条件下测定)则C的化学式为_______ 。
(4)标准状况下,一烧瓶HCl气体倒扣在水槽中,假设溶液没有损失,则所得溶液的物质的量浓度为_______ 。
(5)将4gNaOH溶解在10mL水中,再稀释成1L,从中取出10mL,这10mL溶液的物质的量浓度为_______ 。
(1)3.6gH2O的物质的量是
(2)1.5molCO2和
(3)100mL气体A2跟50mL气体B2恰好完全反应生成100mL气体C(体积均在相同条件下测定)则C的化学式为
(4)标准状况下,一烧瓶HCl气体倒扣在水槽中,假设溶液没有损失,则所得溶液的物质的量浓度为
(5)将4gNaOH溶解在10mL水中,再稀释成1L,从中取出10mL,这10mL溶液的物质的量浓度为
您最近一年使用:0次
10 . 请回答下列问题:
(1)标准状况下,V L氯化氢(HCl)溶解在1 L水中(水的密度近似为1 g/mL)所得溶液的密度为ρ g/mL,则所得盐酸物质的量浓度为_______
(2)将a mol钠和a mol铝一同投入m g足量水中,所得溶液密度为d g·mL-1,该溶液中溶质质量分数为_______
(3)在200 mL氯化镁和氯化铝的混合溶液中,c(Mg2+)为0.2 mol·L-1,c(Cl-)为1.3 mol·L-1。要使Mg2+全部转化为沉淀分离出来,至少需加4 mol·L-1 NaOH溶液的体积为_______
(4)某铁的氧化物(FexO)1.52 g溶于足量盐酸中,向所得溶液中通入112 mL Cl2(标准状况下),恰好将Fe2+完全氧化。x值为_______
(5)向一定量的FeO、Fe、Fe3O4的混合物中加入100 mL 1 mol·L-1的盐酸,恰好使混合物完全溶解,放出224 mL(标准状况)的气体,在所得溶液中加入KSCN溶液无血红色出现。若用足量的CO在高温下还原相同质量的此混合物,能得到铁的质量是_______
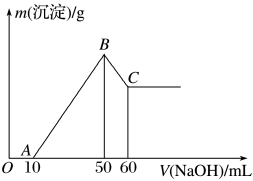
(6)某无色溶液中含有H+、Al3+、Mg2+三种阳离子,逐滴加入0.1 mol·L-1 NaOH溶液,消耗NaOH溶液体积和生成沉淀之间的关系如下图所示。则溶液中H+、Al3+、Mg2+三种阳离子的物质的量浓度之比为_______
(1)标准状况下,V L氯化氢(HCl)溶解在1 L水中(水的密度近似为1 g/mL)所得溶液的密度为ρ g/mL,则所得盐酸物质的量浓度为
(2)将a mol钠和a mol铝一同投入m g足量水中,所得溶液密度为d g·mL-1,该溶液中溶质质量分数为
(3)在200 mL氯化镁和氯化铝的混合溶液中,c(Mg2+)为0.2 mol·L-1,c(Cl-)为1.3 mol·L-1。要使Mg2+全部转化为沉淀分离出来,至少需加4 mol·L-1 NaOH溶液的体积为
(4)某铁的氧化物(FexO)1.52 g溶于足量盐酸中,向所得溶液中通入112 mL Cl2(标准状况下),恰好将Fe2+完全氧化。x值为
(5)向一定量的FeO、Fe、Fe3O4的混合物中加入100 mL 1 mol·L-1的盐酸,恰好使混合物完全溶解,放出224 mL(标准状况)的气体,在所得溶液中加入KSCN溶液无血红色出现。若用足量的CO在高温下还原相同质量的此混合物,能得到铁的质量是
(6)某无色溶液中含有H+、Al3+、Mg2+三种阳离子,逐滴加入0.1 mol·L-1 NaOH溶液,消耗NaOH溶液体积和生成沉淀之间的关系如下图所示。则溶液中H+、Al3+、Mg2+三种阳离子的物质的量浓度之比为

您最近一年使用:0次
2022-04-04更新
|
1304次组卷
|
3卷引用:四川省泸县第四中学2022-2023学年高一上学期第三次月考化学试题
四川省泸县第四中学2022-2023学年高一上学期第三次月考化学试题江苏省天一中学2021-2022学年高一上学期期末考试化学(强化班)试题(已下线)专题02 阿伏加德罗常数及其化学计算 (测)-2023年高考化学二轮复习讲练测(新高考专用)



