名校
1 . 下列实验操作对应的现象预测正确或能达到有关实验目的的是


A.①可比较 、 、 的稳定性 的稳定性 | B.②焰色试验检验K元素 |
| C.③分离氯化铁溶液和氢氧化铁胶体 | D.④制备氢氧化铁胶体 |
您最近一年使用:0次
2022-10-12更新
|
932次组卷
|
12卷引用:内蒙古赤峰市元宝山区第一中学2022-2023学年高一上学期期中考试化学试题
内蒙古赤峰市元宝山区第一中学2022-2023学年高一上学期期中考试化学试题辽宁省沈阳市第一二〇中学2022-2023学年高一上学期第一次月考化学试题四川省遂宁高级实验学校2022-2023学年高一上学期半期考试化学试题 四川省内江市资中县第二中学2022-2023学年高一上学期12月月考化学试题(已下线)【2022】【高一化学】【期中考】-183河南省周口恒大中学2022-2023学年高一上学期11月期中考试化学试题四川省广安市育才学校2022-2023学年高一上学期11月期中考试化学试题辽宁省沈阳市第一二〇中学2022-2023学年高一上学期第一次质量检测化学试题 广西南宁市第三中学2023-2024学年高一上学期期中考试化学试题浙江省杭州市西湖高级中学2023-2024学年高一上学期10月月考化学试题四川省眉山市仁寿第一中学校南校区2023-2024学年高一上学期11月期中化学试题浙江省杭州东方中学2023-2024学年高一上学期期中考试化学试题
名校
2 .  在常温下化学性质非常稳定,但在加热条件下可以体现氧化性或还原性。
在常温下化学性质非常稳定,但在加热条件下可以体现氧化性或还原性。
I.某实验小组计划使用 与浓盐酸制备并收集少量
与浓盐酸制备并收集少量 ,实验装置如下所示:
,实验装置如下所示:

(1)仪器m的名称为_______ ,装置A中发生反应的化学方程式为_______ 。
(2)装置B的作用为_______ , 装置F的作用为_______ 。
(3)在实验进行过程中,小组成员观察到装置E中的紫色石蕊试液先变红后褪色,这一现象发生的原因为_______ 。
II.实验室中可以利用 碱熔法来制备
碱熔法来制备 晶体,其步骤如下所示:
晶体,其步骤如下所示:
(4)高温条件下坩埚中发生反应的化学方程式为_______ ;为了加快水浸时固体的溶解速率,可以采取的措施有_______ (写两条)。
(5)操作X中空缺的内容为_______ ;使用恒温烘箱对所得的 晶体进行干燥时,仪器内部温度一般不宜超过120 ℃,这是由于
晶体进行干燥时,仪器内部温度一般不宜超过120 ℃,这是由于_______ 。
 在常温下化学性质非常稳定,但在加热条件下可以体现氧化性或还原性。
在常温下化学性质非常稳定,但在加热条件下可以体现氧化性或还原性。I.某实验小组计划使用
 与浓盐酸制备并收集少量
与浓盐酸制备并收集少量 ,实验装置如下所示:
,实验装置如下所示:
(1)仪器m的名称为
(2)装置B的作用为
(3)在实验进行过程中,小组成员观察到装置E中的紫色石蕊试液先变红后褪色,这一现象发生的原因为
II.实验室中可以利用
 碱熔法来制备
碱熔法来制备 晶体,其步骤如下所示:
晶体,其步骤如下所示: ①碱熔:在铁制坩埚中将一定量的  与 与 的混合物用酒精喷灯加热至熔化后,向其中逐步加入 的混合物用酒精喷灯加热至熔化后,向其中逐步加入 粉末并用铁棒搅拌,待加热至5分钟时关闭酒精喷灯,冷却到室温后可见坩埚中存在墨绿色的块状固体,其中主要成分为 粉末并用铁棒搅拌,待加热至5分钟时关闭酒精喷灯,冷却到室温后可见坩埚中存在墨绿色的块状固体,其中主要成分为 与 与 。 。②水浸:将坩埚中的块状固体转移至烧杯中,加足量水溶解。 ③歧化:向所得的  溶液中通入适量的 溶液中通入适量的 ,促使 ,促使 歧化为 歧化为 与 与 。 。④过滤:除去溶液中的不溶性物质。 ⑤操作X:加热浓缩、冷却结晶、过滤、_______、干燥。 |
(5)操作X中空缺的内容为
 晶体进行干燥时,仪器内部温度一般不宜超过120 ℃,这是由于
晶体进行干燥时,仪器内部温度一般不宜超过120 ℃,这是由于
您最近一年使用:0次
2022-10-24更新
|
407次组卷
|
3卷引用:内蒙古自治区达拉特旗第一中2021-2022学年高一上学期期末考试化学试题
3 . 甘氨酸亚铁[(NH2CH2COO)2Fe]是一种补铁强化剂。实验室以FeCO3与甘氨酸(NH2CH2COOH)为原料制备甘氨酸亚铁的装置如图所示(夹持和加热仪器已省略)。
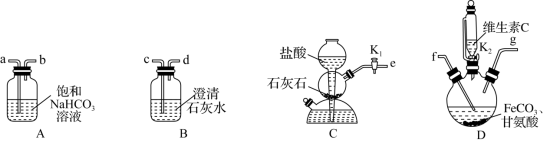
已知:
①甘氨酸易溶于水,微溶于乙醇;甘氨酸亚铁易溶于水,难溶于乙醇。
②维生素C易溶于水,具有较强的还原性和酸性。
回答下列问题:
(1)装置D中盛放维生素C的仪器名称是_______ ,上述装置依次连接的合理顺序为e→_______ (按气流方向,用小写字母表示)。
(2)实验开始时,先关闭K2,打开K1,当_______ (填实验现象)时,关闭K1,打开K2,进行实验。
(3)为了提高甘氨酸亚铁的产率,需要控制D中溶液的pH不能过高或过低。加入维生素C促进FeCO3溶解并调节溶液pH,维生素C的作用还有_______ 。
(4)写出装置D中生成甘氨酸亚铁的化学方程式:_______ 。
(5)实验结束后过滤,滤液经蒸发结晶、过滤、洗涤、干燥,得到甘氨酸亚铁。洗涤所选用的最佳试剂是_______ (填字母)。
a.蒸馏水 b.维生素C c.乙醇
(6)测定产品的含量。实验步骤如下:称量a g产品于锥形瓶中,溶解后进行必要处理,用容量瓶配制成200ml溶液,量取20.00ml,并加入2滴指示剂,用c mol/L Ce(SO4)2标准溶液滴定至终点,消耗标准溶液的体积为b mL。(已知滴定反应为Ce4++Fe2+=Ce3++Fe3+)
①产品中甘氨酸亚铁的质量分数表达式为_______ 。
②若滴定前滴定管内无气泡,滴定结束后有气泡,会使测定结果_______ (填“偏高”、“偏低”或“无影响”)。

已知:
①甘氨酸易溶于水,微溶于乙醇;甘氨酸亚铁易溶于水,难溶于乙醇。
②维生素C易溶于水,具有较强的还原性和酸性。
回答下列问题:
(1)装置D中盛放维生素C的仪器名称是
(2)实验开始时,先关闭K2,打开K1,当
(3)为了提高甘氨酸亚铁的产率,需要控制D中溶液的pH不能过高或过低。加入维生素C促进FeCO3溶解并调节溶液pH,维生素C的作用还有
(4)写出装置D中生成甘氨酸亚铁的化学方程式:
(5)实验结束后过滤,滤液经蒸发结晶、过滤、洗涤、干燥,得到甘氨酸亚铁。洗涤所选用的最佳试剂是
a.蒸馏水 b.维生素C c.乙醇
(6)测定产品的含量。实验步骤如下:称量a g产品于锥形瓶中,溶解后进行必要处理,用容量瓶配制成200ml溶液,量取20.00ml,并加入2滴指示剂,用c mol/L Ce(SO4)2标准溶液滴定至终点,消耗标准溶液的体积为b mL。(已知滴定反应为Ce4++Fe2+=Ce3++Fe3+)
①产品中甘氨酸亚铁的质量分数表达式为
②若滴定前滴定管内无气泡,滴定结束后有气泡,会使测定结果
您最近一年使用:0次
22-23高三上·北京西城·期中
名校
解题方法
4 . CN-会造成水体污染,某研究小组按图所示装置模拟电化学法除去CN- (实验数据如表)。实验(1)中一段时间后,在装置甲X极(Fe)附近滴入K3[Fe(CN)6]溶液,Fe表面有蓝色沉淀生成;装置乙石墨(Ⅰ)表面有无毒气体生成。已知:K3[Fe(CN)6]溶液具有氧化性

依据上述实验现象和数据,下列说法不正确 的是

| 实验序号 | 电极(X) | NaCl溶液浓度(mol/L) | 甲中石墨表面通入气体 | 电流计读数(A) |
| (1) | Fe | 0.1 | 空气 | I |
| (2) | Al | 0.1 | 空气 | 1.5I |
| (3) | Fe | 0.1 | O2 | 2I |
| (4) | Al | 0.5 | 空气 | 1.6I |
| A.仅依据实验(1)装置甲中的现象,不能确定X极(Fe)为负极 |
| B.若实验(1)中X极换成Zn,则电流计读数的范围为1.5I~2I |
C.石墨(Ⅰ)的电极反应式:2CN-+12OH--10e-=2CO +N2↑+6H2O +N2↑+6H2O |
| D.相同条件下,X电极活性、O2浓度、电解质溶液浓度均会影响CN-处理效果 |
您最近一年使用:0次
名校
解题方法
5 . 一氯化碘(ICl)是一种卤素互化物。卤素互化物具有强氧化性稀溶液,可与金属直接反应,也可用作有机合成中的碘化剂,一般可由卤素单质直接化合制得。有关一氯化碘制备及性质验证,请回答下列问题:
I.海藻提碘可得到I2的CCl4溶液,从其中回收I2的流程如下:
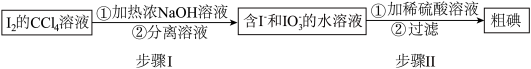
(1)步骤I的分离溶液操作中,主要用到的玻璃仪器有烧杯和_______ ,步骤Ⅱ的反应中氧化剂与还原剂的物质的量之比为_______ 。
(2)回收获得的粗碘可采用如图所示的简易装置分离提纯。将粉状物放入蒸发皿中并小火加热,碘晶体在扎有小孔的滤纸上凝结,该分离提纯方法的名称是_______ 。

Ⅱ.某学习小组在实验室中拟用下图装置制取纯净、干燥的氯气,并利用氯气与碘反应制备一氯化碘。
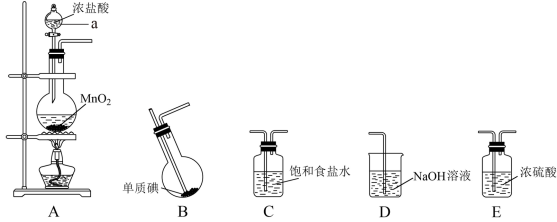
查阅资料了解到以下内容:
①碘与氯气的反应为放热反应
②ICl是一种红棕色液体,沸点97.4℃,不溶于水
③ICl能与KI反应生成I2
请回答下列问题:
(3)各装置连接顺序为A→_______→_______→_______→_______;_______
(4)B装置烧瓶需放在冷水中,其目的是:_______ ,B装置得到的液态产物进一步提纯可得到较纯净的ICl,采取的方法是_______ 。
(5)ICl与稀NaOH溶液可发生非氧化还原反应,请写出该反应的离子方程式_______ 。
(6)请设计简单的实验证明ICl的氧化性比I2强:_______ 。
I.海藻提碘可得到I2的CCl4溶液,从其中回收I2的流程如下:

(1)步骤I的分离溶液操作中,主要用到的玻璃仪器有烧杯和
(2)回收获得的粗碘可采用如图所示的简易装置分离提纯。将粉状物放入蒸发皿中并小火加热,碘晶体在扎有小孔的滤纸上凝结,该分离提纯方法的名称是

Ⅱ.某学习小组在实验室中拟用下图装置制取纯净、干燥的氯气,并利用氯气与碘反应制备一氯化碘。

查阅资料了解到以下内容:
①碘与氯气的反应为放热反应
②ICl是一种红棕色液体,沸点97.4℃,不溶于水
③ICl能与KI反应生成I2
请回答下列问题:
(3)各装置连接顺序为A→_______→_______→_______→_______;
(4)B装置烧瓶需放在冷水中,其目的是:
(5)ICl与稀NaOH溶液可发生非氧化还原反应,请写出该反应的离子方程式
(6)请设计简单的实验证明ICl的氧化性比I2强:
您最近一年使用:0次
2023-01-19更新
|
407次组卷
|
2卷引用:内蒙古自治区呼和浩特市2022-2023学年高三上学期质量普查调研考试化学试题
名校
解题方法
6 . PH3是一种易自燃的气体,能被CuSO4溶液吸收生成Cu3P。实验室利用白磷与过量的NaOH溶液制备PH3,其装置如图所示(加热装置已略去;反应过程中同时有NaH2PO2生成)。下列说法错误的是


| A.不可用排空气法收集PH3 |
| B.制取PH3时,n(PH3):n(NaH2PO2)=3:1 |
| C.加入白磷前应先通入氮气 |
| D.CuSO4溶液吸收PH3利用了Cu2+的氧化性 |
您最近一年使用:0次
2022-12-09更新
|
81次组卷
|
3卷引用:内蒙古乌兰浩特市第一中学2022-2023学年高三上学期期中考试化学试题
7 . “华龙一号”反应堆是由中国两大核电企业中国核工业集团公司和中国广核集团在30余年核电科研、建设和运行经验的基础上,研发的先进百万千瓦级压水堆核裂变发电技术,是中国核电创新发展的重大标志性成果。回答下列问题:
I. 天然铀矿中含有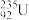 和
和 ,但其中裂变可用的
,但其中裂变可用的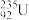 只占总储量的0.71%,需要经过富集浓缩到达3%才能被核电站所利用,
只占总储量的0.71%,需要经过富集浓缩到达3%才能被核电站所利用, 是铀浓缩活动中的关键物质,其具体生产流程如下。
是铀浓缩活动中的关键物质,其具体生产流程如下。
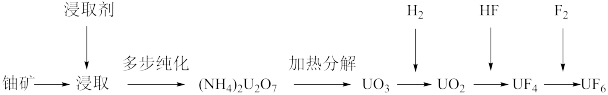
(1)下列说法正确的是___________(填标号)。
(2) 分解的化学方程式为
分解的化学方程式为___________ 。
(3)理论上,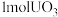 完全转化为
完全转化为 所消耗的
所消耗的 、
、 、
、 质量比为
质量比为___________ (写最简整数比)。
(4)核反应堆工作时发生的核反应为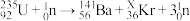 ,则
,则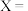
___________ 。
II. 核废料中 价的铀(存在形式为
价的铀(存在形式为 )可以通过电化学法处理,其装置如图所示。
)可以通过电化学法处理,其装置如图所示。

已知阴极上发生反应: 、
、
阴极区溶液中发生反应: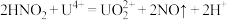 、
、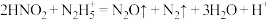
(5)阳极上的电极反应式为___________ 。
(6)对于反应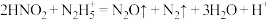 ,当生成的
,当生成的 在标准状况下的体积为2.24 L时,共有
在标准状况下的体积为2.24 L时,共有___________ mol电子转移。
(7)阴极区溶液中加入 的作用是
的作用是___________ 。
I. 天然铀矿中含有
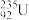 和
和 ,但其中裂变可用的
,但其中裂变可用的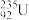 只占总储量的0.71%,需要经过富集浓缩到达3%才能被核电站所利用,
只占总储量的0.71%,需要经过富集浓缩到达3%才能被核电站所利用, 是铀浓缩活动中的关键物质,其具体生产流程如下。
是铀浓缩活动中的关键物质,其具体生产流程如下。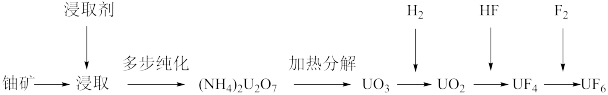
(1)下列说法正确的是___________(填标号)。
| A.为提高浸取率,可以将铀矿粉碎,并适当提高浸取温度 |
B.转化 应在陶瓷而非钢铁容器内进行 应在陶瓷而非钢铁容器内进行 |
C.最后得到的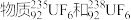 互为同位素 互为同位素 |
D.若要进一步分离 和 和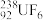 以制备核燃料,应采用物理方法 以制备核燃料,应采用物理方法 |
 分解的化学方程式为
分解的化学方程式为(3)理论上,
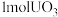 完全转化为
完全转化为 所消耗的
所消耗的 、
、 、
、 质量比为
质量比为(4)核反应堆工作时发生的核反应为
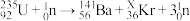 ,则
,则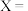
II. 核废料中
 价的铀(存在形式为
价的铀(存在形式为 )可以通过电化学法处理,其装置如图所示。
)可以通过电化学法处理,其装置如图所示。
已知阴极上发生反应:
 、
、
阴极区溶液中发生反应:
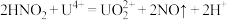 、
、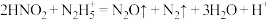
(5)阳极上的电极反应式为
(6)对于反应
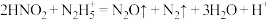 ,当生成的
,当生成的 在标准状况下的体积为2.24 L时,共有
在标准状况下的体积为2.24 L时,共有(7)阴极区溶液中加入
 的作用是
的作用是
您最近一年使用:0次
解题方法
8 . 在实验室里用乙醇、冰醋酸和浓硫酸来制备一种有香味的物质,实验装置如图所示,请根据要求作答。

(1)写出该反应的化学方程式。_______ ,反应类型:_______ 。
(2)往甲试管中加入_____ 可防止暴沸。乙中所盛的试剂为_____ ,该溶液的主要作用是:_____ 、____ 。
(3)实验室怎样鉴别乙酸和乙醇?_______ 。
(4)该装置图中有一个明显的错误是_______ 。

(1)写出该反应的化学方程式。
(2)往甲试管中加入
(3)实验室怎样鉴别乙酸和乙醇?
(4)该装置图中有一个明显的错误是
您最近一年使用:0次
9 . 随着可燃冰开采领域的不断扩大,我国已处于世界绝对领先地位。将甲烷((CH4)催化转化为有价值的化学工业品一直是我国化学工作 者的研究热点。最近徐君团队研发出了一种Au在ZSM-5分子筛上催化氧化甲烷生产CH3OH和CH3COOH的技术,该技术涉及的反应如下:
反应Ⅰ 2CH4(g)+O2(g) 2CH3OH(g) △H1= -251.0kJ·mol-1;
2CH3OH(g) △H1= -251.0kJ·mol-1;
反应Ⅱ 2CH4(g)+2O2(g) CH3COOH(g)+2H2O(g) △H2 = -812.4kJ· mol-1。
CH3COOH(g)+2H2O(g) △H2 = -812.4kJ· mol-1。
请回答下列问题:
(1)部分化学键的键能数据如下表所示:
则C-O的键能为_______ kJ·mol-1。
(2)反应II在热力学上进行的趋势很大,原因为_______ 。除降低温度外,能同时提高CH3OH和CH3COOH的平衡产率的措施为_______ (任答一条)。
(3)T℃下,向含有少量Au-ZSM-5分子筛催化剂的体积为VL的刚性密闭容器中充入1molCH4和2molO2发生反应I和反应II。达到平衡时测得CH4的物质的量为a mol, CH3COOH(g)的物质 的量为b mol,此时O2(g)的浓度为_______ mol·L-1 (用含a、b、v的代数式表示,要求化简,下同),该温度下反应II的平衡常数为_______ 。
(4)徐君教授研究后发现在Au-ZSM-5分子筛催化剂表面,反应I中O2的解离过程和CH4的活化过程的机理如下图所示(·代表吸附态):
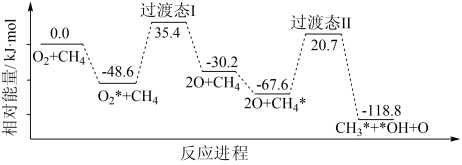
该反应进程中,O2的解离是_______ (填“吸热”或“放热”)的反应,该过程的反应速率_______ (填“大于”或“小于”)CH4的活化反应的反应速率。
(5)以CH4和O2为基本原料,采用电解法也可以制备CH3COOH,其装置如下图所示:
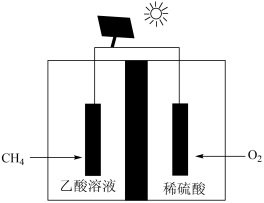
通入CH4的电极反应式为_______ 该装置工作时发生的能量转化形式为_______ (不考虑热能的转化)。
反应Ⅰ 2CH4(g)+O2(g)
 2CH3OH(g) △H1= -251.0kJ·mol-1;
2CH3OH(g) △H1= -251.0kJ·mol-1;反应Ⅱ 2CH4(g)+2O2(g)
 CH3COOH(g)+2H2O(g) △H2 = -812.4kJ· mol-1。
CH3COOH(g)+2H2O(g) △H2 = -812.4kJ· mol-1。请回答下列问题:
(1)部分化学键的键能数据如下表所示:
| 化学键 | O=O | C-H | O-H |
| 键能E/kJ·mol-1 | 498 | 414 | 390.8 |
则C-O的键能为
(2)反应II在热力学上进行的趋势很大,原因为
(3)T℃下,向含有少量Au-ZSM-5分子筛催化剂的体积为VL的刚性密闭容器中充入1molCH4和2molO2发生反应I和反应II。达到平衡时测得CH4的物质的量为a mol, CH3COOH(g)的物质 的量为b mol,此时O2(g)的浓度为
(4)徐君教授研究后发现在Au-ZSM-5分子筛催化剂表面,反应I中O2的解离过程和CH4的活化过程的机理如下图所示(·代表吸附态):

该反应进程中,O2的解离是
(5)以CH4和O2为基本原料,采用电解法也可以制备CH3COOH,其装置如下图所示:

通入CH4的电极反应式为
您最近一年使用:0次
2022-05-31更新
|
267次组卷
|
2卷引用:内蒙古自治区赤峰市2022届高三下学期4月模拟考试理综合化学试题
10 . 高锰酸钾为黑紫色、细长的棱形结晶或颗粒,是一种强氧化剂,可溶于水它常用作消毒剂、水净化剂、氧化剂、漂白剂、毒气吸收剂、二氧化碳精制剂等。
Ⅰ.氯气氧化K2MnO4制备KMnO4
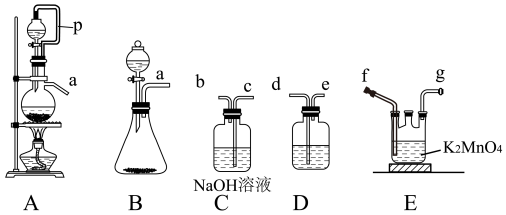
(1)若实验室选用A装置制备Cl2,导管P的作用为_______
(2)若实验室选用B装置制备氯气,当锥形瓶中放置的药品为漂白粉,则对应的离子方程式为_______ 。
(3)D装置中的试剂为_______ ,用氯气氧化K2MnO4,则其接口顺序为 a→_______ (按气流方向从左到右,用小写字母表示,A和B 选其中一个,其它装置只选用一次)。
(4)用惰性电极电解K2MnO4溶液也可以制备KMnO4,则电解的总反应方程式为_______
Ⅱ.做标准液测定草酸晶体(H2C2O4·XH2O)中的X值,实验步骤如下:①称取ag纯草酸晶体,将其配成250.00mL的溶液作为待测液。②取25.00mL待测液于锥形瓶中,加入适量的稀H2SO4,再用浓度为Cmol/L的酸性高锰酸钾进行滴定,达到滴定终点时平均消耗标准液VmL。
(5)求得X的表达式为_______ (用含a、C、V表示)。
(6)讨论:①若滴定至终点时仰视滴定管的读数,则由此测得X的值会_______
②若装高锰酸钾的酸式滴定管未润洗,则由此测得X的值会_______
Ⅰ.氯气氧化K2MnO4制备KMnO4

(1)若实验室选用A装置制备Cl2,导管P的作用为
(2)若实验室选用B装置制备氯气,当锥形瓶中放置的药品为漂白粉,则对应的离子方程式为
(3)D装置中的试剂为
(4)用惰性电极电解K2MnO4溶液也可以制备KMnO4,则电解的总反应方程式为
Ⅱ.做标准液测定草酸晶体(H2C2O4·XH2O)中的X值,实验步骤如下:①称取ag纯草酸晶体,将其配成250.00mL的溶液作为待测液。②取25.00mL待测液于锥形瓶中,加入适量的稀H2SO4,再用浓度为Cmol/L的酸性高锰酸钾进行滴定,达到滴定终点时平均消耗标准液VmL。
(5)求得X的表达式为
(6)讨论:①若滴定至终点时仰视滴定管的读数,则由此测得X的值会
②若装高锰酸钾的酸式滴定管未润洗,则由此测得X的值会
您最近一年使用:0次



