解题方法
1 . X、Y、Z、M为原子序数依次增大的短周期主族元素,这四种元素原子的最外层电子数之和等于12。A~G是由上述四种元素组成的化合物,其转化关系如图所示,其中C是一种强碱,焰色试验呈黄色。

回答下列问题:
(1)元素Y在元素周期表中的位置是___________ 。
(2)Y、Z、M三种元素的原子半径由大到小的顺序为___________ (用元素符号表示)。
(3)能说明Z的非金属性强于Y的依据是___________ (写一点即可)。
(4)写出反应①的离子方程式___________ 。
(5)去除A溶液中混有的少量B的方法是___________ 。
(6)3.9g固体D与足量F反应转移的电子数目为___________ 。
(7)下列实验方案中,能测定出物质A和B的混合物中B的质量分数的是___________ (填标号)。
a.取mg混合物充分加热,质量减少ng
b.取mg混合物与足量稀盐酸充分反应,加热、蒸干、灼烧,得到ng固体
c.取mg混合物与足量NaOH溶液充分反应,得到ng溶液
d.取mg混合物与足量稀硫酸充分反应,逸出气体经干燥后用碱石灰吸收,质量增加ng

回答下列问题:
(1)元素Y在元素周期表中的位置是
(2)Y、Z、M三种元素的原子半径由大到小的顺序为
(3)能说明Z的非金属性强于Y的依据是
(4)写出反应①的离子方程式
(5)去除A溶液中混有的少量B的方法是
(6)3.9g固体D与足量F反应转移的电子数目为
(7)下列实验方案中,能测定出物质A和B的混合物中B的质量分数的是
a.取mg混合物充分加热,质量减少ng
b.取mg混合物与足量稀盐酸充分反应,加热、蒸干、灼烧,得到ng固体
c.取mg混合物与足量NaOH溶液充分反应,得到ng溶液
d.取mg混合物与足量稀硫酸充分反应,逸出气体经干燥后用碱石灰吸收,质量增加ng
您最近一年使用:0次
名校
2 . A、B、C、D、E、F、G为中学化学常见物质,它们之间有如图转化关系(反应条件已略去)。已知:A、C、D、E均含有同种非金属元素M,A为气态氢化物;G是一种紫红色的金属单质;B是空气的组成成分,在空气中占比约为21%。根据学知识,按要求回答下列问题:

Ⅰ.若A具有臭鸡蛋气味,且能与C反应生成一种淡黄色非金属单质,反应①为非氧化还原反应,反应②为E的浓溶液与G反应,则:
(1)M元素在元素周期表中的位置为_______ 。
(2)写出反应②的化学方程式:_______ ,该反应中体现了E的浓溶液的强氧化性和_______ 性。
(3)将C通入足量溴水中,发生反应的离子方程式为_______ ;将C通入少量品红溶液中可观察到的现象为_______ 。
Ⅱ.若光照条件下,E的浓溶液易分解得到B、D、F3种物质;大量排放汽车尾气中的C、D会导致光化学烟雾,已知:反应②为E的稀溶液与G反应。
(4)写出A+B→C+F的化学方程式:_______ 。
(5)常温下,将60mL C、D的混合气体与30mL B同时通入水中,充分反应后,剩余7.5mL气体,则60mL混合气体中C的体积分数可能为_______ (填标号)。
①15.00% ②25.00% ③41.25% ④68.75%

Ⅰ.若A具有臭鸡蛋气味,且能与C反应生成一种淡黄色非金属单质,反应①为非氧化还原反应,反应②为E的浓溶液与G反应,则:
(1)M元素在元素周期表中的位置为
(2)写出反应②的化学方程式:
(3)将C通入足量溴水中,发生反应的离子方程式为
Ⅱ.若光照条件下,E的浓溶液易分解得到B、D、F3种物质;大量排放汽车尾气中的C、D会导致光化学烟雾,已知:反应②为E的稀溶液与G反应。
(4)写出A+B→C+F的化学方程式:
(5)常温下,将60mL C、D的混合气体与30mL B同时通入水中,充分反应后,剩余7.5mL气体,则60mL混合气体中C的体积分数可能为
①15.00% ②25.00% ③41.25% ④68.75%
您最近一年使用:0次
2022-05-20更新
|
575次组卷
|
3卷引用:河南省安阳市2021-2022学年高一下学期阶段性考试(四)化学试题
河南省安阳市2021-2022学年高一下学期阶段性考试(四)化学试题河南省许平汝漯2021-2022学年高一下学期5月大联考化学试题(已下线)第15练 实验综合题与无机综合题-2022年【暑假分层作业】高一化学(人教版2019必修第二册)
解题方法
3 . 从铝土矿废料“赤泥”(主要成分为Al2O3、Fe2O3、TiO2、Sc2O3)中提钪与TiO2的一种工艺如下:
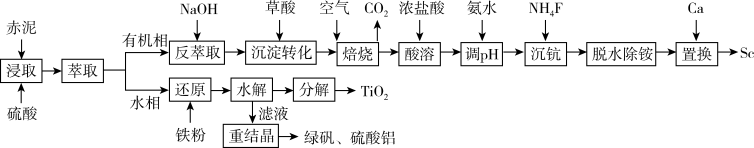
已知:该工艺条件下,溶液中相关离子开始沉淀和完全沉淀的pH值如下表:
(1)钪为21号元素,该元素在元素周期表中的位置是_______ 。
(2)“沉淀转化”过程中,需加入过量的草酸,其原因是_______ 。
(3)“焙烧”过程中,生成Sc2O3的化学方程式为_______ 。
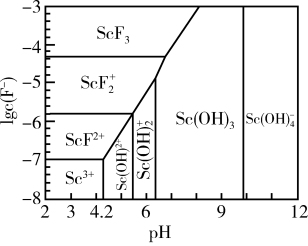
(4)常温下,三价Sc的几种存在形式与氟离子浓度的对数[lgc(F-)、pH的关系如图所示。已知c(F-)=1×10-5,“调pH”过程中控制pH=4.0,则调节pH值后三价Sc的存在形式为_______ (填化学式)。
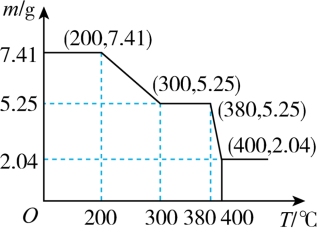
(5)“脱水除铵”过程中,复盐3NH4Cl·ScF3·aH2O分解得到ScF3,某固体样品质量与温度的关系如图所示。加热至380-400℃产生白烟,400℃以上质量不再改变。则a=_______ (填数字)。
(6)“水解”过程中,加水稀释后,TiOSO4水解为TiO2·xH2O的离子方程式为_______ ;应控制溶液的pH值为_______ 。

已知:该工艺条件下,溶液中相关离子开始沉淀和完全沉淀的pH值如下表:
| 离子 | Fe2+ | Fe3+ | Al3+ | TiO2+ |
| 开始沉淀pH | 7.0 | 1.9 | 3.0 | 0.3 |
| 完全沉淀pH | 9.0 | 3.2 | 4.7 | 2.0 |
(1)钪为21号元素,该元素在元素周期表中的位置是
(2)“沉淀转化”过程中,需加入过量的草酸,其原因是
(3)“焙烧”过程中,生成Sc2O3的化学方程式为
(4)常温下,三价Sc的几种存在形式与氟离子浓度的对数[lgc(F-)、pH的关系如图所示。已知c(F-)=1×10-5,“调pH”过程中控制pH=4.0,则调节pH值后三价Sc的存在形式为

(5)“脱水除铵”过程中,复盐3NH4Cl·ScF3·aH2O分解得到ScF3,某固体样品质量与温度的关系如图所示。加热至380-400℃产生白烟,400℃以上质量不再改变。则a=

(6)“水解”过程中,加水稀释后,TiOSO4水解为TiO2·xH2O的离子方程式为
您最近一年使用:0次
4 . 如图为元素周期表的一部分,请参照元素①~⑧在表中的位置,回答下列问题。
(1)表中某元素最高价氧化物的水化物与其氢化物之间能相互反应生成离子化合物,则该离子化合物的名称是____ ,由元素④、⑥、⑦、⑧形成的简单离子的半径由大到小的顺序是____ (用离子符号表示)。②、④元素的最简单氢化物的沸点由高到低的顺序是____ 。(用化学式表示)
(2)分别由上述两种元素组成、均为10e-的阴、阳离子,在加热条件下反应生成两种10e-的分子,写出该反应的离子方程式____ 。
(3)元素周期表中氧化性最强的元素是____ (写元素符号),该元素的单质和水反应的化学方程式为___ 。
(4)以上元素组成的物质有下列框图中的转化关系,其中f为⑥的单质,甲为10电子微粒,h是⑨的单质。
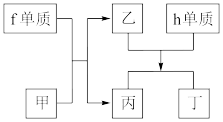
①丁属于___ (选填“离子化合物”或“共价化合物”)。
②请写出h单质与乙反应的化学方程式____ 。
| 族 周期 | ⅠA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | Ⅶ | |
| 2 | ② | ③ | ④ | ⑤ | ||||
| 3 | ⑥ | ⑦ | ⑨ | ⑧ | ||||
(2)分别由上述两种元素组成、均为10e-的阴、阳离子,在加热条件下反应生成两种10e-的分子,写出该反应的离子方程式
(3)元素周期表中氧化性最强的元素是
(4)以上元素组成的物质有下列框图中的转化关系,其中f为⑥的单质,甲为10电子微粒,h是⑨的单质。

①丁属于
②请写出h单质与乙反应的化学方程式
您最近一年使用:0次
5 . 短周期元素a、b、c、d在元素周期表中的相对位置如图所示,其中d在同周期中原子半径最小。回答下列问题:
(1)属于碱金属元素的有___ (填元素符号)。
(2)d在元素周期表中的位置是___ 。
(3)写出由a、b形成的既含极性键又含非极性键的化合物的电子式:___ 。
(4)如图表示某些物质之间的转化关系,其中化合物A是由c、d两种元素组成的二元化合物,L为b的一种单质;常温下M为深红棕色液体,Q可用来检验淀粉的存在。
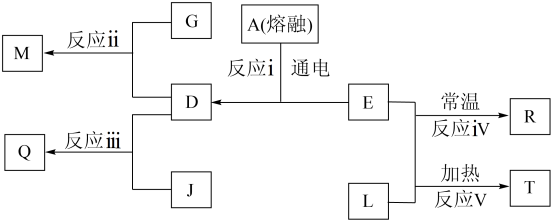
①化合物A在熔融时的电离方程式是___ 。
②反应ⅱ、反应ⅲ说明元素非金属性的强弱关系是___ (用元素符号表示)。
③写出T与水反应的离子方程式:___ 。
| a | |||||
| …… | b | ||||
| c | d | ||||
(2)d在元素周期表中的位置是
(3)写出由a、b形成的既含极性键又含非极性键的化合物的电子式:
(4)如图表示某些物质之间的转化关系,其中化合物A是由c、d两种元素组成的二元化合物,L为b的一种单质;常温下M为深红棕色液体,Q可用来检验淀粉的存在。

①化合物A在熔融时的电离方程式是
②反应ⅱ、反应ⅲ说明元素非金属性的强弱关系是
③写出T与水反应的离子方程式:
您最近一年使用:0次
6 . B、D、C、A、E五种元素的原子序数顺序依次增大,其中只有E为金属元素,D、C元素在元素周期表中位置相邻,在一定条件下,B的单质可以分别和A、C、D的单质化合生成甲、乙、丙化合物,C的单质和D的单质化合可得丁,戊、己、庚均为化合物。已知乙、丙每个分子中均含有10个电子,如图为相互转化关系:
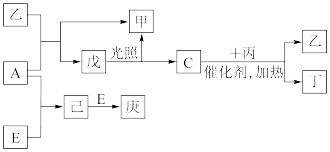
请回答下列问题:
(1)写出C、D氢化物的稳定性由强到弱的顺序_______ (用化学式表示)。
(2) A、B、D三种元素形成的化合物中其中一种可用作化肥,写该化合物的电子式_______ 。
(3)写出C与丙反应的化学反应方程式_______ 。
(4)写出工业上冶炼金属E的主要化学方程式:_______ 。
(5)工业上通过如下转化可制得含A元素的钾盐KAO3晶体:
NaA溶液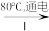 NaAO3
NaAO3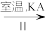 KAO3晶体
KAO3晶体
①完成Ⅰ中反应的总化学方程式:_______NaA+_______H2O _______NaAO3+_______。
_______NaAO3+_______。_______
②Ⅱ中反应过程能析出KClO3晶体而无其他晶体析出的原因是_______ 。

请回答下列问题:
(1)写出C、D氢化物的稳定性由强到弱的顺序
(2) A、B、D三种元素形成的化合物中其中一种可用作化肥,写该化合物的电子式
(3)写出C与丙反应的化学反应方程式
(4)写出工业上冶炼金属E的主要化学方程式:
(5)工业上通过如下转化可制得含A元素的钾盐KAO3晶体:
NaA溶液
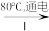 NaAO3
NaAO3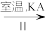 KAO3晶体
KAO3晶体①完成Ⅰ中反应的总化学方程式:_______NaA+_______H2O
 _______NaAO3+_______。
_______NaAO3+_______。②Ⅱ中反应过程能析出KClO3晶体而无其他晶体析出的原因是
您最近一年使用:0次
7 . 以废旧铅酸电池中的含铅废料(Pb、PbO、PbO2、PbSO4及炭黑等)和H2SO4为原料,制备高纯PbO,实现铅的再生利用。其工作流程如下:

(1)铅是碳的同族元素,且比碳多4个电子层,则铅在元素周期表中位置___________
(2)过程Ⅰ中,在 催化下,Pb和
催化下,Pb和 反应生成
反应生成 的离子方程式是
的离子方程式是___________ 。
(3)过程Ⅰ中, 催化过程可表示为:
催化过程可表示为:
ⅰ: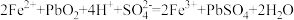
ⅱ:……
①写出ⅱ的化学方程式:___________ 。
②请设计实验方案可证实上述催化过程。将实验方案补充完整。
a.向酸化的 溶液中加入
溶液中加入___________ 溶液,溶液无颜色变化,再加入少量 ,溶液变为
,溶液变为___________ 色。
b.向a得到的溶液中加入Pb,溶液恢复原来的颜色。
(4)配制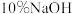 溶液时,所需玻璃仪器除量筒外还有
溶液时,所需玻璃仪器除量筒外还有___________ (填标号)。
A.容量瓶 B.烧杯 C.烧瓶 D.玻璃棒 E.胶头滴管
(5)锡与铅同族,锡及其化合物在生产、生活中有着重要的用途。已知:Sn的熔点为231℃;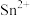 易水解、易被氧化;
易水解、易被氧化; 极易水解、熔点为-33℃、沸点为114℃。用于镀锡工业的硫酸亚锡(SnSO4)的制备路线如下:
极易水解、熔点为-33℃、沸点为114℃。用于镀锡工业的硫酸亚锡(SnSO4)的制备路线如下:

①骤Ⅰ加入Sn粉的作用:___________ 。
②步骤Ⅳ中检验 是否洗涤干净的操作是
是否洗涤干净的操作是___________ ,证明已洗净。
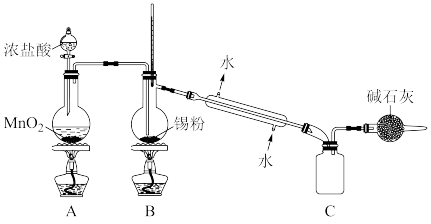
③实验室欲用下图装置制备少量 (夹持装置略),该装置存在明显缺陷,改进方法是
(夹持装置略),该装置存在明显缺陷,改进方法是___________ ,装有碱石灰的球形干燥管的作用是___________ 。

(1)铅是碳的同族元素,且比碳多4个电子层,则铅在元素周期表中位置
(2)过程Ⅰ中,在
 催化下,Pb和
催化下,Pb和 反应生成
反应生成 的离子方程式是
的离子方程式是(3)过程Ⅰ中,
 催化过程可表示为:
催化过程可表示为:ⅰ:
ⅱ:……
①写出ⅱ的化学方程式:
②请设计实验方案可证实上述催化过程。将实验方案补充完整。
a.向酸化的
 溶液中加入
溶液中加入 ,溶液变为
,溶液变为b.向a得到的溶液中加入Pb,溶液恢复原来的颜色。
(4)配制
 溶液时,所需玻璃仪器除量筒外还有
溶液时,所需玻璃仪器除量筒外还有A.容量瓶 B.烧杯 C.烧瓶 D.玻璃棒 E.胶头滴管
(5)锡与铅同族,锡及其化合物在生产、生活中有着重要的用途。已知:Sn的熔点为231℃;
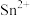 易水解、易被氧化;
易水解、易被氧化; 极易水解、熔点为-33℃、沸点为114℃。用于镀锡工业的硫酸亚锡(SnSO4)的制备路线如下:
极易水解、熔点为-33℃、沸点为114℃。用于镀锡工业的硫酸亚锡(SnSO4)的制备路线如下:
①骤Ⅰ加入Sn粉的作用:
②步骤Ⅳ中检验
 是否洗涤干净的操作是
是否洗涤干净的操作是③实验室欲用下图装置制备少量
 (夹持装置略),该装置存在明显缺陷,改进方法是
(夹持装置略),该装置存在明显缺陷,改进方法是
您最近一年使用:0次
解题方法
8 . 我国科学家相继发明了具有重要工业应用价值的新型非线性光学晶体BBO、LBO,又陆续发展了具有重要应用前景的深紫外非线性光学晶体KBBF、SBBO等,为我国光学事业做出了卓越贡献。
请回答下列问题:
(1)KBBF的化学式为KBe2BO3F2,KBBF晶体的棱镜耦合技术在国际上首次实现了Nd:YVO4激光的6倍频谐波光输出。
①B的价电子层排布式为___________ 。
②Y的原子序数为39,其在元素周期表中的位置为___________ 。
③KBe2BO3F2中各元素的第一电离能由小到大的顺序为___________ 。
④KBF4是合成KBBF的原料之一,其阴离子的空间构型为___________ ,与该阴离子互为等电子体的离子为___________ 。
(2)BBO晶体和LBO晶体是我国首次走向国际,并被国际上广泛应用的两种晶体。LBO晶体由Li、B、O三种元素组成,晶胞结构及沿b、c轴的投影图如图甲所示(O原子略去),晶体结构中存在(B3O7)5-基团,Li+分布在基团骨架空隙中,如图乙所示。

①LBO晶体化合物的化学式为___________ 。
②该晶体中含有的化学键有___________ ,晶体类型为___________ ,其中B采取___________ 杂化。
③已知该晶体的晶胞参数分别为apm、bpm、cpm,α=β=y=90°,则该晶体的密度ρ=___________ g·cm-3。(设阿伏加德罗常数的值为NA,用含a、b、c、NA的代数式表示)
请回答下列问题:
(1)KBBF的化学式为KBe2BO3F2,KBBF晶体的棱镜耦合技术在国际上首次实现了Nd:YVO4激光的6倍频谐波光输出。
①B的价电子层排布式为
②Y的原子序数为39,其在元素周期表中的位置为
③KBe2BO3F2中各元素的第一电离能由小到大的顺序为
④KBF4是合成KBBF的原料之一,其阴离子的空间构型为
(2)BBO晶体和LBO晶体是我国首次走向国际,并被国际上广泛应用的两种晶体。LBO晶体由Li、B、O三种元素组成,晶胞结构及沿b、c轴的投影图如图甲所示(O原子略去),晶体结构中存在(B3O7)5-基团,Li+分布在基团骨架空隙中,如图乙所示。

①LBO晶体化合物的化学式为
②该晶体中含有的化学键有
③已知该晶体的晶胞参数分别为apm、bpm、cpm,α=β=y=90°,则该晶体的密度ρ=
您最近一年使用:0次
名校
解题方法
9 . 有八种短周期主族元素 ,其中
,其中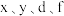 随着原子序数的递增,其原子半径的相对大小、最高正价或最低负价的变化如图1所示。
随着原子序数的递增,其原子半径的相对大小、最高正价或最低负价的变化如图1所示。 的最高价氧化物对应水化物溶液(浓度均为
的最高价氧化物对应水化物溶液(浓度均为 )的
)的 与原子序数的关系如图2所示。
与原子序数的关系如图2所示。

根据上述信息回答下列问题:
(1)g在元素周期表中的位置是___________ 。
(2)比较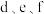 的简单离子半径大小为
的简单离子半径大小为____________________ (用离子符号表示); 的最高价氧化物对应的水化物酸性较强的是
的最高价氧化物对应的水化物酸性较强的是___________ (用化学式表示)。
(3)下列可作为比较e和f金属性强弱的依据是___________ (填字母)。
A.测等浓度相应氯化物水溶液的 B.测两种元素单质的硬度和熔、沸点
B.测两种元素单质的硬度和熔、沸点
C.比较单质作还原剂时失去的电子数目的多少D.比较单质与同浓度盐酸反应的剧烈程度
(4)由元素 组成的剧毒化合物
组成的剧毒化合物 不慎泄漏时,通常用过氧化氢溶液处理,以减少污染,反应生成一种酸式盐和一种气体,二者溶于水均呈碱性,该反应的化学方程式为
不慎泄漏时,通常用过氧化氢溶液处理,以减少污染,反应生成一种酸式盐和一种气体,二者溶于水均呈碱性,该反应的化学方程式为___________ 。
 ,其中
,其中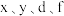 随着原子序数的递增,其原子半径的相对大小、最高正价或最低负价的变化如图1所示。
随着原子序数的递增,其原子半径的相对大小、最高正价或最低负价的变化如图1所示。 的最高价氧化物对应水化物溶液(浓度均为
的最高价氧化物对应水化物溶液(浓度均为 )的
)的 与原子序数的关系如图2所示。
与原子序数的关系如图2所示。
根据上述信息回答下列问题:
(1)g在元素周期表中的位置是
(2)比较
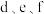 的简单离子半径大小为
的简单离子半径大小为 的最高价氧化物对应的水化物酸性较强的是
的最高价氧化物对应的水化物酸性较强的是(3)下列可作为比较e和f金属性强弱的依据是
A.测等浓度相应氯化物水溶液的
 B.测两种元素单质的硬度和熔、沸点
B.测两种元素单质的硬度和熔、沸点C.比较单质作还原剂时失去的电子数目的多少D.比较单质与同浓度盐酸反应的剧烈程度
(4)由元素
 组成的剧毒化合物
组成的剧毒化合物 不慎泄漏时,通常用过氧化氢溶液处理,以减少污染,反应生成一种酸式盐和一种气体,二者溶于水均呈碱性,该反应的化学方程式为
不慎泄漏时,通常用过氧化氢溶液处理,以减少污染,反应生成一种酸式盐和一种气体,二者溶于水均呈碱性,该反应的化学方程式为
您最近一年使用:0次
2021-07-25更新
|
210次组卷
|
3卷引用:河南省濮阳市第一高级中学2022-2023学年高三上学期第三次质量检测考试化学试题
河南省濮阳市第一高级中学2022-2023学年高三上学期第三次质量检测考试化学试题陕西省咸阳市2021届高三上学期高考模拟检测(一)化学试题(已下线)第五章能力提升检测卷(精练)-2022年高考化学一轮复习讲练测
名校
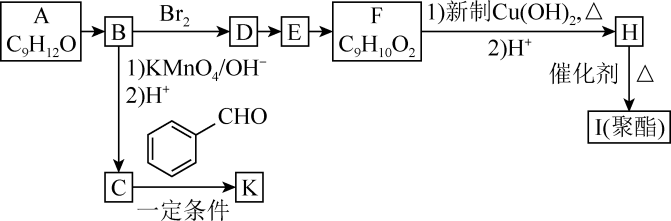
10 . 芳香族化合物A(C9H12O)常用于药物及香料的合成,A有如图转化关系:
已知:
①A是芳香族化合物且苯环侧链上有两种处于不同环境下的氢原子;
②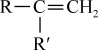
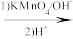
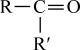 +CO2;
+CO2;
③RCOCH3+R′CHO RCOCH=CHR′+H2O。
RCOCH=CHR′+H2O。
回答下列问题:
(1)B的分子式为____ ,F具有的官能团名称是____ 。
(2)由D生成E的反应类型为____ ,由E生成F所需试剂及反应条件为____ 。
(3)K的结构简式为____ 。
(4)由H生成I的化学方程式为____ 。
(5)化合物F的同分异构体中能同时满足以下三个条件的有____ 种(不考虑立体异构)。
①能与FeCl3溶液发生显色反应;②能发生银镜反应;③苯环上有两个取代基。
其中核磁共振氢谱有6组峰,峰面积比为3:2:2:1:1:1的化合物的结构简式为____ 。
(6)糠叉丙酮( )是一种重要的医药中间体,请参考上述合成路线,设计一条由叔丁醇[(CH3)3COH]和糠醛(
)是一种重要的医药中间体,请参考上述合成路线,设计一条由叔丁醇[(CH3)3COH]和糠醛( )为原料制备糠叉丙酮的合成路线
)为原料制备糠叉丙酮的合成路线____ (无机试剂任用,用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。

已知:
①A是芳香族化合物且苯环侧链上有两种处于不同环境下的氢原子;
②
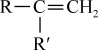
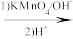
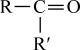 +CO2;
+CO2;③RCOCH3+R′CHO
 RCOCH=CHR′+H2O。
RCOCH=CHR′+H2O。回答下列问题:
(1)B的分子式为
(2)由D生成E的反应类型为
(3)K的结构简式为
(4)由H生成I的化学方程式为
(5)化合物F的同分异构体中能同时满足以下三个条件的有
①能与FeCl3溶液发生显色反应;②能发生银镜反应;③苯环上有两个取代基。
其中核磁共振氢谱有6组峰,峰面积比为3:2:2:1:1:1的化合物的结构简式为
(6)糠叉丙酮(
 )是一种重要的医药中间体,请参考上述合成路线,设计一条由叔丁醇[(CH3)3COH]和糠醛(
)是一种重要的医药中间体,请参考上述合成路线,设计一条由叔丁醇[(CH3)3COH]和糠醛( )为原料制备糠叉丙酮的合成路线
)为原料制备糠叉丙酮的合成路线
您最近一年使用:0次
2022-03-19更新
|
731次组卷
|
6卷引用:河南省平顶山市许昌市济源市2021-2022学年高三下学期3月第二次质量检测理科综合化学试题



