解题方法
1 . 某兴趣小组设计了一个燃料电池,并探究氯碱工业原理和粗铜的精炼原理,如图所示,其中乙装置中 为阳离子交换膜。请按要求回答相关问题:
为阳离子交换膜。请按要求回答相关问题:

(1)甲中通入氧气的电极是___________ 极(填“正”或“负”),通甲烷气体的电极反应式是___________ 。
(2)乙装置中电解的总离子方程式为___________ ,阴极产物为___________ 。
(3)若在标准状况下,有 氧气参加反应,则丙装置中阴极析出铜的质量为
氧气参加反应,则丙装置中阴极析出铜的质量为___________  。
。
(4)某同学利用铅蓄电池设计电解法制取漂白液的实验装置如图所示,a为电池的___________ 极。写出 与
与 反应生成漂白液的离子方程式:
反应生成漂白液的离子方程式:___________ 。
 为阳离子交换膜。请按要求回答相关问题:
为阳离子交换膜。请按要求回答相关问题:
(1)甲中通入氧气的电极是
(2)乙装置中电解的总离子方程式为
(3)若在标准状况下,有
 氧气参加反应,则丙装置中阴极析出铜的质量为
氧气参加反应,则丙装置中阴极析出铜的质量为 。
。(4)某同学利用铅蓄电池设计电解法制取漂白液的实验装置如图所示,a为电池的
 与
与 反应生成漂白液的离子方程式:
反应生成漂白液的离子方程式:
您最近一年使用:0次
2 . 铝灰主要含有 、
、 ,以及少量硅石和
,以及少量硅石和 的氧化物,利用铝灰制备净水剂
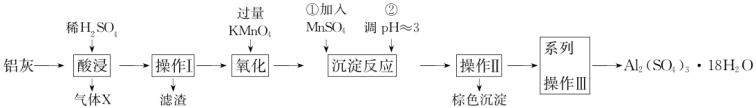
的氧化物,利用铝灰制备净水剂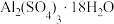 的工艺流程如图。
的工艺流程如图。
已知:金属离子浓度为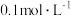 时生成氢氧化物沉淀的
时生成氢氧化物沉淀的
回答相关问题:
(1)酸浸时为确保安全应注意___________ ,酸浸充分后溶液中的金属阳离子是___________ 。
(2)操作I和II的名称是___________ 。
(3)若无氧化步骤,对实验的影响是___________ 。
(4)棕色沉淀含 。操作①加入
。操作①加入 反应的离子方程式是
反应的离子方程式是___________ ,判断该反应完成的现象是___________ 。
(5)操作②调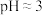 的原因是
的原因是___________ 。
(6)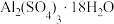 可制作聚合硫酸铝(
可制作聚合硫酸铝(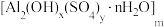 ),它是复合型高分子聚合物,净水效果优于传统的无机净水剂。若
),它是复合型高分子聚合物,净水效果优于传统的无机净水剂。若 ,则
,则
___________ 。引起聚合硫酸铝形态多变的基本成分是 ,可用实验测定其含量。称取
,可用实验测定其含量。称取 试样,将其移入锥形瓶中,用移液管加入
试样,将其移入锥形瓶中,用移液管加入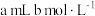 盐酸,充分溶解聚合物后,加
盐酸,充分溶解聚合物后,加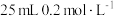 氟化钾溶液掩蔽掉全部铝离子,摇匀。加入3滴酚酞,用
氟化钾溶液掩蔽掉全部铝离子,摇匀。加入3滴酚酞,用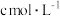 氢氧化钠标准溶液滴定至溶液呈微红色即为终点,消耗了标准液
氢氧化钠标准溶液滴定至溶液呈微红色即为终点,消耗了标准液 。则聚合硫酸铝中
。则聚合硫酸铝中 的质量分数为
的质量分数为___________ 。
 、
、 ,以及少量硅石和
,以及少量硅石和 的氧化物,利用铝灰制备净水剂
的氧化物,利用铝灰制备净水剂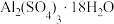 的工艺流程如图。
的工艺流程如图。
已知:金属离子浓度为
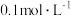 时生成氢氧化物沉淀的
时生成氢氧化物沉淀的
 |  |  | |
| 开始沉淀时 | 3.4 | 6.3 | 1.5 |
| 完全沉淀时 | 4.7 | 8.3 | 2.8 |
回答相关问题:
(1)酸浸时为确保安全应注意
(2)操作I和II的名称是
(3)若无氧化步骤,对实验的影响是
(4)棕色沉淀含
 。操作①加入
。操作①加入 反应的离子方程式是
反应的离子方程式是(5)操作②调
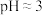 的原因是
的原因是(6)
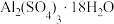 可制作聚合硫酸铝(
可制作聚合硫酸铝(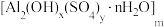 ),它是复合型高分子聚合物,净水效果优于传统的无机净水剂。若
),它是复合型高分子聚合物,净水效果优于传统的无机净水剂。若 ,则
,则
 ,可用实验测定其含量。称取
,可用实验测定其含量。称取 试样,将其移入锥形瓶中,用移液管加入
试样,将其移入锥形瓶中,用移液管加入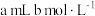 盐酸,充分溶解聚合物后,加
盐酸,充分溶解聚合物后,加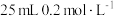 氟化钾溶液掩蔽掉全部铝离子,摇匀。加入3滴酚酞,用
氟化钾溶液掩蔽掉全部铝离子,摇匀。加入3滴酚酞,用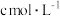 氢氧化钠标准溶液滴定至溶液呈微红色即为终点,消耗了标准液
氢氧化钠标准溶液滴定至溶液呈微红色即为终点,消耗了标准液 。则聚合硫酸铝中
。则聚合硫酸铝中 的质量分数为
的质量分数为
您最近一年使用:0次
3 . 二氧化碳催化加氢制甲醇,有利于减少温室气体二氧化碳。回答下列问题:
(1)二氧化碳加氢制甲醇的总反应可表示为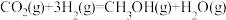 。该反应一般认为通过如下步骤来实现:
。该反应一般认为通过如下步骤来实现:
①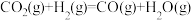
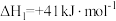
②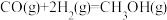
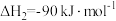
总反应的
___________  ;若反应①为慢反应,下列示意图中能体现上述反应能量变化的是
;若反应①为慢反应,下列示意图中能体现上述反应能量变化的是___________ (填字母),判断的理由是___________ 。
A.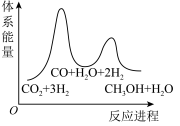 B.
B.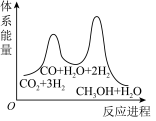 C.
C.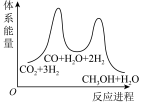 D.
D.
(2) 与
与 反应得到合成气的原理为
反应得到合成气的原理为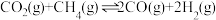 。某小组向体积是
。某小组向体积是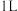 的恒容密闭容器中充入物质的量均为
的恒容密闭容器中充入物质的量均为 的
的 与
与 ,反应过程中
,反应过程中 的平衡转化率与温度、压强的关系如图所示。
的平衡转化率与温度、压强的关系如图所示。

①压强:
___________  (填“>”或“<”)。
(填“>”或“<”)。
②1100℃、 条件下,
条件下, 时反应达到平衡状态,则
时反应达到平衡状态,则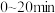 内
内 的反应速率
的反应速率
___________  ,反应的平衡常数
,反应的平衡常数
___________ (用含 的代数式表示,
的代数式表示, 为以分压表示的平衡常数,分压=总压×物质的量分数)。
为以分压表示的平衡常数,分压=总压×物质的量分数)。
(1)二氧化碳加氢制甲醇的总反应可表示为
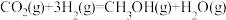 。该反应一般认为通过如下步骤来实现:
。该反应一般认为通过如下步骤来实现:①
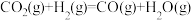
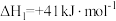
②
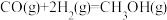
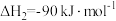
总反应的

 ;若反应①为慢反应,下列示意图中能体现上述反应能量变化的是
;若反应①为慢反应,下列示意图中能体现上述反应能量变化的是A.
 B.
B. C.
C. D.
D.
(2)
 与
与 反应得到合成气的原理为
反应得到合成气的原理为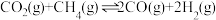 。某小组向体积是
。某小组向体积是 的恒容密闭容器中充入物质的量均为
的恒容密闭容器中充入物质的量均为 的
的 与
与 ,反应过程中
,反应过程中 的平衡转化率与温度、压强的关系如图所示。
的平衡转化率与温度、压强的关系如图所示。
①压强:

 (填“>”或“<”)。
(填“>”或“<”)。②1100℃、
 条件下,
条件下, 时反应达到平衡状态,则
时反应达到平衡状态,则 内
内 的反应速率
的反应速率
 ,反应的平衡常数
,反应的平衡常数
 的代数式表示,
的代数式表示, 为以分压表示的平衡常数,分压=总压×物质的量分数)。
为以分压表示的平衡常数,分压=总压×物质的量分数)。
您最近一年使用:0次
解题方法
4 . 为了合理利用化学能,确保安全生产,化工设计需要充分考虑化学反应的焓变,并采取相应措施。化学反应的焓变通常用实验进行测定,也可进行理论推算。
(1)下列变化过程,属于放热反应的是___________ (填序号)。
① 水解反应 ②酸碱中和反应 ③
水解反应 ②酸碱中和反应 ③ 在
在 中燃烧 ④固体
中燃烧 ④固体 溶于水 ⑤液态水变成水蒸气 ⑥碳高温条件下还原
溶于水 ⑤液态水变成水蒸气 ⑥碳高温条件下还原 ⑦浓硫酸稀释
⑦浓硫酸稀释
(2)实验测得,标准状况下 甲烷在氧气中充分燃烧生成液态水和二氧化碳气体时释放出
甲烷在氧气中充分燃烧生成液态水和二氧化碳气体时释放出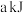 的热量,试写出表示甲烷燃烧热的热化学方程式:
的热量,试写出表示甲烷燃烧热的热化学方程式:___________ 。
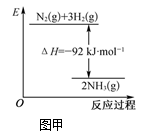
(3)已知反应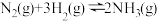 ,该反应过程中的能量变化如图甲,化学键键能如下表所示,通过计算可得
,该反应过程中的能量变化如图甲,化学键键能如下表所示,通过计算可得
___________ 。
(4)锂催化非水相氮还原合成氨的反应机理如图乙所示,各步 如下表所示:
如下表所示:
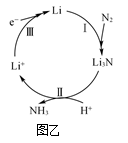
①反应机理图可知,反应中第___________ (填“I”“II”或“III”)步完成后,能自发完成后续反应。
②第II步反应的离子方程式为___________ 。
(1)下列变化过程,属于放热反应的是
①
 水解反应 ②酸碱中和反应 ③
水解反应 ②酸碱中和反应 ③ 在
在 中燃烧 ④固体
中燃烧 ④固体 溶于水 ⑤液态水变成水蒸气 ⑥碳高温条件下还原
溶于水 ⑤液态水变成水蒸气 ⑥碳高温条件下还原 ⑦浓硫酸稀释
⑦浓硫酸稀释(2)实验测得,标准状况下
 甲烷在氧气中充分燃烧生成液态水和二氧化碳气体时释放出
甲烷在氧气中充分燃烧生成液态水和二氧化碳气体时释放出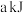 的热量,试写出表示甲烷燃烧热的热化学方程式:
的热量,试写出表示甲烷燃烧热的热化学方程式:(3)已知反应
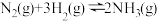 ,该反应过程中的能量变化如图甲,化学键键能如下表所示,通过计算可得
,该反应过程中的能量变化如图甲,化学键键能如下表所示,通过计算可得

| 化学键 |  |  |  |
键能/ |  | 391 | 436 |
(4)锂催化非水相氮还原合成氨的反应机理如图乙所示,各步
 如下表所示:
如下表所示:
| 步骤 | I | II | III |
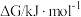 | 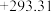 | 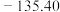 |  |
①反应机理图可知,反应中第
②第II步反应的离子方程式为
您最近一年使用:0次
名校
解题方法
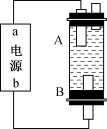
5 . 原电池是化学对人类的一项重大贡献。如图为原电池装置示意图。
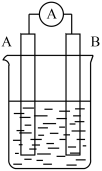
(1)若A为铜,B为锌,电解质溶液为稀硫酸。A和B不连接时,装置中发生反应的离子方程式是_______ 。
(2)若A为铝,B为铜,电解质溶液为 ,用导线相连,则负极为
,用导线相连,则负极为_______ (填“铝”或“铜”),若将装置中 溶液换为氢氧化钠溶液,请写出装置中负极的电极反应式:
溶液换为氢氧化钠溶液,请写出装置中负极的电极反应式:_______ 。
(3)若A为 ,B为
,B为 ,电解质溶液为稀硫酸,工作时的总反应为
,电解质溶液为稀硫酸,工作时的总反应为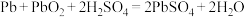 。写出B电极反应式:
。写出B电极反应式:_______ ;该电池在工作时,A电极的质量将_______ (填“增大”“减小”或“不变”)。

(1)若A为铜,B为锌,电解质溶液为稀硫酸。A和B不连接时,装置中发生反应的离子方程式是
(2)若A为铝,B为铜,电解质溶液为
 ,用导线相连,则负极为
,用导线相连,则负极为 溶液换为氢氧化钠溶液,请写出装置中负极的电极反应式:
溶液换为氢氧化钠溶液,请写出装置中负极的电极反应式:(3)若A为
 ,B为
,B为 ,电解质溶液为稀硫酸,工作时的总反应为
,电解质溶液为稀硫酸,工作时的总反应为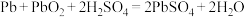 。写出B电极反应式:
。写出B电极反应式:
您最近一年使用:0次
2022-07-16更新
|
191次组卷
|
2卷引用:广西北海市2021-2022学年高一下学期期末检测化学试题
解题方法
6 . 铜及其化合物是生活、生产中运用广泛的材料。
(1)铜元素在周期表中的位置是___________ ,基态 原子核外电子占据最高能层的符号是
原子核外电子占据最高能层的符号是___________ 。
(2)合成氨工业常用醋酸二氨合铜(I){ }溶液吸收对氨合成的催化剂有毒害作用的
}溶液吸收对氨合成的催化剂有毒害作用的 。
。
① 中存在的化学键类型有
中存在的化学键类型有___________ 。
② 的沸点比
的沸点比 的沸点
的沸点___________ ,原因是___________ 。 的键角小于
的键角小于 的键角,原因是
的键角,原因是___________ 。
(3)晶胞的两个基本要素。
①原子坐标参数:晶胞内部各微粒的相对位置。 的晶胞结构如图所示,其中原子坐标参数:A
的晶胞结构如图所示,其中原子坐标参数:A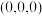 ;B
;B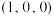 ;C
;C 。则
。则 处微粒的坐标参数为
处微粒的坐标参数为___________ 。
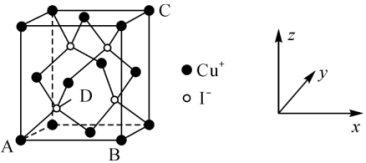
②晶胞参数:描述晶胞的大小和形状。若晶胞的边长为 ,则
,则 与
与 的最短距离为
的最短距离为___________  ,设
,设 为阿伏加德罗常数的值,该化合物的密度为
为阿伏加德罗常数的值,该化合物的密度为___________ (用含 、
、 的代数式表示)
的代数式表示) 。
。
(1)铜元素在周期表中的位置是
 原子核外电子占据最高能层的符号是
原子核外电子占据最高能层的符号是(2)合成氨工业常用醋酸二氨合铜(I){
 }溶液吸收对氨合成的催化剂有毒害作用的
}溶液吸收对氨合成的催化剂有毒害作用的 。
。①
 中存在的化学键类型有
中存在的化学键类型有②
 的沸点比
的沸点比 的沸点
的沸点 的键角小于
的键角小于 的键角,原因是
的键角,原因是(3)晶胞的两个基本要素。
①原子坐标参数:晶胞内部各微粒的相对位置。
 的晶胞结构如图所示,其中原子坐标参数:A
的晶胞结构如图所示,其中原子坐标参数:A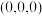 ;B
;B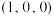 ;C
;C 。则
。则 处微粒的坐标参数为
处微粒的坐标参数为
②晶胞参数:描述晶胞的大小和形状。若晶胞的边长为
 ,则
,则 与
与 的最短距离为
的最短距离为 ,设
,设 为阿伏加德罗常数的值,该化合物的密度为
为阿伏加德罗常数的值,该化合物的密度为 、
、 的代数式表示)
的代数式表示) 。
。
您最近一年使用:0次
解题方法
7 . 常温下, 的
的 溶液中
溶液中 、
、 、
、 三者中所占物质的量分数(分布系数)随
三者中所占物质的量分数(分布系数)随 变化的关系如图所示,下列表述不正确的是
变化的关系如图所示,下列表述不正确的是

 的
的 溶液中
溶液中 、
、 、
、 三者中所占物质的量分数(分布系数)随
三者中所占物质的量分数(分布系数)随 变化的关系如图所示,下列表述不正确的是
变化的关系如图所示,下列表述不正确的是
A.常温下,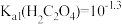 |
B.将等物质的量的 、 、 溶于水中,所得溶液 溶于水中,所得溶液 恰好为4.3 恰好为4.3 |
C.常温下 的 的 ,将少量 ,将少量 溶液加入到足量 溶液加入到足量 溶液中,发生的反应为 溶液中,发生的反应为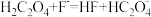 |
D.在 溶液中,各离子浓度大小关系为: 溶液中,各离子浓度大小关系为: |
您最近一年使用:0次
解题方法
8 . 利用含双膜(阴离子交换膜和过滤膜)电解装置将普通电解精炼铜所制备的精铜(仍含微量杂质)提纯为高纯度铜。下列有关叙述中不正确的是
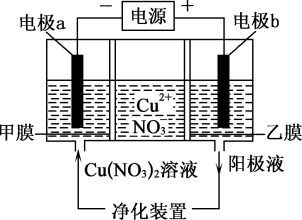

| A.电极a为高纯度铜,电极b为精铜 |
B.电极b上发生的主要反应为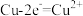 |
| C.甲膜为阴离子交换膜,可阻止杂质阳离子进入阴极区 |
| D.相同时间内b电极减少的质量和a电极增加的质量相等 |
您最近一年使用:0次
解题方法
9 . 下列实验事实能证明相应结论的是
| 选项 | 实验或事实 | 结论 |
| A | 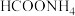 溶液显酸性 溶液显酸性 | 电离平衡常数: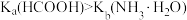 |
| B | 常温下,测得饱和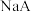 溶液的 溶液的 大于饱和 大于饱和 溶液 溶液 | 常温下,水解程度: |
| C | 向某密闭容器中充入 ,保持温度不变,慢慢扩大容器体积,最终容器中气体颜色比开始时浅 ,保持温度不变,慢慢扩大容器体积,最终容器中气体颜色比开始时浅 | 平衡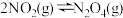 正向移动 正向移动 |
| D | 在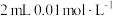 的 的 溶液中先滴入几滴 溶液中先滴入几滴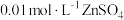 溶液,有白色沉淀生成,再滴入 溶液,有白色沉淀生成,再滴入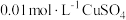 溶液,又出现黑色沉淀 溶液,又出现黑色沉淀 | 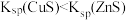 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2022-07-02更新
|
83次组卷
|
2卷引用:广西北海市2021-2022学年高二下学期期末检测化学试题
解题方法
10 . 下列溶液中有关微粒的物质的量浓度关系正确的是
A.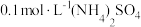 溶液: 溶液: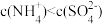 |
B. 溶液: 溶液: |
C.物质的量浓度之比为 的 的 、 、 混合液中: 混合液中:  |
D. 的 的 溶液: 溶液: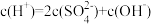 |
您最近一年使用:0次



