1 . 风绪小组探究 的相关性质。
的相关性质。
(1)对于 和水反应放出氧气的现象,他们推测,可能和
和水反应放出氧气的现象,他们推测,可能和 有关。通过实验发现,用冷水时,该反应放出气体的速率相对慢,而换用热水相对快。从而推测可能是
有关。通过实验发现,用冷水时,该反应放出气体的速率相对慢,而换用热水相对快。从而推测可能是 在水中反应生成了
在水中反应生成了 ,后
,后 分解。通过查阅资料得知:
分解。通过查阅资料得知: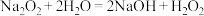 ,
,
①借助资料和实验,发现可以通过 溶于冷水制备少量的
溶于冷水制备少量的 。使用冷水的原因是
。使用冷水的原因是_______ 。
②为验证资料的真实性,他们向溶液中滴加适量的酸性 溶液,发现产生气泡,产生气泡的原因是(用方程式表示)
溶液,发现产生气泡,产生气泡的原因是(用方程式表示)_______ 。
(2)在有同学做实验时,还观察到了棕褐色沉淀,他们推测是 。猜测可能是
。猜测可能是 与
与 发生了反应。为验证猜想以及探究实验现象不一样的原因,他们做了如下实验。
发生了反应。为验证猜想以及探究实验现象不一样的原因,他们做了如下实验。
①先向沉淀中加入浓盐酸并加热,观察到有_______ 气体产生,发生反应_______ 。证明了猜想正确。
②后续得知,同学在制酸性 溶液时,加入的硫酸的量不一样。推测可能是
溶液时,加入的硫酸的量不一样。推测可能是 浓度不同造成的。于是,他们改用有
浓度不同造成的。于是,他们改用有 的
的 溶液滴入
溶液滴入 溶液中,仅观察到了
溶液中,仅观察到了_______ 沉淀,并证明是 ,反应方程式是
,反应方程式是_______ 。
(3) 在反应时,表现氧化性还是还原性,和
在反应时,表现氧化性还是还原性,和_______ 有关。
 的相关性质。
的相关性质。(1)对于
 和水反应放出氧气的现象,他们推测,可能和
和水反应放出氧气的现象,他们推测,可能和 有关。通过实验发现,用冷水时,该反应放出气体的速率相对慢,而换用热水相对快。从而推测可能是
有关。通过实验发现,用冷水时,该反应放出气体的速率相对慢,而换用热水相对快。从而推测可能是 在水中反应生成了
在水中反应生成了 ,后
,后 分解。通过查阅资料得知:
分解。通过查阅资料得知: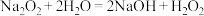 ,
,
①借助资料和实验,发现可以通过
 溶于冷水制备少量的
溶于冷水制备少量的 。使用冷水的原因是
。使用冷水的原因是②为验证资料的真实性,他们向溶液中滴加适量的酸性
 溶液,发现产生气泡,产生气泡的原因是(用方程式表示)
溶液,发现产生气泡,产生气泡的原因是(用方程式表示)(2)在有同学做实验时,还观察到了棕褐色沉淀,他们推测是
 。猜测可能是
。猜测可能是 与
与 发生了反应。为验证猜想以及探究实验现象不一样的原因,他们做了如下实验。
发生了反应。为验证猜想以及探究实验现象不一样的原因,他们做了如下实验。①先向沉淀中加入浓盐酸并加热,观察到有
②后续得知,同学在制酸性
 溶液时,加入的硫酸的量不一样。推测可能是
溶液时,加入的硫酸的量不一样。推测可能是 浓度不同造成的。于是,他们改用有
浓度不同造成的。于是,他们改用有 的
的 溶液滴入
溶液滴入 溶液中,仅观察到了
溶液中,仅观察到了 ,反应方程式是
,反应方程式是(3)
 在反应时,表现氧化性还是还原性,和
在反应时,表现氧化性还是还原性,和
您最近一年使用:0次
名校
解题方法
2 . 某兴趣小组同学探究KMnO4溶液与草酸(H2C2O4)溶液反应速率的影响因素。配制1.0×10-3mol/LKMnO4溶液、0.40mol/L草酸溶液。将KMnO4溶液与草酸溶液按如下比例混合。
【设计实验】
(1)实验①和②的目的是___________ 。
(2)甲认为上述实验应控制pH相同,可加入的试剂是___________ (填序号)。
a.盐酸 b.硫酸 c.草酸
【实施实验】
小组同学将溶液pH调至1并进行实验①和②,发现紫色并未直接褪去,而是分成两个阶段:
i.紫色溶液转变为青色溶液,ii.青色溶液逐渐褪至无色溶液。
资料:(a) 无色,在草酸中不能形成配合物;
无色,在草酸中不能形成配合物;
(b) 无色,有强氧化性,发生反应
无色,有强氧化性,发生反应 (青绿色)后氧化性减弱;
(青绿色)后氧化性减弱;
(c) 呈绿色,在酸性条件下不稳定,迅速分解产生
呈绿色,在酸性条件下不稳定,迅速分解产生 和
和 。
。
(3)乙同学从氧化还原角度推测阶段i中可能产生 ,你认为该观点是否合理,并说明理由:
,你认为该观点是否合理,并说明理由:___________ 。
【继续探究】
进一步实验证明溶液中含有 ,反应过程中
,反应过程中 和
和 浓度随时间的变化如下图。
浓度随时间的变化如下图。
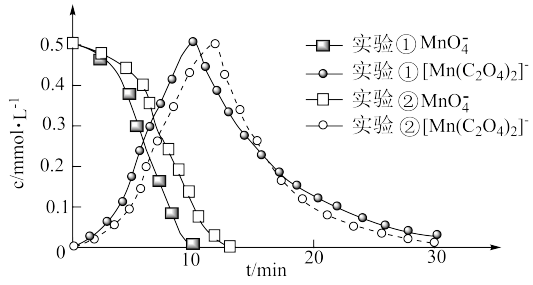
(4)第i阶段中检测到有 气体产生,反应的离子方程式为
气体产生,反应的离子方程式为___________ 。
(5)实验②在第ii阶段的反应速率较大,可能的原因是___________ 。
(6)据此推测,若在第ii阶段将 调节至
调节至 ,溶液褪至无色的时间会
,溶液褪至无色的时间会___________ (填“增加”“减少”或“不变”)。
【结论与反思】
(7)上述实验涉及的反应中,草酸的作用是___________ 。
结论:反应可能是分阶段进行的。草酸浓度的改变对不同阶段反应速率的影响可能不同。
【设计实验】
| 序号 | 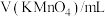 | 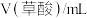 | 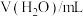 | 反应温度/℃ |
| ① | 2.0 | 2.0 | 0 | 20 |
| ② | 2.0 | 1.0 | 1.0 | 20 |
(2)甲认为上述实验应控制pH相同,可加入的试剂是
a.盐酸 b.硫酸 c.草酸
【实施实验】
小组同学将溶液pH调至1并进行实验①和②,发现紫色并未直接褪去,而是分成两个阶段:
i.紫色溶液转变为青色溶液,ii.青色溶液逐渐褪至无色溶液。
资料:(a)
 无色,在草酸中不能形成配合物;
无色,在草酸中不能形成配合物;(b)
 无色,有强氧化性,发生反应
无色,有强氧化性,发生反应 (青绿色)后氧化性减弱;
(青绿色)后氧化性减弱;(c)
 呈绿色,在酸性条件下不稳定,迅速分解产生
呈绿色,在酸性条件下不稳定,迅速分解产生 和
和 。
。(3)乙同学从氧化还原角度推测阶段i中可能产生
 ,你认为该观点是否合理,并说明理由:
,你认为该观点是否合理,并说明理由:【继续探究】
进一步实验证明溶液中含有
 ,反应过程中
,反应过程中 和
和 浓度随时间的变化如下图。
浓度随时间的变化如下图。
(4)第i阶段中检测到有
 气体产生,反应的离子方程式为
气体产生,反应的离子方程式为(5)实验②在第ii阶段的反应速率较大,可能的原因是
(6)据此推测,若在第ii阶段将
 调节至
调节至 ,溶液褪至无色的时间会
,溶液褪至无色的时间会【结论与反思】
(7)上述实验涉及的反应中,草酸的作用是
结论:反应可能是分阶段进行的。草酸浓度的改变对不同阶段反应速率的影响可能不同。
您最近一年使用:0次
2022-04-01更新
|
1366次组卷
|
8卷引用:北京市第二中学2022-2023学年高二上学期10月月考化学试题
北京市第二中学2022-2023学年高二上学期10月月考化学试题北京师范大学附属中学2022-2023学年高二上学期10月月考化学试题北京市海淀区2022届高三一模化学试题(已下线)必刷卷03-2022年高考化学考前信息必刷卷(河北专用)北京市第二十中学2022-2023学年高三上学期12月月考化学试题(已下线)北京市海淀区2022届高三一模(实验探究题)北京第一零一中学2023届高三10月月考化学试题超重点8 碳酸盐、草酸盐的创新考查
21-22高二下·全国·单元测试
解题方法
3 . 同周期、同主族元素性质的递变规律
| 性质 | 同一周期(从左到右) | 同一主族(从上到下) | |
| 核外电子的排布 | 能层数 | ||
| 最外层电子数 | 1→2或8 | ||
| 金属性 | |||
| 非金属性 | |||
| 单质的氧化性、还原性 | 氧化性 | ||
| 还原性 | |||
| 最高价氧化物对应水化物的酸碱性 | 酸性 | ||
| 碱性 | |||
| 气态氢化物的稳定性 | |||
| 第一电离能 | |||
| 电负性 | |||
您最近一年使用:0次
4 . 学习小组在实验室中利用如图所示装置制备 并进行相关性质的探究。
并进行相关性质的探究。
Ⅰ.制备实验: 和NaClO溶液反应制取
和NaClO溶液反应制取 。
。

(1)装有 的装置名称
的装置名称_______
(2)③中分液漏斗盛放的试剂为_______ (填化学式)
(3)制备 的离子方程式为
的离子方程式为_______
Ⅱ.探究实验:探究 的还原性和碱性。将制得的分离提纯后,进行如图实验:
的还原性和碱性。将制得的分离提纯后,进行如图实验:

[查阅资料]AgOH在溶液中不稳定易分解生成黑色的 ,
, 可溶于氨水。
可溶于氨水。
[提出假设]黑色固体可能是Ag、 中的一种或两种。
中的一种或两种。
[实验验证]设计如下方案,进行实验,
(4)请完成下表中的空白部分、
(5)实验表明,黑色固体主要是Ag,还有少量的 ,请解释产生
,请解释产生 的原因
的原因_______
(6)在制备实验中,需要先打开⑤的酒精灯,待得到饱和氨水后,再打开分液漏斗滴加少量溶液。请结合物质性质说明该操作的目的_______
 并进行相关性质的探究。
并进行相关性质的探究。Ⅰ.制备实验:
 和NaClO溶液反应制取
和NaClO溶液反应制取 。
。
(1)装有
 的装置名称
的装置名称(2)③中分液漏斗盛放的试剂为
(3)制备
 的离子方程式为
的离子方程式为Ⅱ.探究实验:探究
 的还原性和碱性。将制得的分离提纯后,进行如图实验:
的还原性和碱性。将制得的分离提纯后,进行如图实验:
[查阅资料]AgOH在溶液中不稳定易分解生成黑色的
 ,
, 可溶于氨水。
可溶于氨水。[提出假设]黑色固体可能是Ag、
 中的一种或两种。
中的一种或两种。[实验验证]设计如下方案,进行实验,
(4)请完成下表中的空白部分、
| 实验编号 | 操作 | 现象 | 实验结论 |
| 1 | 取少量黑色固体于试管,① | 黑色固体不溶解 | 黑色固体是Ag |
| 2 | 操作步骤同实验1 | 黑色固体完全溶解 | 黑色固体是 |
| 3 | i取少量黑色固体于试管中,加入适量氨水,振荡,静置,取上层清液于洁净试管中,加入几滴乙醛,水浴加热;ii取少量黑色固体于试管中,加入足量稀硝酸,振荡。 | i试管内壁有银镜生成ii② | 黑色固体是Ag和 |
 ,请解释产生
,请解释产生 的原因
的原因(6)在制备实验中,需要先打开⑤的酒精灯,待得到饱和氨水后,再打开分液漏斗滴加少量溶液。请结合物质性质说明该操作的目的
您最近一年使用:0次
2022-05-07更新
|
158次组卷
|
2卷引用:四川省内江市第六中学2021-2022学年高二下学期第一次月考化学试题
解题方法
5 . I.高铁酸钠(Na2FeO4)是一种多功能、高效无毒的新型绿色水处理剂。
(1)Na2FeO4中铁元素的化合价是____ 价,Na2FeO4具有较强的____ (填“氧化性”或“还原性”)。
(2)工业上可用FeCl3、NaOH、NaClO三种物质在一定条件下反应制得Na2FeO4,完成下列化学方程式:____ 。
2FeCl3+10NaOH+3NaClO=2____+5____+9____
II.钒触媒(V2O5)是催化氧化所常用的催化剂,为综合利用,科研人员最新研制了一种离子交换法回收废钒的新工艺,回收率达90%以上。已知废钒催化剂中含有V2O5、VOSO4及不溶性残渣。查阅资料可知:VOSO4可溶于水,V2O5难溶于水,NH4VO3难溶于水。该工艺的流程如图。
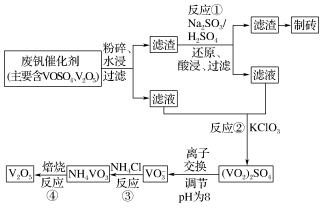
(3)水浸时,为了提高废钒的浸出率,除了粉碎,还可以采取的措施:____ 、____ (写出2条)。
(4)写出反应①的离子方程式____ 。
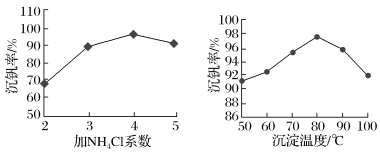
(5)该工艺中反应③的沉矾率是回收钒的关键,沉钒率的高低除受溶液pH影响外,还需要控制氯化铵系数(NH4Cl加入质量与料液中V2O5的质量比)和温度。根据如图建议最合适的氯化铵系数和温度:氯化铵系数为____ ,温度为____ 。
(6)写出“焙烧反应④”中由NH4VO3制备V2O5的化学方程式____ 。
(1)Na2FeO4中铁元素的化合价是
(2)工业上可用FeCl3、NaOH、NaClO三种物质在一定条件下反应制得Na2FeO4,完成下列化学方程式:
2FeCl3+10NaOH+3NaClO=2____+5____+9____
II.钒触媒(V2O5)是催化氧化所常用的催化剂,为综合利用,科研人员最新研制了一种离子交换法回收废钒的新工艺,回收率达90%以上。已知废钒催化剂中含有V2O5、VOSO4及不溶性残渣。查阅资料可知:VOSO4可溶于水,V2O5难溶于水,NH4VO3难溶于水。该工艺的流程如图。

(3)水浸时,为了提高废钒的浸出率,除了粉碎,还可以采取的措施:
(4)写出反应①的离子方程式
(5)该工艺中反应③的沉矾率是回收钒的关键,沉钒率的高低除受溶液pH影响外,还需要控制氯化铵系数(NH4Cl加入质量与料液中V2O5的质量比)和温度。根据如图建议最合适的氯化铵系数和温度:氯化铵系数为

(6)写出“焙烧反应④”中由NH4VO3制备V2O5的化学方程式
您最近一年使用:0次
名校
6 . 化学小组同学设计如下实验验证氧气的部分性质,并探究氯水的成分和性质。
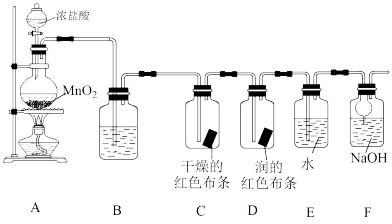
回答下列问题:
(1)装置A中装浓盐酸的仪器的名称是_______ 。
(2)装置A中发生反应的化学方程式为_______ 。
(3)验证干燥的氯气没有漂白性的现象为_______ 。
(4)装置F的作用(用离子方程式表示)是_______ 。
(5)资料:淀粉的特征反应——遇 变蓝色:
变蓝色: 。
。
研究新制氯水的成分和性质,分别取装置E中的溶液(氯水)进行下列实验:
①根据实验1,滴加淀粉碘化钾溶液,溶液变蓝,可知氧化性:
_______  (填“﹥”或“﹤”)。
(填“﹥”或“﹤”)。
②实验2中,将氯水滴入石蕊溶液中,石蕊溶液先变红,后褪色,褪色是因为溶液中含有_______ 分子。
③若用实验3证明氯水中含有氯离子,则操作、现象:_______ 。

回答下列问题:
(1)装置A中装浓盐酸的仪器的名称是
(2)装置A中发生反应的化学方程式为
(3)验证干燥的氯气没有漂白性的现象为
(4)装置F的作用(用离子方程式表示)是
(5)资料:淀粉的特征反应——遇
 变蓝色:
变蓝色: 。
。研究新制氯水的成分和性质,分别取装置E中的溶液(氯水)进行下列实验:
①根据实验1,滴加淀粉碘化钾溶液,溶液变蓝,可知氧化性:

 (填“﹥”或“﹤”)。
(填“﹥”或“﹤”)。②实验2中,将氯水滴入石蕊溶液中,石蕊溶液先变红,后褪色,褪色是因为溶液中含有
③若用实验3证明氯水中含有氯离子,则操作、现象:
您最近一年使用:0次
2022-12-07更新
|
115次组卷
|
2卷引用:四川省内江市资中县第二中学2022-2023学年高二上学期期中考试化学试题
名校
7 . 砷(As)与氮(N)是同主族元素,它们的化合物在生活、生产和科学研究中有重要的作用。
(1)亚硝酸钠(NaNO2)的外观与食盐非常相似,但有毒。某小组欲鉴别NaCl与NaNO2,常温下,用pH试纸分别测定0.1 mol∙L−1两种盐溶液的pH,测得NaNO2溶液的pH=9,即NaNO2溶液呈碱性,其原因为___________ (用离子方程式表示)。常温下,HNO2电离常数Ka(HNO2)约为___________ 。
(2)查阅资料知:5 +2
+2 +6H+=5
+6H+=5 +3Mn2++3H2O;
+3Mn2++3H2O; +5Fe2++8H+=Mn2++5Fe3++4H2O。该小组设计如下方案测定NaNO2样品的纯度(含NaNO3杂质):取样品2.3 g经溶解后得到溶液A 100 mL,准确量取10.00 mL A与24.00 mL 0.0500 mol∙L−1的酸性高锰酸钾溶液在锥形瓶中充分反应。反应后的溶液用0.1000 mol∙L−1 (NH4)2Fe(SO4)2标准溶液滴定至紫色刚好褪去;重复上述实验3次,平均消耗(NH4)2Fe(SO4)2溶液10.00 mL,则样品中NaNO2的纯度为
+5Fe2++8H+=Mn2++5Fe3++4H2O。该小组设计如下方案测定NaNO2样品的纯度(含NaNO3杂质):取样品2.3 g经溶解后得到溶液A 100 mL,准确量取10.00 mL A与24.00 mL 0.0500 mol∙L−1的酸性高锰酸钾溶液在锥形瓶中充分反应。反应后的溶液用0.1000 mol∙L−1 (NH4)2Fe(SO4)2标准溶液滴定至紫色刚好褪去;重复上述实验3次,平均消耗(NH4)2Fe(SO4)2溶液10.00 mL,则样品中NaNO2的纯度为___________ 。通过上述实验测得样品中NaNO2的纯度偏高,该小组讨论的原因错误的是___________ (填字母编号)。
a.滴定至溶液紫色刚好褪去,立即停止滴定
b.加入A与KMnO4溶液前的锥形瓶未经干燥
c.实验中使用的(NH4)2Fe(SO4)2溶液暴露在空气中的时间过长
(3)已知常温下,Ksp(AgNO2)=2×10−8,Ksp(AgCl)=1.8×10−10.分别向同浓度的两种盐溶液中滴入向同浓度的AgNO3溶液,先出现的沉淀是___________ (填化学式)。欲用1L NaNO2溶液将0.01mol AgCl完全转化为AgNO2,则NaNO2溶液的浓度需要满足___________ 。
(4)25℃时,10mL 0.3 mol∙L−1 Na3AsO3溶液、10mL 0.3 mol∙L−1 I2溶液的的水溶液和10mL NaOH溶液混合,发生反应: (aq)+I2(aq)+2OH-(aq)
(aq)+I2(aq)+2OH-(aq) 
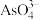 (aq)+2I-(aq)+H2O(l)。溶液中c(I-)与反应时间(t)的关系如图所示(溶液体积变化忽略不计):
(aq)+2I-(aq)+H2O(l)。溶液中c(I-)与反应时间(t)的关系如图所示(溶液体积变化忽略不计):
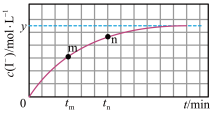
①m点时υ逆___________ n点时υ正(填“>”、“=”或“<”)。
②若平衡时溶液的pH=13,该反应的平衡常数K=___________ (用含y的代数式表示)。
(5)已知H3AsO4的电离常数分别为Ka1=6.3×10−2,Ka2=1.0×10−7,Ka3=3.2×10−12。
①25℃时,0.1 mol∙L−1的NaH2AsO4溶液中:c(H3AsO4)___________ c( )(填“>”、“=”或“<”)。
)(填“>”、“=”或“<”)。
②25℃时,向10mL 0.1 mol∙L−1的H3AsO4溶液中逐滴滴加1 mol∙L−1 NaOH溶液至中性,此时混合溶液中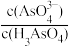 =
=___________ 。
(1)亚硝酸钠(NaNO2)的外观与食盐非常相似,但有毒。某小组欲鉴别NaCl与NaNO2,常温下,用pH试纸分别测定0.1 mol∙L−1两种盐溶液的pH,测得NaNO2溶液的pH=9,即NaNO2溶液呈碱性,其原因为
(2)查阅资料知:5
 +2
+2 +6H+=5
+6H+=5 +3Mn2++3H2O;
+3Mn2++3H2O; +5Fe2++8H+=Mn2++5Fe3++4H2O。该小组设计如下方案测定NaNO2样品的纯度(含NaNO3杂质):取样品2.3 g经溶解后得到溶液A 100 mL,准确量取10.00 mL A与24.00 mL 0.0500 mol∙L−1的酸性高锰酸钾溶液在锥形瓶中充分反应。反应后的溶液用0.1000 mol∙L−1 (NH4)2Fe(SO4)2标准溶液滴定至紫色刚好褪去;重复上述实验3次,平均消耗(NH4)2Fe(SO4)2溶液10.00 mL,则样品中NaNO2的纯度为
+5Fe2++8H+=Mn2++5Fe3++4H2O。该小组设计如下方案测定NaNO2样品的纯度(含NaNO3杂质):取样品2.3 g经溶解后得到溶液A 100 mL,准确量取10.00 mL A与24.00 mL 0.0500 mol∙L−1的酸性高锰酸钾溶液在锥形瓶中充分反应。反应后的溶液用0.1000 mol∙L−1 (NH4)2Fe(SO4)2标准溶液滴定至紫色刚好褪去;重复上述实验3次,平均消耗(NH4)2Fe(SO4)2溶液10.00 mL,则样品中NaNO2的纯度为a.滴定至溶液紫色刚好褪去,立即停止滴定
b.加入A与KMnO4溶液前的锥形瓶未经干燥
c.实验中使用的(NH4)2Fe(SO4)2溶液暴露在空气中的时间过长
(3)已知常温下,Ksp(AgNO2)=2×10−8,Ksp(AgCl)=1.8×10−10.分别向同浓度的两种盐溶液中滴入向同浓度的AgNO3溶液,先出现的沉淀是
(4)25℃时,10mL 0.3 mol∙L−1 Na3AsO3溶液、10mL 0.3 mol∙L−1 I2溶液的的水溶液和10mL NaOH溶液混合,发生反应:
 (aq)+I2(aq)+2OH-(aq)
(aq)+I2(aq)+2OH-(aq) 
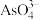 (aq)+2I-(aq)+H2O(l)。溶液中c(I-)与反应时间(t)的关系如图所示(溶液体积变化忽略不计):
(aq)+2I-(aq)+H2O(l)。溶液中c(I-)与反应时间(t)的关系如图所示(溶液体积变化忽略不计):
①m点时υ逆
②若平衡时溶液的pH=13,该反应的平衡常数K=
(5)已知H3AsO4的电离常数分别为Ka1=6.3×10−2,Ka2=1.0×10−7,Ka3=3.2×10−12。
①25℃时,0.1 mol∙L−1的NaH2AsO4溶液中:c(H3AsO4)
 )(填“>”、“=”或“<”)。
)(填“>”、“=”或“<”)。②25℃时,向10mL 0.1 mol∙L−1的H3AsO4溶液中逐滴滴加1 mol∙L−1 NaOH溶液至中性,此时混合溶液中
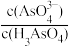 =
=
您最近一年使用:0次
名校
8 . 铜的配合物广泛存在,对含铜配合物的研究一直是关注的热点。
Ⅰ.同学甲设计如下制备铜的配合物的实验Ⅰ:
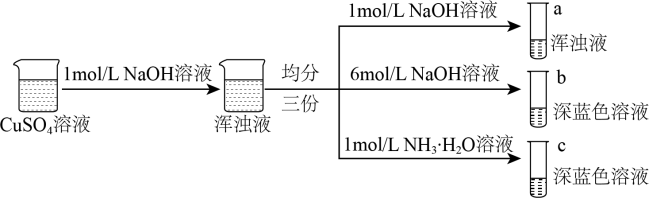
已知:铜离子的配位数通常为4, 呈深蓝色,
呈深蓝色, 呈深蓝色
呈深蓝色
(1)硫酸铜溶液呈蓝色的原因是溶液中存在配离子___________ (填化学式),配离子中配体的空间结构为___________ ,外界阴离子的空间结构___________
(2)结合化学平衡原理解释试管c中浑浊液转变为深蓝色溶液的原因___________ 。
(3)由实验Ⅰ可得出以下结论:
结论1:配合物的形成与___________ 、___________ 有关;
结论2:结合上述实验,b、c中配体的配位能力强弱顺序为:___________ >___________ (填化学式)。
Ⅱ.同学乙查阅资料发现 与
与 在溶液中可以发生配位反应,生成配合物
在溶液中可以发生配位反应,生成配合物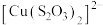 ;同学丙认为Cu(Ⅱ)有氧化性,
;同学丙认为Cu(Ⅱ)有氧化性, 与
与 在溶液中可以发生氧化还原反应。
在溶液中可以发生氧化还原反应。
【资料】
ⅰ.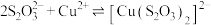 (绿色),
(绿色),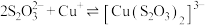 (无色);
(无色);
ⅱ. (无色),
(无色), 遇空气容易被氧化成
遇空气容易被氧化成 (蓝色);
(蓝色);
ⅲ. 易被氧化为
易被氧化为 或
或 。
。
实验Ⅱ:探究 与
与 溶液的反应。
溶液的反应。
(4)①丙同学认为实验Ⅱ可证明发生了氧化还原反应,他的理由是___________
②丙同学利用已知资料进一步确证了无色溶液中存在Cu(Ⅰ),他的实验方案是:取少量无色溶液,___________ 。
(5)经检验氧化产物以 形式存在,写出
形式存在,写出 与
与 发生氧化还原反应得到无色溶液的离子方程式:
发生氧化还原反应得到无色溶液的离子方程式:___________ 。
(6)由实验Ⅱ可得出以下结论:
Cu(Ⅱ)盐与 在溶液中的反应与多种因素有关,随
在溶液中的反应与多种因素有关,随 的增大,
的增大,___________ 。
Ⅰ.同学甲设计如下制备铜的配合物的实验Ⅰ:

已知:铜离子的配位数通常为4,
 呈深蓝色,
呈深蓝色, 呈深蓝色
呈深蓝色(1)硫酸铜溶液呈蓝色的原因是溶液中存在配离子
(2)结合化学平衡原理解释试管c中浑浊液转变为深蓝色溶液的原因
(3)由实验Ⅰ可得出以下结论:
结论1:配合物的形成与
结论2:结合上述实验,b、c中配体的配位能力强弱顺序为:
Ⅱ.同学乙查阅资料发现
 与
与 在溶液中可以发生配位反应,生成配合物
在溶液中可以发生配位反应,生成配合物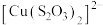 ;同学丙认为Cu(Ⅱ)有氧化性,
;同学丙认为Cu(Ⅱ)有氧化性, 与
与 在溶液中可以发生氧化还原反应。
在溶液中可以发生氧化还原反应。【资料】
ⅰ.
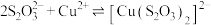 (绿色),
(绿色),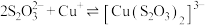 (无色);
(无色);ⅱ.
 (无色),
(无色), 遇空气容易被氧化成
遇空气容易被氧化成 (蓝色);
(蓝色);ⅲ.
 易被氧化为
易被氧化为 或
或 。
。实验Ⅱ:探究
 与
与 溶液的反应。
溶液的反应。| 实验操作 | 实验序号 |  (mL) (mL) |  (mL) (mL) | 逐滴加入 溶液时的实验现象 溶液时的实验现象 |
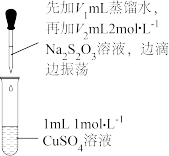 | a | 1.5 | 0.5 | 溶液逐渐变为绿色,静置无变化 |
| b | 1.0 | 1.0 | 溶液先变为绿色,后逐渐变成浅绿色,静置无变化 | |
| c | 0 | 2.0 | 溶液先变为绿色,后逐渐变浅至无色,静置无变化 |
②丙同学利用已知资料进一步确证了无色溶液中存在Cu(Ⅰ),他的实验方案是:取少量无色溶液,
(5)经检验氧化产物以
 形式存在,写出
形式存在,写出 与
与 发生氧化还原反应得到无色溶液的离子方程式:
发生氧化还原反应得到无色溶液的离子方程式:(6)由实验Ⅱ可得出以下结论:
Cu(Ⅱ)盐与
 在溶液中的反应与多种因素有关,随
在溶液中的反应与多种因素有关,随 的增大,
的增大,
您最近一年使用:0次
名校
解题方法
9 . 在 中加入蒸馏水,微热,
中加入蒸馏水,微热, 完全水解,产物之一是亚磷酸
完全水解,产物之一是亚磷酸 。
。
 易溶于水,它的结构式表示为
易溶于水,它的结构式表示为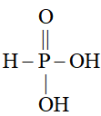 。
。 和
和 反应只生成
反应只生成 和
和 两种盐,其正盐溶液呈碱性。常温下,
两种盐,其正盐溶液呈碱性。常温下,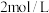 的亚磷酸溶液pH约为1。在
的亚磷酸溶液pH约为1。在 溶液中加入碘水振荡后,碘水的棕黄色褪去,再滴加溶液有黄
溶液中加入碘水振荡后,碘水的棕黄色褪去,再滴加溶液有黄 色沉淀析出。若在装有
色沉淀析出。若在装有 溶液的试管中加入
溶液的试管中加入 溶液,则析出黑色金属银沉淀,溶液中有无色气泡产生,在试管口变为红棕色。回答下列问题:
溶液,则析出黑色金属银沉淀,溶液中有无色气泡产生,在试管口变为红棕色。回答下列问题:
(1) 为
为__________ 盐(填“酸式”、“碱式”或“正”)。
(2)用化学方程式表示 和碘水的反应:
和碘水的反应:_______________ 。
 水溶液呈碱性的原因(用离子方程式表示):
水溶液呈碱性的原因(用离子方程式表示):_____________ 。
(3)根据上述事实,可以得知 是
是______ (填序号)。
A.强酸 B.弱酸 C.二元酸 D.三元酸 E.具有强氧化性 F.具有强还原性
 中加入蒸馏水,微热,
中加入蒸馏水,微热, 完全水解,产物之一是亚磷酸
完全水解,产物之一是亚磷酸 。
。 易溶于水,它的结构式表示为
易溶于水,它的结构式表示为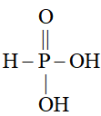 。
。 和
和 反应只生成
反应只生成 和
和 两种盐,其正盐溶液呈碱性。常温下,
两种盐,其正盐溶液呈碱性。常温下,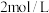 的亚磷酸溶液pH约为1。在
的亚磷酸溶液pH约为1。在 溶液中加入碘水振荡后,碘水的棕黄色褪去,再滴加溶液有黄
溶液中加入碘水振荡后,碘水的棕黄色褪去,再滴加溶液有黄 色沉淀析出。若在装有
色沉淀析出。若在装有 溶液的试管中加入
溶液的试管中加入 溶液,则析出黑色金属银沉淀,溶液中有无色气泡产生,在试管口变为红棕色。回答下列问题:
溶液,则析出黑色金属银沉淀,溶液中有无色气泡产生,在试管口变为红棕色。回答下列问题:(1)
 为
为(2)用化学方程式表示
 和碘水的反应:
和碘水的反应: 水溶液呈碱性的原因(用离子方程式表示):
水溶液呈碱性的原因(用离子方程式表示):(3)根据上述事实,可以得知
 是
是A.强酸 B.弱酸 C.二元酸 D.三元酸 E.具有强氧化性 F.具有强还原性
您最近一年使用:0次
解题方法
10 . 工业废水对环境产生很大影响,不同的工业度水有不同的处理方法。
(1)电化学氧化法处理酸性废水中 的原理是:利用电解产生高活性羟基自由基
的原理是:利用电解产生高活性羟基自由基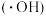 将
将 氧化成
氧化成 ,电解产生
,电解产生 的反应机理如图所示。
的反应机理如图所示。

①电解制取 的过程可描述为
的过程可描述为_______ 。
②研究表明当 大于4后,随溶液
大于4后,随溶液 增大,
增大, 去除率降低的原因是
去除率降低的原因是_______ 。
③写出 与
与 反应的离子方程式:
反应的离子方程式:_______ 。
(2)工业制革废水中含有大量蛋白质(酸性条件下带正电荷,碱性条件下带负电荷)和 。当
。当 以
以 胶体颗粒形式存在时,可用
胶体颗粒形式存在时,可用 纳米颗粒吸附除去。
纳米颗粒吸附除去。 胶体、
胶体、 纳米颗粒的zeta电位、
纳米颗粒的zeta电位、 捕获量随溶液
捕获量随溶液 的变化关系如图所示。
的变化关系如图所示。

资料卡片
胶体粒子所带电荷多少和正负用zeta电位衡量,zeta电位的正负值表示胶体粒子带正负电荷,数值越大所带电荷越多。
① 时,铬元素吸收效率很差,其原因可能是
时,铬元素吸收效率很差,其原因可能是_______ 。
②在碱性条件下 吸附废水中
吸附废水中 胶体颗粒具有选择性的原因是
胶体颗粒具有选择性的原因是_______ 。
③ 纳米颗粒吸附后的形成
纳米颗粒吸附后的形成 ,加入到
,加入到 溶液中浸泡可以回收
溶液中浸泡可以回收 纳米颗粒,同时得到
纳米颗粒,同时得到 溶液,反应的离子方程式为
溶液,反应的离子方程式为_______ 。
(1)电化学氧化法处理酸性废水中
 的原理是:利用电解产生高活性羟基自由基
的原理是:利用电解产生高活性羟基自由基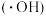 将
将 氧化成
氧化成 ,电解产生
,电解产生 的反应机理如图所示。
的反应机理如图所示。
①电解制取
 的过程可描述为
的过程可描述为②研究表明当
 大于4后,随溶液
大于4后,随溶液 增大,
增大, 去除率降低的原因是
去除率降低的原因是③写出
 与
与 反应的离子方程式:
反应的离子方程式:(2)工业制革废水中含有大量蛋白质(酸性条件下带正电荷,碱性条件下带负电荷)和
 。当
。当 以
以 胶体颗粒形式存在时,可用
胶体颗粒形式存在时,可用 纳米颗粒吸附除去。
纳米颗粒吸附除去。 胶体、
胶体、 纳米颗粒的zeta电位、
纳米颗粒的zeta电位、 捕获量随溶液
捕获量随溶液 的变化关系如图所示。
的变化关系如图所示。
资料卡片
胶体粒子所带电荷多少和正负用zeta电位衡量,zeta电位的正负值表示胶体粒子带正负电荷,数值越大所带电荷越多。
①
 时,铬元素吸收效率很差,其原因可能是
时,铬元素吸收效率很差,其原因可能是②在碱性条件下
 吸附废水中
吸附废水中 胶体颗粒具有选择性的原因是
胶体颗粒具有选择性的原因是③
 纳米颗粒吸附后的形成
纳米颗粒吸附后的形成 ,加入到
,加入到 溶液中浸泡可以回收
溶液中浸泡可以回收 纳米颗粒,同时得到
纳米颗粒,同时得到 溶液,反应的离子方程式为
溶液,反应的离子方程式为
您最近一年使用:0次



