1 . X、Y、Z、W是元素周期表前四周期中的常见元素,其原子序数依次增大。X元素的一种核素的质量数为12,中子数为6;Y元素是动植物生长不可缺少的、构成蛋白质的重要组成元素;Z的基态原子核外9个原子轨道上填充了电子且有2个未成对电子,与X不同族;W是一种常见元素,可以形成一种具有磁性的黑色晶体氧化物。
(1)写出下列元素的名称:X__________ ,Y__________ ,Z__________ 。
(2)X—H和Y—H属于极性共价键,其中极性较强的是________ (X、Y用元素符号表示)。X的第一电离能比Y的________ (填“大”或“小”)。
(3)写出X的单质与Z的最高价氧化物对应水化物的浓溶液反应的化学方程式:_______________ 。
(4)W的基态原子的价层电子排布式为_________________ 。
(5)Y元素的核外电子轨道表达式为________________ 。
(1)写出下列元素的名称:X
(2)X—H和Y—H属于极性共价键,其中极性较强的是
(3)写出X的单质与Z的最高价氧化物对应水化物的浓溶液反应的化学方程式:
(4)W的基态原子的价层电子排布式为
(5)Y元素的核外电子轨道表达式为
您最近一年使用:0次
解题方法
2 . 下列关于物质结构的命题表述中正确的是
| A.乙醛分子中碳原子的杂化类型为sp3 |
B.元素Br位于周期表第四周期ⅦA族,核外电子排布式为 ,属于p区 ,属于p区 |
| C.非极性分子往往具有高度对称性,如BF3、PCl5、H2O2、CO2分子 |
D.氨水中大部分NH3与H2O以氢键(用“…”表示)结合成NH3·H2O分子,根据氨水的性质可知NH3·H2O的结构式可记为: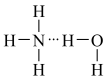 |
您最近一年使用:0次
解题方法
3 . 硼、砷、铁等元素可形成结构、性质各异的物质,在生产、科研中发挥着重要用途。回答下列问题:
(1)下列不同状态的硼中,失去一个电子需要吸收能量最多的是___________ (填标号,下同),用光谱仪可捕捉到发射光谱的是___________ 。___________ 种。CH3As(OH)2与(CH3)2AsOH两种含砷有机酸中沸点较高的是___________ (填化学式),原因为___________ 。
(3)LiZnAs晶体的立方晶胞结构如图1所示,N点原子分数坐标为( ,
, ,
, );LiZnAs晶体部分Zn原子被Mn原子代替后可以形成一种新型稀磁半导体LiZnmMnnAs,其立方晶胞结构如图2所示。
);LiZnAs晶体部分Zn原子被Mn原子代替后可以形成一种新型稀磁半导体LiZnmMnnAs,其立方晶胞结构如图2所示。___________ 。
②m=_________ 。
(1)下列不同状态的硼中,失去一个电子需要吸收能量最多的是
A. 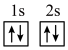 B.
B. 
C. 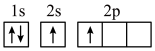 D.
D. 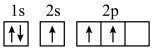
(3)LiZnAs晶体的立方晶胞结构如图1所示,N点原子分数坐标为(
 ,
, ,
, );LiZnAs晶体部分Zn原子被Mn原子代替后可以形成一种新型稀磁半导体LiZnmMnnAs,其立方晶胞结构如图2所示。
);LiZnAs晶体部分Zn原子被Mn原子代替后可以形成一种新型稀磁半导体LiZnmMnnAs,其立方晶胞结构如图2所示。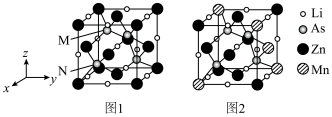
②m=
您最近一年使用:0次
解题方法
4 . 物质结构决定物质性质。下列性质差异与结构因素匹配错误 的是
| 性质差异 | 结构因素 | |
| A | 溶解度: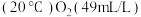 大于 大于 | 分子间作用力 |
| B | 键角: | 杂化类型 |
| C | 酸性: 远强于 远强于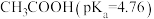 | 羟基极性 |
| D | 气态氢化物稳定性:HF强于HCl | 氢键 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
解题方法
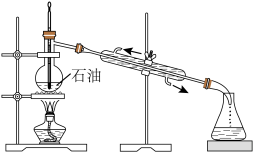
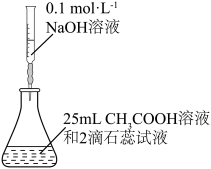
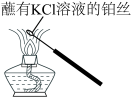
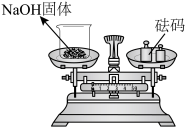
5 . 化学实验操作是进行科学实验的基础。下列操作合理的是
|
|
| A.石油分馏 | B.用NaOH标准溶液滴定未知浓度的 溶液 溶液 |
|
|
| C.观察K元素的焰色 | D.称量NaOH固体 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2024-06-12更新
|
186次组卷
|
7卷引用:四川省雅安市2023-2024学年高三下学期5月联考理综试题-高中化学
6 . 工业上用软锰矿(主要含 、
、 及铁的氧化物)和铅闪(主要含PbS、
及铁的氧化物)和铅闪(主要含PbS、 、ZnS)为原料联合制取
、ZnS)为原料联合制取 和
和 的流程如下图所示。
的流程如下图所示。___________ 个未成对电子,Mn元素位于元素周期表的___________ 区。
(2)提高“酸浸”浸出率可采取的措施有_______ (写两条),“冰水沉积”的目的是_________ 。
(3)PbS、MnS、ZnS三种物质在相同条件下,溶度积最大的是___________ (填化学式)。
(4)“酸浸”时,PbS与 反应生成
反应生成 和
和 ,写出其反应的离子方程式
,写出其反应的离子方程式_______ 。
(5)“酸浸”时,要尽量防止硫元素转化为单质S,其主要原因是___________ 。
(6)“氧化”时,发生的主要反应的离子方程式为___________ 。
 、
、 及铁的氧化物)和铅闪(主要含PbS、
及铁的氧化物)和铅闪(主要含PbS、 、ZnS)为原料联合制取
、ZnS)为原料联合制取 和
和 的流程如下图所示。
的流程如下图所示。
(2)提高“酸浸”浸出率可采取的措施有
(3)PbS、MnS、ZnS三种物质在相同条件下,溶度积最大的是
(4)“酸浸”时,PbS与
 反应生成
反应生成 和
和 ,写出其反应的离子方程式
,写出其反应的离子方程式(5)“酸浸”时,要尽量防止硫元素转化为单质S,其主要原因是
(6)“氧化”时,发生的主要反应的离子方程式为
您最近一年使用:0次
解题方法
7 . 钛是一种银白色过渡金属,在高科技社会中得到了广泛的应用。可以从钛铁矿( )中提取
)中提取 ,并常用Na置换熔融
,并常用Na置换熔融 来获得单质Ti。
来获得单质Ti。
(1)基态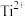 的价电子排布式为
的价电子排布式为___________ ,其核外能量最高的电子所在的能层符号为___________ ,其核外共有___________ 种运动状态不同的电子。
(2)Ti的配合物有多种。在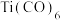 、
、 和
和 三种微粒的配体中,所含原子电负性由大到小排序后,排第3位的元素是
三种微粒的配体中,所含原子电负性由大到小排序后,排第3位的元素是___________ (填写元素名称), 中
中
___________ (填“大于”、“小于”或“等于”)单个水分子中 ,原因是
,原因是___________ 。
(3) 的球棍结构如图,Ti的配位数是
的球棍结构如图,Ti的配位数是___________ ,N原子的杂化方式为___________ ,与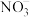 互为等电子体的分子为
互为等电子体的分子为___________ (写分子式)。 和
和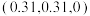 ,则微粒3的原子分数坐标为
,则微粒3的原子分数坐标为___________ ;若阿伏加德罗常数的值为 ,金红石的密度为
,金红石的密度为___________  (列出计算表达式)。
(列出计算表达式)。
 )中提取
)中提取 ,并常用Na置换熔融
,并常用Na置换熔融 来获得单质Ti。
来获得单质Ti。(1)基态
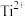 的价电子排布式为
的价电子排布式为(2)Ti的配合物有多种。在
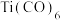 、
、 和
和 三种微粒的配体中,所含原子电负性由大到小排序后,排第3位的元素是
三种微粒的配体中,所含原子电负性由大到小排序后,排第3位的元素是 中
中
 ,原因是
,原因是(3)
 的球棍结构如图,Ti的配位数是
的球棍结构如图,Ti的配位数是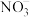 互为等电子体的分子为
互为等电子体的分子为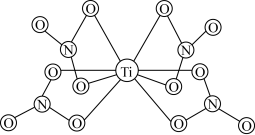
 和
和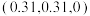 ,则微粒3的原子分数坐标为
,则微粒3的原子分数坐标为 ,金红石的密度为
,金红石的密度为 (列出计算表达式)。
(列出计算表达式)。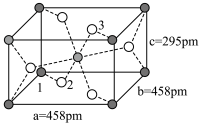
您最近一年使用:0次
8 . 化合物H用于制喹宁系列抗疟药等,一种合成化合物H的人工合成路线如图:___________ 。
(2) 的反应类型是
的反应类型是___________ ; 的反应条件是
的反应条件是___________ 。
(3)E的同分异构体同时满足下列条件,写出该同分异构体的结构简式___________ 。
①能与 溶液发生显色反应;
溶液发生显色反应;
②苯环上有4个取代基;
③分子中有4种不同化学环境的氢原子。
(4) 的化学方程式是
的化学方程式是___________ 。
(5)写出以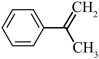 为原料制备
为原料制备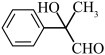 的合成流程图
的合成流程图___________ 。(无机试剂和有机溶剂任选,合成流程图示例见本题题干)
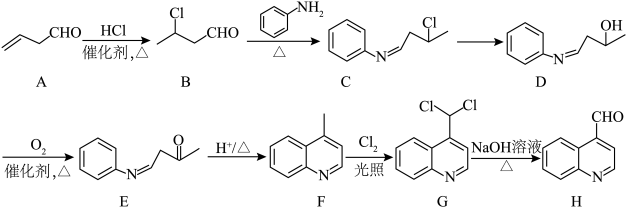
(2)
 的反应类型是
的反应类型是 的反应条件是
的反应条件是(3)E的同分异构体同时满足下列条件,写出该同分异构体的结构简式
①能与
 溶液发生显色反应;
溶液发生显色反应;②苯环上有4个取代基;
③分子中有4种不同化学环境的氢原子。
(4)
 的化学方程式是
的化学方程式是(5)写出以
 为原料制备
为原料制备 的合成流程图
的合成流程图
您最近一年使用:0次
解题方法
9 . 硫酸四氨合铜(Ⅱ)晶体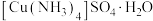 为深蓝色,易溶于水,不溶于乙醇等有机溶剂,加热时易失氨。某研究小组拟用粗
为深蓝色,易溶于水,不溶于乙醇等有机溶剂,加热时易失氨。某研究小组拟用粗 (含少量
(含少量 )合成硫酸四氨合铜晶体并测定其纯度。
)合成硫酸四氨合铜晶体并测定其纯度。
I.硫酸四氨合铜(Ⅱ)晶体制备与提纯
步骤①:称取 粗
粗 倒入烧杯中,加入适量稀硫酸溶解,将溶液加热至沸腾,边搅拌边逐滴加入
倒入烧杯中,加入适量稀硫酸溶解,将溶液加热至沸腾,边搅拌边逐滴加入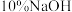 溶液至pH为3.5,继续加热溶液片刻,趁热过滤,得到
溶液至pH为3.5,继续加热溶液片刻,趁热过滤,得到 溶液。
溶液。
步骤②:___________ ,调pH为3.5的目的是___________ 。
(2)写出操作①中发生的离子反应方程式___________ 。
(3)操作③中洗涤步骤中可选用的洗涤液是___________ 。
A.乙醇与乙醚的混合液 B.蒸馏水 C.饱和硫酸钠溶液
(4)某同学认为操作②也可以通过蒸发浓缩、冷却结晶获得所要晶体,你___________ (填“是”或“否”)同意他的观点,并说明理由___________ 。
Ⅱ.硫酸四氨合铜(Ⅱ)晶体纯度测定
步骤①:准确称取 固体于烧杯中,加稀硫酸溶解,配制为
固体于烧杯中,加稀硫酸溶解,配制为 的溶液。
的溶液。
步骤②:量取上述试液 于锥形瓶中,加入
于锥形瓶中,加入 水和KI固体(稍过量)
水和KI固体(稍过量)
步骤③:用 标准溶液(
标准溶液( )滴定至溶液呈淡黄色,加入淀粉溶液
)滴定至溶液呈淡黄色,加入淀粉溶液 ,溶液变为蓝色,再加入
,溶液变为蓝色,再加入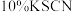 溶液
溶液 ,继续用
,继续用 标准溶液滴定至蓝色刚好消失,重复操作3次,平均用量为
标准溶液滴定至蓝色刚好消失,重复操作3次,平均用量为 。
。
已知:①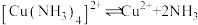 ,
,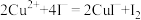 ,
, 沉淀表面易吸附
沉淀表面易吸附 。
。
② 比
比 更难溶。③
更难溶。③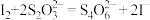 。
。
(5)硫酸四氨合铜晶体纯度是___________ (写出用m、V表示的计算表达式。)。
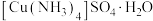 为深蓝色,易溶于水,不溶于乙醇等有机溶剂,加热时易失氨。某研究小组拟用粗
为深蓝色,易溶于水,不溶于乙醇等有机溶剂,加热时易失氨。某研究小组拟用粗 (含少量
(含少量 )合成硫酸四氨合铜晶体并测定其纯度。
)合成硫酸四氨合铜晶体并测定其纯度。I.硫酸四氨合铜(Ⅱ)晶体制备与提纯
步骤①:称取
 粗
粗 倒入烧杯中,加入适量稀硫酸溶解,将溶液加热至沸腾,边搅拌边逐滴加入
倒入烧杯中,加入适量稀硫酸溶解,将溶液加热至沸腾,边搅拌边逐滴加入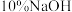 溶液至pH为3.5,继续加热溶液片刻,趁热过滤,得到
溶液至pH为3.5,继续加热溶液片刻,趁热过滤,得到 溶液。
溶液。步骤②:

(2)写出操作①中发生的离子反应方程式
(3)操作③中洗涤步骤中可选用的洗涤液是
A.乙醇与乙醚的混合液 B.蒸馏水 C.饱和硫酸钠溶液
(4)某同学认为操作②也可以通过蒸发浓缩、冷却结晶获得所要晶体,你
Ⅱ.硫酸四氨合铜(Ⅱ)晶体纯度测定
步骤①:准确称取
 固体于烧杯中,加稀硫酸溶解,配制为
固体于烧杯中,加稀硫酸溶解,配制为 的溶液。
的溶液。步骤②:量取上述试液
 于锥形瓶中,加入
于锥形瓶中,加入 水和KI固体(稍过量)
水和KI固体(稍过量)步骤③:用
 标准溶液(
标准溶液( )滴定至溶液呈淡黄色,加入淀粉溶液
)滴定至溶液呈淡黄色,加入淀粉溶液 ,溶液变为蓝色,再加入
,溶液变为蓝色,再加入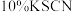 溶液
溶液 ,继续用
,继续用 标准溶液滴定至蓝色刚好消失,重复操作3次,平均用量为
标准溶液滴定至蓝色刚好消失,重复操作3次,平均用量为 。
。已知:①
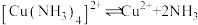 ,
,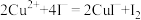 ,
, 沉淀表面易吸附
沉淀表面易吸附 。
。②
 比
比 更难溶。③
更难溶。③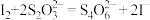 。
。(5)硫酸四氨合铜晶体纯度是
您最近一年使用:0次
解题方法
10 . 布洛芬是常用的解热镇痛药,其结构简式如下图所示,下列有关说法正确的是
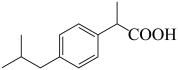
A.布洛芬的分子式为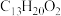 | B. 布洛芬可与 布洛芬可与 发生加成反应 发生加成反应 |
| C.所有原子可能共平面 | D.苯环上的一氯代物有两种 |
您最近一年使用:0次