名校
解题方法
1 . 由硫酸钾、硫酸铝和硫酸组成的混合溶液,其中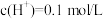 ,
,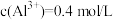 ,
,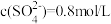 ,则c(K+)为
,则c(K+)为
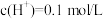 ,
,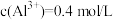 ,
,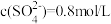 ,则c(K+)为
,则c(K+)为| A.0.3 mol/L | B.0.2 mol/L | C.0.15 mol/L | D.0.4 mol/L |
您最近一年使用:0次
2023-05-01更新
|
868次组卷
|
22卷引用:四川省雅安中学2021-2022学年高一上学期半期考试化学试题
四川省雅安中学2021-2022学年高一上学期半期考试化学试题第2章第三节第3课时物质的量浓度(课后)——课前、课中、课后同步专题精编(人教版2019必修第一册)江苏省徐州市沛县2021-2022学年高一上学期第一次学情调研化学试题江苏省淮安市高中校协作体2021-2022学年高一上学期期中考试化学试题四川省眉山市仁寿县龙正中学、清水中学2021-2022学年高一上学期期中联考化学试题吉林省前郭尔罗斯蒙古族自治县蒙古族中学2021-2022学年高一上学期第二次月考化学试题湖北省巴东一中2020-2021学年高一上学期第五次月考化学试题河南省濮阳市油田第二高级中学2021-2022学年高一上学期诊断性测试化学试题山东省济宁市微山县第二中学2021-2022学年高一上学期12月月考化学试题江苏省溧阳中学2020~2021学年高一上学期第一次阶段考试化学试题(已下线)第13讲 物质的量浓度-【暑假自学课】2022年新高一化学暑假精品课(沪科版2020必修第一册)(已下线)1.3.5 物质的量浓度-【帮课堂】2022-2023学年高一化学同步精品讲义(沪科版2020必修第一册)上海市行知中学2022-2023学年高一上学期10月质量检测化学试题江苏省镇江第一中学2022-2023学年高一上学期月考化学试题北京市第八中学2022-2023学年高一上学期期中考试选考班化学试题江苏省盐城市大丰中学、盐城一中等六校2022-2023学年高一上学期期末联考化学试题(已下线)【知识图鉴】单元讲练测必修第一册第二单元01讲核心(已下线)章末综合评价(二)黑龙江省哈尔滨市宾县第二中学2022-2023学年高一上学期期中考试化学试题(已下线)【定心卷】2.3.3 物质的量浓度随堂练习-人教版2023-2024学年必修第一册(已下线)专题02 物质的化学计量-【好题汇编】备战2023-2024学年高一化学上学期期末真题分类汇编(江苏专用)(已下线)浙江省柯桥中学2023-2024学年高一上学期期中检测化学试题
10-11高一下·辽宁大连·阶段练习
名校
解题方法
2 . 将纯锌片和纯铜片按图示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是

| A.两烧杯中铜片表面均无气泡产生 | B.甲中铜片是正极,乙中铜片是负极 |
| C.两烧杯中溶液的c(H+)均减小 | D.产生气泡的速率甲比乙慢 |
您最近一年使用:0次
2023-04-28更新
|
1864次组卷
|
115卷引用:四川省雅安中学2020-2021学年高一下学期开学考试化学试题
四川省雅安中学2020-2021学年高一下学期开学考试化学试题(已下线)2013-2014四川省雅安中学下学期期中考试高二化学试卷(已下线)2013-2014四川省雅安中学下学期期中考试高二化学试卷高中化学苏教2019版必修第二册-专题6 第三单元 第1课时 化学能转化为电能(人教版2019)必修第二册 第六章 化学反应与能量 第一节 化学反应与能量变化内蒙古通辽市科尔沁区大林高中2020-2021学年高二4月月考化学试题黑龙江省牡丹江市海林市朝鲜族中学2020-2021学年高一5月月考化学试题辽宁省朝阳市建平县实验中学2020-2021学年度高一下学期期末考试化学试题(已下线)1.2.1 原电池的工作原理(备作业)-【上好课】2021-2022学年高二化学同步备课系列(苏教版2019选择性必修1)(已下线)第14讲 原电池-2020-2021学年秋季班高一上学期化学教材知识点精讲练(沪科版)甘肃省庆阳市第六中学2020-2021学年高一下学期期中考试化学(文)试题甘肃省庆阳市第六中学2020-2021学年高一下学期期中考试化学(理)试题广东省茂名高州市2020-2021学年高一下学期期末考试化学试题吉林省乾安县第四中学2020-2021学年高一下学期期中考试化学试题福建省福州市文博中学2020-2021学年高一下学期期中考试化学试题河北省顺平县中学2021-2022学年高二上学期第一次月考化学试题广东省揭阳市惠来县第一中学2021-2022学年高二上学期第二次阶段考试化学试题福建省南安市柳城中学2021-2022学年高二上学期期中考试化学试题(已下线)2010—2011学年辽宁省大连协作体高一4月月考化学试卷(已下线)2010—2011学年海南省洋浦中学高二上学期期末考试化学试卷(已下线)2010—2011学年云南省芒市中学高一下学期期末考试化学试卷理(已下线)2010—2011学年山东省任城一中高一下学期期末考试化学试卷(已下线)2011-2012年云南省建水一中高二上学期期中考试化学(理)试题(已下线)2011-2012学年甘肃武威六中高二上学期期末考试化学(理)试卷(已下线)2011-2012学年吉林省松原市油田高中高二上学期期末考试化学试卷(已下线)2011-2012学年安徽省六安市徐集中学高二上学期期末考试化学试卷(已下线)2012年苏教版高中化学选修4 1.2化学能与电能的转化(已下线)2012-2013学年福建省福州文博中学高一下学期期末考试化学试卷(已下线)2014年高一化学人教版必修2 期中测试练习卷(已下线)2013-2014湖南师大附中第二学期期中考试高一化学试卷(已下线)2013-2014山西省山大附中高一下学期期中化学试卷(已下线)2014届山东省济南一中高二上学期期末考试化学试卷 2014-2015学年福建省清流一中高二上学期月考化学理试卷2014-2015山东省淄博市沂源一中高二12月月考化学试卷2014-2015陕西省西安市庆安高级中学高二上学期期末化学试卷2014-2015山东省淄博市沂源县第一中学高二12月月考化学试卷2014-2015陕西省西安市七十中高二上学期期末考试化学试卷2014-2015陕西省三原北城中学高一下学期第一次月考化学试卷2014-2015安徽省宣郞广三校高一下学期期中联考化学试卷2014-2015学年吉林省松原市扶余县第一中学高一下期末化学试卷2015-2016学年甘肃省天水一中高二上学期第一次段中考试化学试卷2015-2016北京大学附中宇华教育集团高二12月化学卷2015-2016北京大学附中宇华教育集团高一12月化学卷2015-2016学年江苏省扬州中学高二上期中必修化学试卷2015-2016学年安徽省安庆市怀宁县高河中学高二上期末化学试卷2015-2016学年福建省八县一中高二上学期期末考试化学试卷2015-2016学年河北武邑中学高一下5.15周考化学试卷2015-2016学年江西省宜春三中高一下期中化学试卷2015-2016学年浙江省宁波市效实中学高一下期中化学试卷2015-2016学年广东省仲元中学高一下期末文科化学试卷2016-2017学年山东省德州市陵城一中高二上10月月考化学试卷2016-2017学年陕西西藏民族学院附中高二上月考二化学卷2017届浙江省温州中学高三3月高考模拟化学试卷2016-2017学年浙江省温州市“十五校联合体”高一下学期期中联考化学试卷广东省广州市第二中学2016-2017学年高二下学期期中考试化学试题浙江省东阳中学2016-2017学年高二下学期期中考试化学试题河北省张家口市第一中学2016-2017学年高一(实验班、普通班)6月月考(文)化学试题广西贵港市覃塘高级中学2016-2017学年高一6月月考化学试题浙江省2018版考前特训(2017年10月)学考70快练:原电池河北省张家口市2016-2017学年高一下学期期末考试化学试题山东省枣庄市第八中学南校区高二10月份月考化学试题福建省惠安惠南中学2017-2018学年高二10月月考(理)化学试题山东省锦泽技工学校2017-2018学年高二10月月考化学试题福建省闽侯第六中学2017-2018学年高二12月月考化学试题高中化学人教版 选修四 第四章 电化学基础 第一节 原电池 原电池新疆兵团第二师华山中学2017-2018学年高一下学期期中考试化学试题浙江省宁波市北仑中学2018-2019学年高二上学期期初返校考试化学试题吉林省辽源市田家炳高级中学2018-2019学年高二9月月考化学试题(已下线)2018年11月21日 《每日一题》人教选修4-原电池工作原理甘肃省武威市第十八中学2018-2019学年高二上学期期末考试化学试题【全国百强校】重庆市第八中学2018-2019学年高二上学期期中考试化学试题【校级联考】黑龙江省龙东南七校2018-2019学年高二上学期期末联考化学试题黑龙江省绥滨县第一中学2018-2019学年高一(理)下学期期中考试化学试题吉林省吉林市第三中学2018-2019学年高一5月阶段测试化学试题山西省祁县第二中学校2018-2019学年高一下学期期末考试化学试题上海市浦东新区2017-2018学年高一上学期期末化学试题上海市金山中学2015-2016学年高一下学期期中考试化学试题陕西省咸阳市西藏民族大学附属中学2019-2020学年高二上学期第二次月考化学试题山西省应县第一中学校2019-2020学年高二上学期第四次月考化学试题云南省西双版纳傣族自治州勐腊县第一中学2019-2020学年高二上学期期末考试化学试题内蒙古赤峰市宁城县2019-2020学年高二上学期期末考试化学试题6.1.2 化学反应与电能——2020年春高一新人教版第二册化学一课一练山东省滕州市第一中学2019-2020学年高一下学期第一次月考化学试题第2章 化学键化学反应规律 综合拓展——B拓展区 夯实基础(鲁科版(2019)第二册)第2章 化学键 化学反应与能量 综合拓展——B拓展区 夯实基础(鲁科版必修2)江苏省宿豫中学2019-2020学年度高二下学期调研测试(实验班)化学试题2020年春高一化学新人教版第二册课后同步:6.1.2 化学反应与电能河北省唐山市海港高级中学2019-2020学年高一下学期第五次校考化学试题安徽省合肥市2019—2020学年高一下学期期中考试化学试题河北省邯郸市肥乡区第一中学2019-2020学年高一下学期开学考试化学试题江西省南昌市实验中学2019-2020学年高一5月摸底考试化学试题江苏省响水中学2019-2020学年高一下学期期中考试化学试题贵州省贵阳市第十四中学2019-2020学年高一下学期期末考试化学试题上海理工大附中2014-2015学年高一上学期期末化学试卷河北省秦皇岛市卢龙县中学2019-2020学年高一下学期第二次调研考试化学试题贵州省贵阳十四中2019-2020学年高一下学期期末考试化学试题贵州省遵义市航天高级中学2020-2021学年高二上学期第一次月考化学(文)试题黑龙江省农垦建三江管理局第一高级中学2020-2021学年高二上学期期中考试化学试题河北省石家庄市藁城区第一中学2019-2020学年高二上学期第三次月考化学试题2011年全国高中学生化学素质和实验能力竞赛(广东初赛B组)试题(已下线)章末培优 第6章 化学反应与能量-2021-2022学年高一化学课后培优练(人教版2019必修第二册)湖南省长沙市雅礼中学2021-2022学年高一下学期期中联考化学试题天津市南开大学附属中学2021-2022学年高一下学期期中检测化学试题(已下线)第06练 原电池的工作原理及其应用-2022年【暑假分层作业】高一化学(人教版2019必修第二册)(已下线)第08练 以新型化学电源及电极反应式的书写突破原电池原理-2022年【暑假分层作业】高二化学(2023届一轮复习通用)甘肃省武威市凉州区2021-2022学年高一下学期期末考试化学试题(已下线)4.1.1 原电池的工作原理-2022-2023学年高二化学上学期课后培优分级练(人教版2019选择性必修1)辽宁省东北师范大学连山实验高中2021-2022学年高一下学期第一次线上考试化学试题吉林省松原市油田第十一中学2021-2022学年高一下学期期末考试化学试题湖南省长沙市湖南师大附中2022-2023学年高一下学期第一次月考化学试题 湖南师范大学附属中学2022-2023学年高一下学期第一次月考化学试题第六章 化学反应与能量(B卷·能力提升练)-【单元测试】2022-2023学年高一化学分层训练AB卷(人教版2019必修第二册)广东省深圳市光明区高级中学、 深圳市光明书院2022-2023学年高一下学期4月期中联考化学试题(已下线)第六章 化学反应与能量【单元测试B卷】四川省泸州市龙马潭区2023-2024学年高一下学期5月期中考试化学试题
名校
解题方法
3 . 在0.5molNa2SO4中含有Na+的数目是
| A.3.01×1023 | B.6.02×1023 | C.0.5 | D.1 |
您最近一年使用:0次
2022-12-21更新
|
742次组卷
|
42卷引用:四川省雅安市2020-2021学年高一上学期期末考试化学试题
四川省雅安市2020-2021学年高一上学期期末考试化学试题湖南省平江县第一中学2020-2021学年高一上学期期末考试化学试题西藏昌都市第三中学2020-2021学年高一上学期期末考试化学试题(已下线)衔接点17 物质的量的单位—摩尔-2021年初升高化学无忧衔接北京市中国农业大学附属中学2020-2021学年高一上学期期末学业水平调研化学试题广东省华南师范大学附属龙门学校2021-2022学年高一上学期期中考试化学试题人教2019版必修第一册第二章第三节 物质的量课后习题上海市静安区2021-2022学年高一上学期期末考试化学试题内蒙古霍林郭勒市第一中学2021-2022学年高一上学期期中考试化学试题山西省稷山县稷山中学2020-201学年高一上学期期末考试化学试题陕西省西安市鄠邑区第二中学2021-2022学年高一上学期第一次月考化学试题湖南省临湘市第五中学2021-2022学年高一上学期期中考试化学试题江苏省盐城市时杨中学2017-2018学年高一上学期期中考试化学试题云南省峨山彝族自治县第一中学2017-2018学年高一12月月考化学试题云南省峨山彝族自治县第一中学2017-2018学年高二12月月考(文)化学试题新疆伊犁哈萨克自治州伊宁市第八中学2019-2020学年高一上学期期中考试化学试题甘肃省兰州大学附属中学(33中)2019-2020学年高一上学期期中考试化学试题北京市清华志清中学2018-2019学年高一上学期期中考试化学试题河南省开封市第五中学2019-2020学年高一上学期11月月考化学试题(已下线)2.3.1 物质的量的单位--摩尔-2020-2021学年高一化学同步课堂帮帮帮(人教版2019必修第一册)贵州省遵义市航天高级中学2020-2021学年高二上学期第一次月考化学(文)试题吉林省梅河口市朝鲜族中学2019-2020学年高一上学期期末考试化学试题吉林省梅河口市三校2019-2020学年高一上学期期末联考化学试题四川省/成都新津为明学校2020-2021学年高一上学期第一次月考化学试题内蒙古包头钢铁公司第四中学2020-2021学年高一上学期期中考试化学试题江苏省常州市戚墅堰高级中学2020-2021学年高一上学期期中质量调研考试化学试题湖南省怀化市第五中学2019-2020学年高一下学期期中考试化学试题黑龙江省大兴安岭实验中学(西校区)2020-2021学年高一上学期期中考试化学试题四川师范大学附属中学安宁校区2021-2022学年高一上学期期中考试化学试题天津市河东区普通高中2022年高二学业水平合格考试模拟化学试题黑龙江省哈尔滨市第三十二中学2021-2022学年高一上学期期末考试化学试题新疆喀什第二中学2021-2022学年高一下学期开学考试化学试题(已下线)2.3.1 物质的量的单位——摩尔-2022-2023学年高一化学上学期课后培优分级练(人教版2019必修第一册)青海省西宁市湟源县第一中学2020-2021学年高一上学期期中考试化学试题黑龙江省哈尔滨市宾县第二中学2021-2022学年高一上学期期末考试化学试题河南省平顶山市蓝天高级中学2021-2022学年高一上学期期末考试化学试题河南省洛阳市2022-2023学年高一上学期期中考试化学试题上海市莘庄中学2022-2023学年高一上学期期末考试化学试题新疆疏勒县第一中学等3校2022-2023学年高一上学期1月期末考试化学试题湖南省涟源市第二中学2022-2023学年高一上学期11月期中考试化学试题北京市第一六六中学2023-2024学年高一上学期期中考试化学试题新疆喀什地区巴楚县第一中学2023-2024学年高一上学期12月月考化学试题
名校
解题方法
4 . 可逆反应 在不同条件下的反应速率如下,其中反应速率最快的是
在不同条件下的反应速率如下,其中反应速率最快的是
 在不同条件下的反应速率如下,其中反应速率最快的是
在不同条件下的反应速率如下,其中反应速率最快的是A.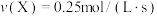 | B.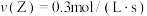 |
C. | D.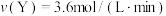 |
您最近一年使用:0次
2022-12-05更新
|
549次组卷
|
27卷引用:四川省雅安中学2020-2021学年高一下学期期中考试化学试题
四川省雅安中学2020-2021学年高一下学期期中考试化学试题广西河池市2020-2021学年高二上学期期末教学质量检测化学试题广西来宾市2020-2021学年高二上学期期末教学质量检测化学试题河北省衡水市第十四中学2020-2021学年高二下学期摸底考试化学试题辽宁省阜新市第二高级中学2020-2021学年高二下学期第一次月考化学试题湖北省黄冈市麻城市麻城二中2020-2021学年高一下学期期中考试化学试题吉林省“BEST合作体”2020-2021学年高一下学期期中化学试题河南省周口市中英文学校2020-2021学年高一下学期期中考试化学试题湖北省华中师范大学潜江附属中学2020-2021学年高一下学期5月月考化学试题江苏省宿迁市2020-2021学年高一下学期期末考试化学试题吉林省长春市2020-2021学年高一下学期期末联考化学试题贵州省平塘民族中学2021-2022学年高二上学期第一次月考化学试题江苏省苏州市相城区陆慕高级中学2021-2022学年高二上学期第一次月考化学试题新疆生产建设兵团第二师八一中学2021-2022学年高二上学期期中考试化学试题陕西省神木中学2021-2022学年高二上学期第一次月考化学试题黑龙江省齐齐哈尔市恒昌中学校2021-2022学年高一下学期期中考试化学试题黑龙江省大庆市大庆中学2021-2022学年高一下学期期中考试化学试题辽宁省营口市普通高中2021-2022学年高一下学期期末化学试题吉林省长春市农安县2021-2022学年高一下学期期末考试化学试题河北省元氏县第四中学2022-2023学年高二上学期开学考试化学试卷河南省南乐县第一高级中学2022-2023学年高二上学期第二次月考化学试题河北省邯郸市大名县第一中学2022-2023学年高一下学期3月月考化学试题黑龙江省齐齐哈尔市恒昌中学校2022-2023学年高一下学期5月期中考试化学试题江苏省常熟中学2023-2024学年高二上学期10月阶段性学业水平调研化学试题江苏省苏州市常熟中学2023-2024学年高二上学期10月月考化学试题湖南省邵东市第三中学2022-2023学年高一下学期期末考试化学试题(已下线)重难点01 化学反应速率的计算及平衡图像分析-【好题汇编】备战2023-2024学年高一化学下学期期末真题分类汇编(江苏专用)
11-12高二上·湖北·期中
名校
解题方法
5 . 下列有关化学反应速率的说法正确的是
| A.用铁片和稀硫酸反应制取氢气时,改用98%的浓硫酸可加快产生氢气的速率 |
| B.100 mL 2 mol/L的盐酸跟锌片反应,加入适量的氯化钠溶液,反应速率不变 |
| C.SO2的催化氧化是一个放热的反应,所以升高温度,反应速率减慢 |
| D.汽车尾气中的NO和CO可以缓慢反应生成N2和CO2,减小压强反应速率减慢 |
您最近一年使用:0次
2022-09-15更新
|
2167次组卷
|
97卷引用:四川省雅安中学2020-2021学年高一下学期开学考试化学试题
四川省雅安中学2020-2021学年高一下学期开学考试化学试题湖南省娄底市春元中学2021届高三上学期第四次月考化学试题人教版2019必修第二册 第六章 本章达标检测高中化学苏教2019版必修第二册-专题6 第一单元 第1课时 化学反应速率(人教版2019)必修第二册 第六章 化学反应与能量 第二节 化学反应的速率与限度浙江省宁波市咸祥中学2020-2021学年高一下学期期中考试化学试题甘肃省会宁县第一中学2020-2021学年高一下学期期中考试化学试题黑龙江省牡丹江市海林市朝鲜族中学2020-2021学年高一5月月考化学试题福建省福州外国语学校2020-2021学年高一下学期期中考试化学试题(已下线)课时35 化学反应速率及影响因素-2022年高考化学一轮复习小题多维练(全国通用)(已下线)2.1.2 影响化学反应速率的因素-2021-2022学年高二化学课后培优练(苏教版2019选择性必修1)重庆市重庆实验外国语学校2021-2022学年高二上学期9月月考化学试题辽宁省渤海大学附属高级中学2021-2022学年高二上学期第一次月考化学试题(已下线)第二章 化学反应速率和化学平衡 单元综合检测-2021-2022学年高二化学课后培优练(人教版选修4)天津市武清区杨村第一中学2021-2022学年高二上学期第一次月考化学试题安徽省合肥市第六中学2021-2022学年高二上学期月考化学试题吉林省四平市普通高中2021-2022学年高二上学期期中考试化学试题云南省昭通市镇雄县第四中学2021-2022学年高二上学期第一次月考化学试题山西省乡宁县第一中学2021-2022高二上学期第一次月考化学试题河北省武安市第一中学2021-2022学年高二上学期第一次月考化学试题黑龙江省伊春市伊美区第二中学2021-2022学年高二上学期期中考试化学试题陕西省西安市雁塔区第二中学2021-2022学年高二上学期第一次月考化学试题(已下线)2011-2012学年湖北省部分重点中学高二上学期期中联考化学试卷(已下线)2011-2012学年黑龙江龙东地区高二第一学期高中教学联合体期末考试化学试卷(已下线)2011-2012年安徽芜湖一中高二下学期期中考试理科化学试卷(已下线)2013-2014湖北省沙市中学高二上学期第七次周练化学试卷(已下线)2015届北京理工附中高三第一次月考化学试卷2014-2015山东省淄博市第一中学高一下学期期中考试化学试卷2014-2015学年福建省晋江市平山中学高二下学期期中考试化学试卷2015-2016学年广西钦州港经济开发区中学高一上学期期末化学试卷2016届河北省定州中学高三下周练(一)化学试卷2016届河北定州中学高三下学期周练二化学试卷2015-2016学年山西省怀仁一中高一下期中化学试卷2015-2016学年江西省横峰中学高一下期中化学试卷2015-2016学年天津市静海县六校高一下学期期中联考化学试卷2015-2016学年江西省于都三中高一第三次月考化学试卷2015-2016学年安徽省舒城晓天中学高一下第三次月考化学试卷2015-2016学年广西宾阳县宾阳中学高二5月月考化学试卷2015-2016学年河北省定州中学高一下期末化学试卷2015-2016学年四川省成都树德中学高一下期末化学试卷2015-2016学年山东省烟台市招远二中高一下3月月考化学试卷2016-2017学年黑龙江大庆中学高二上期中化学试卷2016-2017学年河北省邯郸市成安一中、永年二中高二上期中化学卷2016-2017学年云南省曲靖一中高二上期中化学试卷2016-2017学年陕西省西安一中高二上期中化学试卷2016-2017学年山西省大同市第一中学高二2月月考化学试卷2016-2017学年甘肃省嘉峪关市酒钢三中高二上学期期末考试化学试卷四川省成都市盐道街中学2016~2017学年高一下学期五月月考化学试题西藏日喀则市第一高级中学2017-2018学年高二上学期期中考试化学试题山西省运城中学、芮城中学2017-2018学年高二上学期期中联考化学试题河北省邯郸市2016-2017学年高二上学期期中考试化学试题湖南省临武一中、嘉禾一中2017-2018学年高二12月联考化学试题广西桂林市第十八中学2017-2018学年高二下学期开学考试化学试题安徽省定远重点中学2017-2018学年高一下学期第一次月考化学试题浙江省余姚中学2017-2018学年高一4月质量检测化学试题【全国百强校】河南省南阳市第一中学2017-2018学年高一下学期期末考前模拟化学试题【全国百强校】广西陆川县中学2017-2018学年高二下学期期末考试化学试题【全国百强校】河南省林州市第一中学2018-2019学年高二上学期开学考试化学试题浙江省诸暨中学2018-2019学年高二上学期10月(期中)阶段性考试实验班化学试题江苏省泰州市第二中学2017-2018学年高二上学期期中考试化学试题高二人教版选修4 期末学业测评(一)安徽省定远县第三中学2018-2019学年度下学期高二化学开学检测卷【全国百强校】山东省招远一中2018-2019学年高一下学期4月月考化学试题河南省周口中英文学校2018-2019学年高一下学期期中考试化学试题湖南省醴陵市第一中学2018-2019学年高一下学期期中考试化学试题浙江省丽水市四校2018-2019学年高一下学期期中化学试题黑龙江省大庆中学2019-2020学年高二上学期期中考试化学试题江西省赣州市于都二中2019-2020学年高二上学期第三次月考化学试题2019——2020学年人教版必修2 第二章 化学反应与能量新疆昌吉回族自治州玛纳斯县第一中学2018-2019学年高二上学期第一次月考化学试题天津市静海区第一中学2020届高三下学期第六周周末训练化学试题河北省邯郸市第一中学2019—2020学年高一4月月考化学试题河北省新乐市第一中学2019-2020学年高二上学期第二次月考化学试题安徽省定远县育才学校2019-2020学年高一6月月考化学试题山东济南市历城第二中学2019-2020学年高一下学期开学考试化学试题山东省济宁市微山县第二中学2019-2020学年高一下学期第三学段考试化学试题江苏省南通市包场高级中学2020-2021学年高二上学期第一次学情检测化学(选修)试题(已下线)【南昌新东方】8. 外国语 刘惠文江西省上高二中2020-2021学年高二上学期第二次月考化学试题山东省德州市第一中学2020-2021学年高二上学期期中检测化学试题福建省福州市闽江口联盟校2020-2021学年高二上学期期中联考化学试题甘肃省天水市秦安县第一中学2021-2022学年高一下学期期中考试化学试题 广东省广州市育才中学2021-2022学年高一下学期期中考试化学试题江苏省南京市金陵中学2021-2022学年高一下学期6月月考化学试题河南省南阳市第六完全学校高级中学2021-2022学年高一下学期第三次考试化学试题安徽省合肥市肥东县综合高中2021-2022学年高一下学期期中考试化学试题天津市武清区四校2022-2023学年高二上学期第一次阶段性练习化学试题广东省江门市新会第一中学2022-2023学年高二上学期期中考试化学试题安徽省蚌埠市田家炳中学、五中2019-2020学年高二上学期期中考试化学试题广东省广州市协和中学2022-2023学年高一下学期期中考试化学试题吉林省长春市第二实验中学2022-2023学年高一下学期期中考试化学试题天津市杨柳青一中、咸水沽一中 、四十七中,一百中学四校2022-2023学年高一下学期期末联考化学试题浙江省嘉兴市八校联盟2022-2023学年高二上学期期中联考化学试题天津市第九十五中学益中学校2023-2024学年高二上学期第一次月考化学试题云南省曲靖市第一中学2023-2024学年高二上学期11月期中考试化学试题江西省南昌十九中2022-2023学年高二上学期第一次月考化学试卷福建省福州第四中学2023-2024学年高一下学期期中考试化学试卷
名校
解题方法
6 . 下列各离子组在指定的溶液中能够大量共存的是
| A.无色溶液中:Cu2+、K+、SCN-、Cl- |
B.pH=11的NaOH溶液中:CO 、Na+、NO 、Na+、NO 、SO 、SO |
C.由水电离出的c(H+)=1.0×10−13 mol•L-1的溶液中:Na+、NH 、SO 、SO 、HCO 、HCO |
D.含有NO 的溶液中:I-、SO 的溶液中:I-、SO 、SO 、SO 、H+ 、H+ |
您最近一年使用:0次
2022-09-14更新
|
217次组卷
|
23卷引用:四川省雅安市2020-2021学年高二下学期期末检测化学试题
四川省雅安市2020-2021学年高二下学期期末检测化学试题北京市北京交通大学附属中学2020-2021学年高二上学期期末练习化学试题河北省衡水市第十四中学2020-2021学年高二下学期摸底考试化学试题北京朝阳市陈经纶中学2021-2022学年高三上学期10月月考化学试题北京市顺义牛栏山第一中学2021-2022学年高三上学期10月月考化学试题北京师范大学第二附属中学未来科技城学校2021-2022学年高二上学期期中考试化学试题北京市中央民族大学附属中学2021-2022学年高三上学期12月月考化学试题北京市海淀区中关村中学2019-2020学年高二下学期期末练习化学试题北京清华大学附属中学朝阳分校2020-2021学年高二上学期期中考试化学试题(已下线)全册综合检测(一)-2020-2021学年高二化学选择性必修1同步单元AB卷(新教材鲁科版)北京市第十二中学2020-2021学年高二上学期12月月考化学试题天津市第三中学2020-2021学年高二上学期12月月考化学试题宁夏青铜峡市高级中学2021-2022学年高二下学期开学考试化学试题福建省福州教育学院附属中学2021-2022学年高二上学期期末考试化学试题青海省西宁市湟源县第一中学2020-2021学年高二上学期期中考试化学试题甘肃省武威第七中学2021-2022学年高二下学期学科竞赛化学试题河北省衡水市第二中学2022-2023学年高二上学期期中考试化学试题北京师范大学附属中学2022-2023学年上学期高二化学期末试题湖南省衡阳县第四中学 2022-2023学年高二下学期开学摸底考试(平行班)化学试题上海市青浦高级中学 2022-2023学年高二上学期期末线上质量检测化学试题北京师范大学第二附属中学2023-2024学年高二上学期10月月考化学试题四川省射洪中学校2022-2023学年高二下学期3月月考化学试题北京市第十二中学2023-2024学年高二上学期期中考试化学试题
11-12高一上·海南·期中
名校
解题方法
7 . 下列关于物质的量浓度的表述中正确的是
A.0.3 mol·L-1K2SO4溶液中含有K+和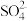 总物质的量为0.9 mol 总物质的量为0.9 mol |
| B.当1 L水吸收22.4 L氨气时所得氨水的浓度不是1 mol·L-1,只有当22.4 L氨气溶于水制得1 L氨水时,其浓度才是1 mol·L-1 |
C.在Na2SO4和KCl的中性混合水溶液中,如果 K+和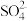 的物质的量浓度相等,那么Na+和Cl-的物质的量浓度一定相等 的物质的量浓度相等,那么Na+和Cl-的物质的量浓度一定相等 |
| D.10 ℃时0.35 mol·L-1的KCl饱和溶液100 mL,蒸发掉5 g水,冷却到10 ℃时,其体积小于100mL,它的物质的量浓度仍为0.35mol·L-1 |
您最近一年使用:0次
2022-04-01更新
|
887次组卷
|
41卷引用:四川省雅安中学2021-2022学年高一上学期10月月考化学试题
四川省雅安中学2021-2022学年高一上学期10月月考化学试题(已下线)第02讲 物质的量浓度与溶液的配制(精练)-2022年高考化学一轮复习讲练测河北正定中学2020-2021学年高一上学期第三次月考化学试题(已下线)【苏州新东方】10 吴江中学黑龙江省哈尔滨市第六中学2021-2022学年高一上学期期中考试化学试题(已下线)2011-2012学年海南中学高一上学期期中考试化学试卷2014-2015河北省唐山市一中高一上学期期中化学试卷2015-2016学年河北省唐山一中高一上第一次月考化学试卷2015-2016学年安徽省合肥一中高一上期中测试化学试卷2015-2016学年河南省信阳市高一上学期期末教学质量监测化学试卷(已下线)同步君 人教版 必修1 第1章 第2节 物质的量浓度2017届河北省武安三中高三上学期第一次月考化学试卷(已下线)1.2.3 物质的量在化学实验中的应用高中化学人教版 必修1 第一章 从实验学化学 2.化学计量在实验中的应用 物质的量浓度宁夏回族自治区长庆高级中学2019届高三上学期第一次月考化学试题【全国百强校】天津市静海县第一中学2018-2019学年高一9月学生学业能力调研化学试题湖南省双峰县第一中学2018-2019学年高一上学期第一次月考化学试题(已下线)【走进新高考】(人教版必修一)第一章 从实验学化学 单元练习02福建省泉州第一中学2018-2019学年高二第二学期期末考试化学试题湖北省宜昌市部分示范高中教学协作体2020届高三9月联考化学试题宁夏长庆高级中学2020届高三上学期第一次月考化学试题福建省南安第一中学2020届高三上学期第一次阶段考试化学试题山东省章丘四中2020届高三10月月考化学试题甘肃省兰州师范大学附属中学2019-2020学年高一上学期期中考试化学试题(已下线)第1单元 化学计量在实验中的应用(B卷 滚动提升检测)-2021年高考化学一轮复习单元滚动双测卷(已下线)第二章章末检测(1)——《高中新教材同步备课》(人教版 必修第一册)(已下线)1.3.3物质的量浓度练习(1)——《高中新教材同步备课》(鲁科版 必修第一册)河南省郑州市第一中学2021届高三上学期开学测试化学试题(已下线)小题必刷11 物质的量浓度与溶液的配制——2021年高考化学一轮复习小题必刷(通用版)(已下线)新东方【2019】【高一上】【第一次月考】【DC】【化学】高一必修第一册(苏教2019版)专题2 B 素养拓展区四川省遂宁市射洪中学校2020-2021学年高一上学期第一次月考化学试题(已下线)2.3.3 物质的量浓度(精练)-2020-2021学年上学期高一化学同步精品课堂(人教版必修第一册)安徽省舒城中学2020-2021学年高一上学期期中考试化学试题陕西省延安大学玉章实验中学2019-2020学年高二下学期期末考试化学试题贵州省贵阳市清镇养正学校2019-2020学年高一上学期期中考试化学试题江西省赣州市信丰中学2020-2021学年高一上学期第二次月考化学试题云南省镇沅县第一中学2021-2022学年高二下学期开学考试化学试题河南省郑州市新密市第一高级中学2022-2023学年高一上学期第一次月考化学试题(已下线)专题02 阿伏加德罗常数及其化学计算 (讲)-2023年高考化学二轮复习讲练测(新高考专用)(已下线)考点巩固卷01 化学计量(2大考点42题)?-2024年高考化学一轮复习考点通关卷(新高考通用)
名校
8 . 将质量为2.3gNa用刺了孔的铝箔(Al)包裹后放入水中,一共只收集到1.792L(标准状况)气体。若反应后溶液的体积为200mL。
(1)写出该过程中发生的化学反应的离子方程式___________ 。
(2)则反应后溶液中NaOH的物质的量浓度为___________
(1)写出该过程中发生的化学反应的离子方程式
(2)则反应后溶液中NaOH的物质的量浓度为
您最近一年使用:0次
名校
解题方法
9 . 按要求回答问题:
(1)将已配制好的饱和三氯化铁溶液滴入沸水中并煮沸一段时间,可得到红褐色液体,该反应的离子方程式为:___________
(2)实验室用氨水和硫酸铝溶液制取氢氧化铝,离子方程式为___________
(3)过氧化钠作为供氧剂时发生的化学反应(化学方程式):___________
(4)请用双线桥法标注以下氧化还原反应,标明电子转移数目,3Cl2+6KOH 5KCl+KClO3+3H2O
5KCl+KClO3+3H2O___________ ,氧化产物:还原产物=___________ (物质的量之比)。
(5)请用单线桥法标注以下氧化还原反应,标明电子转移数目:2 +5H2O2+6H+=2Mn2++5O2↑+5H2O
+5H2O2+6H+=2Mn2++5O2↑+5H2O___________ ,还原剂是___________ 。
(1)将已配制好的饱和三氯化铁溶液滴入沸水中并煮沸一段时间,可得到红褐色液体,该反应的离子方程式为:
(2)实验室用氨水和硫酸铝溶液制取氢氧化铝,离子方程式为
(3)过氧化钠作为供氧剂时发生的化学反应(化学方程式):
(4)请用双线桥法标注以下氧化还原反应,标明电子转移数目,3Cl2+6KOH
 5KCl+KClO3+3H2O
5KCl+KClO3+3H2O(5)请用单线桥法标注以下氧化还原反应,标明电子转移数目:2
 +5H2O2+6H+=2Mn2++5O2↑+5H2O
+5H2O2+6H+=2Mn2++5O2↑+5H2O
您最近一年使用:0次
名校
解题方法
10 . 我国化学家侯德榜发明了联合制碱法,为世界制碱工业做出了巨大贡献。联合制碱法的主要过程如下图所示(部分物质已略去)。
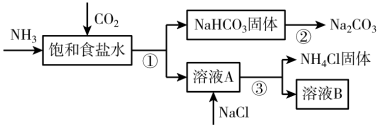
已知:NH3极易溶于水,且其水溶液显碱性。
(1)①~③所涉及的操作方法中,包含过滤的是___________ (填序号)。
(2)根据上图,将化学方程式补充完整:NH3+CO2+____+____=NaHCO3↓+_____,___________ (注意:书写完整的化学方程式,只填写物质的不给分!!)。
(3)下列说法中,正确的是___________(填字母)。
(4)某种市售食用碱是纯碱与小苏打的混合物,可大量应用于食品加工,如:面条、面包、馒头等,某校化学兴趣小组利用如图所示装置进行实验测定此种食用碱中纯碱的质量分数。
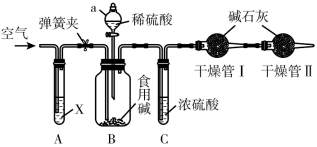
实验步骤:
①检查装置的气密性,称取样品(仅由纯碱与小苏打组成)10g,加到装置B中;
②连接装置,打开弹簧夹,先通一段时间空气后,关闭弹簧夹,打开分液漏斗活塞滴入稀硫酸至不再有气体生成;
③关闭分液漏斗的活塞,打开弹簧夹,继续通入一段时间空气。实验中记录的数据如表所示:
请回答下列问题:
①装置a的仪器名称是___________
②试剂X为NaOH溶液,实验开始前,先打开弹簧夹,通入一段时间空气,其目的为___________ ,实验结束后,需要继续通入一段时间的空气,其目的是将装置内的CO2赶到干燥管中被吸收。
③干燥管II的作用是___________ 。

已知:NH3极易溶于水,且其水溶液显碱性。
(1)①~③所涉及的操作方法中,包含过滤的是
(2)根据上图,将化学方程式补充完整:NH3+CO2+____+____=NaHCO3↓+_____,
(3)下列说法中,正确的是___________(填字母)。
| A.碳酸氢钠分解产生的CO2可回收并循环使用 |
| B.NH4Cl副产物可用作氮肥 |
C.溶液B中只含有 、Cl- 、Cl- |
| D.饱和氯化钠溶液中应该先通二氧化碳再通入氨气 |

实验步骤:
①检查装置的气密性,称取样品(仅由纯碱与小苏打组成)10g,加到装置B中;
②连接装置,打开弹簧夹,先通一段时间空气后,关闭弹簧夹,打开分液漏斗活塞滴入稀硫酸至不再有气体生成;
③关闭分液漏斗的活塞,打开弹簧夹,继续通入一段时间空气。实验中记录的数据如表所示:
| 装置B | 装置C | 干燥管I | |
| 实验前称得的质量/g | 180.0 | 30.0 | 120.4 |
| 实验后称得的质量/g | 174.2 | 31.5 | 124.8 |
请回答下列问题:
①装置a的仪器名称是
②试剂X为NaOH溶液,实验开始前,先打开弹簧夹,通入一段时间空气,其目的为
③干燥管II的作用是
您最近一年使用:0次



