1 . 将盛12mL一氧化氮和36mL二氧化氮混合气体的烧瓶倒置于水中,通入一定量的氧气,完全反应后,剩余气体体积为4mL,且该气体支持燃烧,则充入的氧气的体积为
| A.15mL | B.18mL | C.20mL | D.22mL |
您最近一年使用:0次
名校
解题方法
2 . 下列反应的离子方程式正确的是
A.向滴有酚酞的 溶液中滴入盐酸至红色恰好褪去: 溶液中滴入盐酸至红色恰好褪去: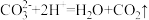 |
B.将硫酸铬溶液滴入含 的强碱性溶液中: 的强碱性溶液中: |
C.碳酸铵与氢氧化钙溶液反应:CO +Ca2+=CaCO3↓ +Ca2+=CaCO3↓ |
D.少量 通入苯酚钠溶液中: 通入苯酚钠溶液中: |
您最近一年使用:0次
3 . Ⅰ.下面两个方法都可以用来制氯气:①MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O;②2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O。③4HCl+O2
MnCl2+Cl2↑+2H2O;②2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O。③4HCl+O2 2Cl2+2H2O(g),根据以上两个反应,回答下列问题:
2Cl2+2H2O(g),根据以上两个反应,回答下列问题:
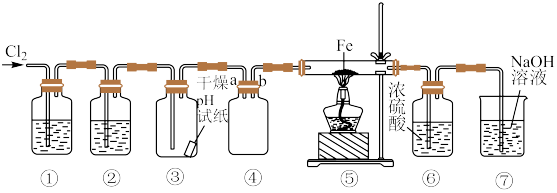
(1)反应①的离子方程式为___________ 。
(2)浓盐酸在反应①中表现出来的性质是___________。
(3)若要制得相同质量的氯气,反应①②所消耗的HCl的质量之比为___________ 。
(4)由上述3个反应发生的条件可推知MnO2、KMnO4、O2三种物质氧化性由强到弱的顺序为___________ 。
Ⅱ.某同学欲利用浓盐酸、MnO2、Fe等试剂制取无水氯化铁、收集一定量的氯气并验证其某些性质,实验装置如图所示(制气装置省略)。___________ (填名称)。
(6)装置③中现象是___________ ,装置④中有一处错误,更正为___________ 。
(7)装置⑦是用于氯气的尾气处理,防止污染空气,发生反应的化学方程式为___________ 。
 MnCl2+Cl2↑+2H2O;②2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O。③4HCl+O2
MnCl2+Cl2↑+2H2O;②2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O。③4HCl+O2 2Cl2+2H2O(g),根据以上两个反应,回答下列问题:
2Cl2+2H2O(g),根据以上两个反应,回答下列问题:(1)反应①的离子方程式为
(2)浓盐酸在反应①中表现出来的性质是___________。
| A.只有还原性 | B.只有氧化性 | C.只有酸性 | D.既表还原性和又表酸性 |
(3)若要制得相同质量的氯气,反应①②所消耗的HCl的质量之比为
(4)由上述3个反应发生的条件可推知MnO2、KMnO4、O2三种物质氧化性由强到弱的顺序为
Ⅱ.某同学欲利用浓盐酸、MnO2、Fe等试剂制取无水氯化铁、收集一定量的氯气并验证其某些性质,实验装置如图所示(制气装置省略)。
(6)装置③中现象是
(7)装置⑦是用于氯气的尾气处理,防止污染空气,发生反应的化学方程式为
您最近一年使用:0次
4 . 环境保护是化学的重要任务,请完成下列问题。
(1)采用“联合脱硫脱氮技术”处理烟气(含 、
、 、NO)可获得含
、NO)可获得含 、
、 、
、 的副产品,工业流程如图1所示。
的副产品,工业流程如图1所示。 采用“气-液逆流”接触吸收法(如图2),其优点是
采用“气-液逆流”接触吸收法(如图2),其优点是___________ 。
②反应釜 中
中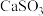 转化为
转化为 反应的化学方程式为
反应的化学方程式为___________ 。
(2)烟气(主要污染物 、
、 )对人类生活环境造成很大的污染。工业上采取氧化、还原等方法将之除去,以达到净化目的。
)对人类生活环境造成很大的污染。工业上采取氧化、还原等方法将之除去,以达到净化目的。
①烟气经 预处理后用碱液吸收,可减少其中
预处理后用碱液吸收,可减少其中 、
、 的含量。已知NO可被
的含量。已知NO可被 氧化为
氧化为 ,
, 用NaOH溶液吸收生成两种盐,其中一种盐是NaNO3 ,另一种盐的化学式为
用NaOH溶液吸收生成两种盐,其中一种盐是NaNO3 ,另一种盐的化学式为___________ 。
②尿素 在高温条件下与NO反应转化成三种无毒气体,该反应的化学方程式为
在高温条件下与NO反应转化成三种无毒气体,该反应的化学方程式为___________ 。
(3)工业上氮的氧化物通常是用碱性溶液吸收。
①用 溶液吸收硝酸工业尾气中的
溶液吸收硝酸工业尾气中的 ,生成等物质的量的两种钠盐(其中一种为
,生成等物质的量的两种钠盐(其中一种为 )及一种气体,反应的离子方程式为
)及一种气体,反应的离子方程式为___________ 。
②NaOH溶液浓度越大黏稠度越高,用不同浓度的NaOH溶液吸收 (混有NO)含量不同的工业尾气,氮氧化物的吸收率随NaOH溶液浓度的变化如图3所示,曲线
(混有NO)含量不同的工业尾气,氮氧化物的吸收率随NaOH溶液浓度的变化如图3所示,曲线 表示NO的物质的量
表示NO的物质的量___________ (填“大于”“小于”或“等于”) 物质的量。当NaOH溶液浓度高于
物质的量。当NaOH溶液浓度高于 后,氮氧化物的吸收率随NaOH溶液浓度的升高而降低的原因是
后,氮氧化物的吸收率随NaOH溶液浓度的升高而降低的原因是___________ 。
(1)采用“联合脱硫脱氮技术”处理烟气(含
 、
、 、NO)可获得含
、NO)可获得含 、
、 、
、 的副产品,工业流程如图1所示。
的副产品,工业流程如图1所示。

 采用“气-液逆流”接触吸收法(如图2),其优点是
采用“气-液逆流”接触吸收法(如图2),其优点是②反应釜
 中
中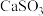 转化为
转化为 反应的化学方程式为
反应的化学方程式为(2)烟气(主要污染物
 、
、 )对人类生活环境造成很大的污染。工业上采取氧化、还原等方法将之除去,以达到净化目的。
)对人类生活环境造成很大的污染。工业上采取氧化、还原等方法将之除去,以达到净化目的。①烟气经
 预处理后用碱液吸收,可减少其中
预处理后用碱液吸收,可减少其中 、
、 的含量。已知NO可被
的含量。已知NO可被 氧化为
氧化为 ,
, 用NaOH溶液吸收生成两种盐,其中一种盐是NaNO3 ,另一种盐的化学式为
用NaOH溶液吸收生成两种盐,其中一种盐是NaNO3 ,另一种盐的化学式为②尿素
 在高温条件下与NO反应转化成三种无毒气体,该反应的化学方程式为
在高温条件下与NO反应转化成三种无毒气体,该反应的化学方程式为(3)工业上氮的氧化物通常是用碱性溶液吸收。
①用
 溶液吸收硝酸工业尾气中的
溶液吸收硝酸工业尾气中的 ,生成等物质的量的两种钠盐(其中一种为
,生成等物质的量的两种钠盐(其中一种为 )及一种气体,反应的离子方程式为
)及一种气体,反应的离子方程式为②NaOH溶液浓度越大黏稠度越高,用不同浓度的NaOH溶液吸收
 (混有NO)含量不同的工业尾气,氮氧化物的吸收率随NaOH溶液浓度的变化如图3所示,曲线
(混有NO)含量不同的工业尾气,氮氧化物的吸收率随NaOH溶液浓度的变化如图3所示,曲线 表示NO的物质的量
表示NO的物质的量 物质的量。当NaOH溶液浓度高于
物质的量。当NaOH溶液浓度高于 后,氮氧化物的吸收率随NaOH溶液浓度的升高而降低的原因是
后,氮氧化物的吸收率随NaOH溶液浓度的升高而降低的原因是
您最近一年使用:0次
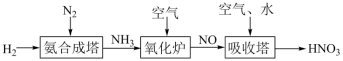
5 . 氮元素形成的化合物种类十分丰富。请根据以下工业制硝酸的原理示意图回答含氮化合物相关的问题: 的说法中,不正确的是___________(填字母)。
的说法中,不正确的是___________(填字母)。
(2)氨气在氧化炉中发生反应的化学方程式为___________ 。
(3)氮的氧化物(NOx)是常见的大气污染物之一,NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。当物质NO与NO2的物质的量之比为1:1时,与足量氨气能在催化剂作用下发生反应,生成两种无污染的物质,该反应的化学方程式为___________ 。
(4)“吸收塔”尾部会有含NO、NO2等氮氧化物的尾气排出,为消除它们对环境的污染,可用以下两种方法处理:
①可用ClO2将氮氧化物转化成 。向含ClO2的溶液中加入NaOH溶液调节至碱性,ClO2转化为去除氮氧化物效果更好的NaClO2,再通入NO气体进行反应。碱性条件下NaClO2去除NO反应的离子方程式为
。向含ClO2的溶液中加入NaOH溶液调节至碱性,ClO2转化为去除氮氧化物效果更好的NaClO2,再通入NO气体进行反应。碱性条件下NaClO2去除NO反应的离子方程式为___________ 。
②氨转化法。已知7mol氨恰好能将含NO和NO2共6mol的混合气体完全转化为N2,则混合气体中NO和NO2的物质的量之比为___________ 。
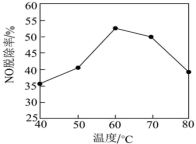
③还有人研究:在不同温度下经酸化处理的Ca(ClO)2溶液对NO脱除率的影响,结果如图所示。在60~80℃ 时,NO 脱除率下降的原因是___________ 。
 的说法中,不正确的是___________(填字母)。
的说法中,不正确的是___________(填字母)。A.工业合成 需要在高温、高压、催化剂下进行 需要在高温、高压、催化剂下进行 |
B. 可用来生产碳铵和尿素等化肥 可用来生产碳铵和尿素等化肥 |
C. 可用浓硫酸或无水氯化钙干燥 可用浓硫酸或无水氯化钙干燥 |
D. 受热易分解,须置于冷暗处保存 受热易分解,须置于冷暗处保存 |
(3)氮的氧化物(NOx)是常见的大气污染物之一,NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。当物质NO与NO2的物质的量之比为1:1时,与足量氨气能在催化剂作用下发生反应,生成两种无污染的物质,该反应的化学方程式为
(4)“吸收塔”尾部会有含NO、NO2等氮氧化物的尾气排出,为消除它们对环境的污染,可用以下两种方法处理:
①可用ClO2将氮氧化物转化成
 。向含ClO2的溶液中加入NaOH溶液调节至碱性,ClO2转化为去除氮氧化物效果更好的NaClO2,再通入NO气体进行反应。碱性条件下NaClO2去除NO反应的离子方程式为
。向含ClO2的溶液中加入NaOH溶液调节至碱性,ClO2转化为去除氮氧化物效果更好的NaClO2,再通入NO气体进行反应。碱性条件下NaClO2去除NO反应的离子方程式为②氨转化法。已知7mol氨恰好能将含NO和NO2共6mol的混合气体完全转化为N2,则混合气体中NO和NO2的物质的量之比为
③还有人研究:在不同温度下经酸化处理的Ca(ClO)2溶液对NO脱除率的影响,结果如图所示。在60~80℃ 时,NO 脱除率下降的原因是
您最近一年使用:0次
6 . 我国科学家利用过渡金属氮化物(TMNS)作催化剂,在常温下实现氨气的合成,其反应机理如图所示。

| A.用15N2进行合成反应,产物中只有15NH3 |
| B.TMNS表面上的N原子被氧化为氨气 |
| C.TMNS表面上氨脱附产生的空位有利于吸附N2 |
| D.TMNS不参与氨气的合成反应 |
您最近一年使用:0次
7 . 室温下进行下列实验,根据实验操作和现象所得出的结论正确的是
| 选项 | 实验操作和现象 | 结论 |
| A | 向溶有SO2的BaCl2溶液中通入气体X,出现白色沉淀 | 气体X一定具有强氧化性 |
| B | 向Na2CO3溶液中加入盐酸,将产生的气体直接通入硅酸钠溶液中,产生白色胶状沉淀硅酸 | 酸性:盐酸>碳酸>硅酸 |
| C | 某溶液中加入硝酸酸化的Ba(NO3)2溶液,无现象,再滴加AgNO3溶液,有白色沉淀生成 | 溶液中一定含有Cl- |
| D | 向5mL 0.1mol/L FeCl3溶液中滴加1mL 0.1mol/L KI溶液,再滴加几滴KSCN溶液,观察溶液颜色变化 | FeCl3和KI反应为可逆反应 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
8 . 过硫酸钠(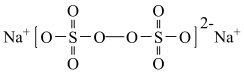 ),易溶于水,加热至65℃分解。作为强氧化剂,广泛应用于蓄电池工业、造纸工业、食品工业等。某化学小组对
),易溶于水,加热至65℃分解。作为强氧化剂,广泛应用于蓄电池工业、造纸工业、食品工业等。某化学小组对 制备和性质及用途进行探究。
制备和性质及用途进行探究。

工业制备过硫酸钠的反应原理:
主反应:

副反应:

实验室设计如图实验装置:
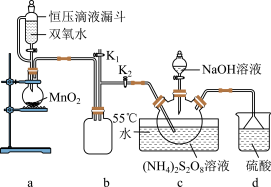
(2)装置b的作用是
(3)上述反应过程中,d装置中主要发生的化学反应方程式为
Ⅱ.探究
 的性质与用途
的性质与用途(4)
 用于废水中苯酚的降解
用于废水中苯酚的降解已知:a.
 具有强氧化性,
具有强氧化性, 浓度较高时会导致
浓度较高时会导致 淬灭。
淬灭。b.
 可将苯酚氧化,但反应速率较慢,加入
可将苯酚氧化,但反应速率较慢,加入 可加快反应。
可加快反应。过程为ⅰ.

ⅱ.
 将苯酚氧化为
将苯酚氧化为 气体
气体①
 氧化苯酚的离子方程式是
氧化苯酚的离子方程式是②将含
 的溶液稀释后加入苯酚的废水处理器中,调节溶液总体积为1L,pH=1,测得在相同时间内,不同条件下苯酚的降解率如图甲。
的溶液稀释后加入苯酚的废水处理器中,调节溶液总体积为1L,pH=1,测得在相同时间内,不同条件下苯酚的降解率如图甲。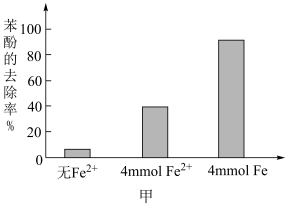
 ,可明显提高苯酚的降解率,主要原因是
,可明显提高苯酚的降解率,主要原因是(5)工业上利用
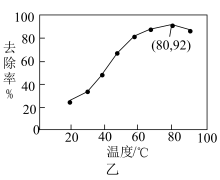
 能有效处理燃煤锅炉烟气中的NO气体。一定条件下,将含一定浓度NO的烟气以一定的速率通过含
能有效处理燃煤锅炉烟气中的NO气体。一定条件下,将含一定浓度NO的烟气以一定的速率通过含 的处理液中,NO去除率随温度变化的关系如图乙所示,80℃时,NO去除率为92%。若NO初始浓度为
的处理液中,NO去除率随温度变化的关系如图乙所示,80℃时,NO去除率为92%。若NO初始浓度为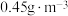 ,
,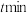 达到最大去除率,NO去除的平均反应速率:
达到最大去除率,NO去除的平均反应速率: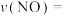
 。
。
您最近一年使用:0次
9 . 碘酸钙[ ]为白色结晶性粉末,微溶于水,不溶于乙醇,主要用作防臭剂、药物和食品添加剂。某同学在实验室制备
]为白色结晶性粉末,微溶于水,不溶于乙醇,主要用作防臭剂、药物和食品添加剂。某同学在实验室制备 实验步骤如下:
实验步骤如下:
Ⅰ.将一定质量的 、
、 和45mL水加入圆底烧瓶中,再加入几滴盐酸,使溶液的pH≈1,控制温度在85℃回流大约1h;
和45mL水加入圆底烧瓶中,再加入几滴盐酸,使溶液的pH≈1,控制温度在85℃回流大约1h;
Ⅱ.步骤Ⅰ反应完毕后,将烧瓶内的混合液倒入烧杯中,滴入KOH溶液调节pH=10,然后用滴管逐滴加入1 的
的 溶液,至沉淀完全。经一系列操作,得到碘酸钙粗品;
溶液,至沉淀完全。经一系列操作,得到碘酸钙粗品;
Ⅲ.碘酸钙粗品纯度:准确称取a g碘酸钙粗品于烧杯中,加入10mL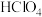 将其溶解,转移至250mL容量瓶中定容,移取25.00 mL溶液于锥形瓶中,再加入1mL
将其溶解,转移至250mL容量瓶中定容,移取25.00 mL溶液于锥形瓶中,再加入1mL 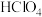 、20mL KI溶液,在避光处放置3min,加入50mL水,用淀粉作指示剂,用
、20mL KI溶液,在避光处放置3min,加入50mL水,用淀粉作指示剂,用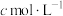 的
的 溶液滴定,平行三次,平均消耗
溶液滴定,平行三次,平均消耗 溶液的体积为V mL(
溶液的体积为V mL( )
)
(1)仪器a的名称为___________ ,b中应盛放的最佳传热介质是___________ 。
(2)步骤Ⅰ中反应生成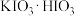 、
、 等,写出反应的化学方程式:
等,写出反应的化学方程式:___________ 。反应过程中,在烧瓶瓶颈或仪器a下口处可能会看到___________ (填物质名称)析出,其原因是___________ 。
(3)步骤Ⅱ“一系列操作”包括静置、___________ 、洗涤、干燥,其中洗涤所用较佳试剂为___________ (填“水”或“乙醇”)。
(4)碘酸钙粗晶纯度为___________ %(用含a、c、V的代数式表示),下列情况导致产品纯度测定结果偏低的是___________ (填字母)。
A.所配待测溶液中含有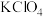 少量沉淀 B.定容时俯视读数
少量沉淀 B.定容时俯视读数
C.盛放 溶液的滴定管未润洗 D.滴定后俯视读数
溶液的滴定管未润洗 D.滴定后俯视读数
 ]为白色结晶性粉末,微溶于水,不溶于乙醇,主要用作防臭剂、药物和食品添加剂。某同学在实验室制备
]为白色结晶性粉末,微溶于水,不溶于乙醇,主要用作防臭剂、药物和食品添加剂。某同学在实验室制备 实验步骤如下:
实验步骤如下:Ⅰ.将一定质量的
 、
、 和45mL水加入圆底烧瓶中,再加入几滴盐酸,使溶液的pH≈1,控制温度在85℃回流大约1h;
和45mL水加入圆底烧瓶中,再加入几滴盐酸,使溶液的pH≈1,控制温度在85℃回流大约1h;Ⅱ.步骤Ⅰ反应完毕后,将烧瓶内的混合液倒入烧杯中,滴入KOH溶液调节pH=10,然后用滴管逐滴加入1
 的
的 溶液,至沉淀完全。经一系列操作,得到碘酸钙粗品;
溶液,至沉淀完全。经一系列操作,得到碘酸钙粗品;Ⅲ.碘酸钙粗品纯度:准确称取a g碘酸钙粗品于烧杯中,加入10mL
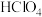 将其溶解,转移至250mL容量瓶中定容,移取25.00 mL溶液于锥形瓶中,再加入1mL
将其溶解,转移至250mL容量瓶中定容,移取25.00 mL溶液于锥形瓶中,再加入1mL 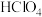 、20mL KI溶液,在避光处放置3min,加入50mL水,用淀粉作指示剂,用
、20mL KI溶液,在避光处放置3min,加入50mL水,用淀粉作指示剂,用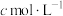 的
的 溶液滴定,平行三次,平均消耗
溶液滴定,平行三次,平均消耗 溶液的体积为V mL(
溶液的体积为V mL( )
)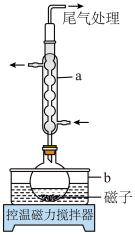
(1)仪器a的名称为
(2)步骤Ⅰ中反应生成
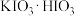 、
、 等,写出反应的化学方程式:
等,写出反应的化学方程式:(3)步骤Ⅱ“一系列操作”包括静置、
(4)碘酸钙粗晶纯度为
A.所配待测溶液中含有
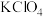 少量沉淀 B.定容时俯视读数
少量沉淀 B.定容时俯视读数C.盛放
 溶液的滴定管未润洗 D.滴定后俯视读数
溶液的滴定管未润洗 D.滴定后俯视读数
您最近一年使用:0次
7日内更新
|
176次组卷
|
3卷引用:2024届九师联盟高三下学期四月月考化学试卷
名校
解题方法
10 . 某课外小组探究食品添加剂 (焦亚硫酸钠)制备原理,实验操作如下:(已知:焦亚硫酸钠可用饱和亚硫酸氢钠溶液脱水制得)
(焦亚硫酸钠)制备原理,实验操作如下:(已知:焦亚硫酸钠可用饱和亚硫酸氢钠溶液脱水制得)
已知: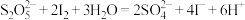 ;
;
 ,实验装置如下:
,实验装置如下:
(1)写出A中反应的化学方程式为______ 。装置 的作用是
的作用是______ 。
(2)第二步控制 中
中 ,若
,若 中溶质只有一种,
中溶质只有一种, 中反应的离子方程式是
中反应的离子方程式是______ 。
(3)第三步加热过程中若温度过高可能会生成 ,检验
,检验 固体是否变质的方法是
固体是否变质的方法是______ ,过滤操作用到的玻璃仪器有______ 。
(4)用于D处合理的装置是______ (填标号)。 :
:
①取 饮料于锥形瓶中,加入
饮料于锥形瓶中,加入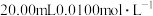 的
的 溶液,塞紧瓶塞充分反应。
溶液,塞紧瓶塞充分反应。
②打开瓶塞,将锥形瓶内液体调至接近中性,滴加 滴淀粉溶液做指示剂。用
滴淀粉溶液做指示剂。用 的
的 溶液滴定,滴定至终点时,消耗
溶液滴定,滴定至终点时,消耗 溶液
溶液 。滴定至终点的现象为:
。滴定至终点的现象为:______ 。饮料中残留的 为
为______  (已知
(已知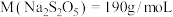 ;计算结果保留两位小数)。
;计算结果保留两位小数)。
 (焦亚硫酸钠)制备原理,实验操作如下:(已知:焦亚硫酸钠可用饱和亚硫酸氢钠溶液脱水制得)
(焦亚硫酸钠)制备原理,实验操作如下:(已知:焦亚硫酸钠可用饱和亚硫酸氢钠溶液脱水制得)实验步骤 | 实验操作 |
第一步 | 连接实验装置并检查装置气密性 |
第二步 |  、 、 、 、 中装入药品,加热 中装入药品,加热 中试管,通过 中试管,通过 数据采集器控制 数据采集器控制 中反应至 中反应至 时,停止加热,将 时,停止加热,将 中铜丝外移脱离浓硫酸 中铜丝外移脱离浓硫酸 |
第三步 | 将 中所得溶液转移至蒸发装置中,加热,结晶脱水、过滤、洗涤、干燥制得焦亚硫酸钠 中所得溶液转移至蒸发装置中,加热,结晶脱水、过滤、洗涤、干燥制得焦亚硫酸钠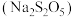 |
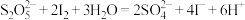 ;
; ,实验装置如下:
,实验装置如下: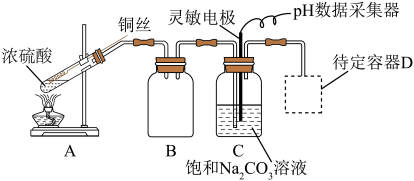
(1)写出A中反应的化学方程式为
 的作用是
的作用是(2)第二步控制
 中
中 ,若
,若 中溶质只有一种,
中溶质只有一种, 中反应的离子方程式是
中反应的离子方程式是(3)第三步加热过程中若温度过高可能会生成
 ,检验
,检验 固体是否变质的方法是
固体是否变质的方法是(4)用于D处合理的装置是
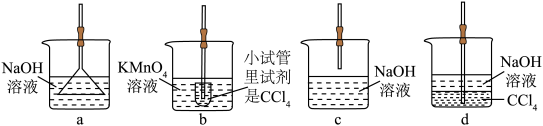
 :
:①取
 饮料于锥形瓶中,加入
饮料于锥形瓶中,加入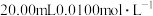 的
的 溶液,塞紧瓶塞充分反应。
溶液,塞紧瓶塞充分反应。②打开瓶塞,将锥形瓶内液体调至接近中性,滴加
 滴淀粉溶液做指示剂。用
滴淀粉溶液做指示剂。用 的
的 溶液滴定,滴定至终点时,消耗
溶液滴定,滴定至终点时,消耗 溶液
溶液 。滴定至终点的现象为:
。滴定至终点的现象为: 为
为 (已知
(已知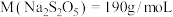 ;计算结果保留两位小数)。
;计算结果保留两位小数)。
您最近一年使用:0次



