1 . 某兴趣小组对FeSO4的一些性质进行探究实验。回答下列问题:
(1)在试管中加入少量FeSO4样品,加水溶解,滴加KSCN溶液,溶液逐渐变_____ 色,说明样品已变质。同学甲认为若要使变质的FeSO4溶液复原,可以向溶液中加入过量的Fe粉,发生反应的离子方程式为______________ 。
(2)已知FeSO4的分解产物中含有SO2和SO3。将纯净FeSO4和有关试剂放入如图所示的装置,打开K1和K2,缓缓通入N2,加热,实验后反应管中残留固体为红棕色粉末。________________ 。
②装置C中盛放的溶液为________ ;装置D中盛放的溶液为________ (填标号)。
A.品红 B.NaOH C.BaCl2 D.浓H2SO4
③盛有NaOH溶液的装置的作用是_____________ 。
④实验时装置D中除有气泡冒出外,还可观察到的实验现象为_____________ 。
(1)在试管中加入少量FeSO4样品,加水溶解,滴加KSCN溶液,溶液逐渐变
(2)已知FeSO4的分解产物中含有SO2和SO3。将纯净FeSO4和有关试剂放入如图所示的装置,打开K1和K2,缓缓通入N2,加热,实验后反应管中残留固体为红棕色粉末。

②装置C中盛放的溶液为
A.品红 B.NaOH C.BaCl2 D.浓H2SO4
③盛有NaOH溶液的装置的作用是
④实验时装置D中除有气泡冒出外,还可观察到的实验现象为
您最近一年使用:0次
2 . 过氧化钠常作漂白剂、杀菌剂、消毒剂,保存不当容易吸收空气中 而变质。
而变质。
(1)某课外活动小组欲探究某过氧化钠样品是否已经变质,取少量样品,溶解,加入___________ 溶液,若充分振荡后有白色沉淀,则证明 已经变质。
已经变质。
(2)该课外活动小组为了粗略测定过氧化钠的纯度,他们称取 样品,并设计用如图装置来测定过氧化钠的质量分数。
样品,并设计用如图装置来测定过氧化钠的质量分数。___________ (填“是”或“否”);请写出 中发生的化学反应方程式
中发生的化学反应方程式___________ 。
②实验结束时,读取实验中生成气体的体积时,不合理的是___________ (填字母)。
A.直接读取气体体积,不需冷却到室温
B.上下移动量筒,使得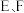 中液面高度相同
中液面高度相同
C.视线与凹液面的最低点相平读取量筒中水的体积
③读出量筒内水的体积后,折算成氧气的质量为 ,则样品中过氧化钠的质量分数为
,则样品中过氧化钠的质量分数为___________ (用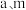 表示)。
表示)。
④实验完成后,E到F之间导管内残留水会使测量结果___________ (填“偏大”“偏小”或“不影响”)。
 而变质。
而变质。(1)某课外活动小组欲探究某过氧化钠样品是否已经变质,取少量样品,溶解,加入
 已经变质。
已经变质。(2)该课外活动小组为了粗略测定过氧化钠的纯度,他们称取
 样品,并设计用如图装置来测定过氧化钠的质量分数。
样品,并设计用如图装置来测定过氧化钠的质量分数。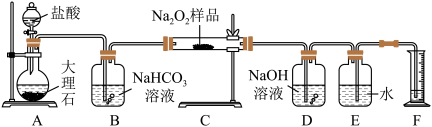
 中发生的化学反应方程式
中发生的化学反应方程式②实验结束时,读取实验中生成气体的体积时,不合理的是
A.直接读取气体体积,不需冷却到室温
B.上下移动量筒,使得
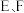 中液面高度相同
中液面高度相同C.视线与凹液面的最低点相平读取量筒中水的体积
③读出量筒内水的体积后,折算成氧气的质量为
 ,则样品中过氧化钠的质量分数为
,则样品中过氧化钠的质量分数为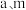 表示)。
表示)。④实验完成后,E到F之间导管内残留水会使测量结果
您最近一年使用:0次
3 . 下列实验方案设计、现象和结论都正确的是
| 选项 | 目的 | 方案设计 | 现象和结论 |
| A | 探究溴乙烷消去反应的产物是乙烯 | 取溴乙烷,加入乙醇、氢氧化钠固体,加热,将产生的气体通入 溶液中 溶液中 | 若 溶液褪色,则溴乙烷消去反应的产物为乙烯 溶液褪色,则溴乙烷消去反应的产物为乙烯 |
| B | 证明酸性:碳酸>苯酚 | 将盐酸与 混合产生的气体直接通入苯酚钠溶液 混合产生的气体直接通入苯酚钠溶液 | 若溶液变浑浊,这证明碳酸酸性大于苯酚 |
| C | 探究 固体样品是否变质 固体样品是否变质 | 取少量待测样品溶于蒸馏水,加入足量稀盐酸,再加入足量 溶液 溶液 | 若有白色沉淀产生,则样品已经变质 |
| D | 验证 有还原性 有还原性 | 向HCl酸化的 溶液中滴加 溶液中滴加 溶液,溶液褪色 溶液,溶液褪色 |  具有还原性 具有还原性 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
4 . 焦亚硫酸钠( )可用作食品添加剂,其实验室制备的装置如下图所示。回答下列问题:
)可用作食品添加剂,其实验室制备的装置如下图所示。回答下列问题:___________ ,其作用为___________ 。
(2)圆底烧瓶中发生反应的化学方程式为___________ 。
(3)焦亚硫酸钠易被氧化而变质,选用下列试剂设计实验方案,检验焦亚硫酸钠样品氧化变质的程度。
试剂:稀盐酸、稀 、稀
、稀 、
、 溶液、酸性
溶液、酸性 溶液、
溶液、 溶液
溶液
(4)某小组利用下列装置测定空气中 的含量。
的含量。___________ (填A或B)连接到导管末端。
②已知:该反应的化学方程式为: ,若空气流速为
,若空气流速为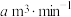 ,当观察到
,当观察到___________ 时,结束计时,测定耗时t min,假定样品中的 可被溶液充分吸收,该空气样品中
可被溶液充分吸收,该空气样品中 的含量是
的含量是___________ 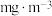 。
。
 )可用作食品添加剂,其实验室制备的装置如下图所示。回答下列问题:
)可用作食品添加剂,其实验室制备的装置如下图所示。回答下列问题: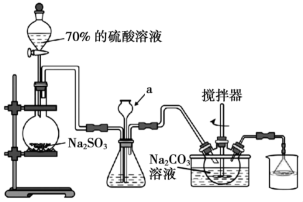
(2)圆底烧瓶中发生反应的化学方程式为
(3)焦亚硫酸钠易被氧化而变质,选用下列试剂设计实验方案,检验焦亚硫酸钠样品氧化变质的程度。
试剂:稀盐酸、稀
 、稀
、稀 、
、 溶液、酸性
溶液、酸性 溶液、
溶液、 溶液
溶液| 实验编号 | 实验步骤 | 现象 | 结论 |
| Ⅰ | 取少量样品,加入除氧蒸馏水,溶解完后平均分装到两支相同的小试管中 | 固体完全溶解得到无色溶液 | / |
| Ⅱ | 取实验I的溶液, | 出现白色沉淀 | 样品已氧化变质 |
| Ⅲ | 另取实验Ⅰ的溶液,加入酸性 溶液,充分振荡 溶液,充分振荡 | 溶液褪色 | 样品未完全氧化变质 |
 的含量。
的含量。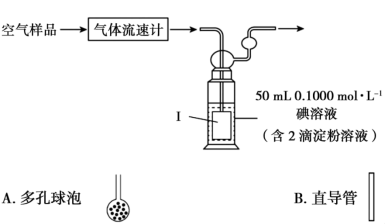
②已知:该反应的化学方程式为:
 ,若空气流速为
,若空气流速为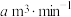 ,当观察到
,当观察到 可被溶液充分吸收,该空气样品中
可被溶液充分吸收,该空气样品中 的含量是
的含量是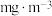 。
。
您最近一年使用:0次
名校
解题方法
5 .  俗称大苏打,是重要的化工原料。实验室用如下图所示的装置,模拟工业用含硫废水生产
俗称大苏打,是重要的化工原料。实验室用如下图所示的装置,模拟工业用含硫废水生产 。已知装置C中发生如下反应:
。已知装置C中发生如下反应:
①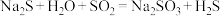 ②
② ③
③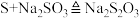
_______ 。
(2)仪器组装完成后,关闭所有活塞,向装置B中的长颈漏斗内注入液体至形成一段液柱,若装置中出现_______ 现象,则整个装置气密性良好。
(3)装置E中的溶液为_______ ,此处发生反应的离子方程式为(任写一个)_______ 。
(4)装置B可用于观察 的生成速率,其中的液体最好选择_______。
的生成速率,其中的液体最好选择_______。
(5) 固体长时间暴露在空气中会变质,若要检验某
固体长时间暴露在空气中会变质,若要检验某 样品是否变质,结合必要的离子方程式说明实验操作、现象和结论
样品是否变质,结合必要的离子方程式说明实验操作、现象和结论_______ 。
(6)实验前装置C溶液中含有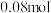
 和
和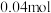
 ,反应结束后经一系列操作,得到纯净的
,反应结束后经一系列操作,得到纯净的 晶体19.11g,则
晶体19.11g,则 的产率为
的产率为_______ (保留2位有效数字)。(已知 的式量为248,
的式量为248,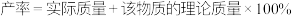 )
)
 俗称大苏打,是重要的化工原料。实验室用如下图所示的装置,模拟工业用含硫废水生产
俗称大苏打,是重要的化工原料。实验室用如下图所示的装置,模拟工业用含硫废水生产 。已知装置C中发生如下反应:
。已知装置C中发生如下反应:①
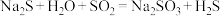 ②
② ③
③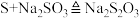
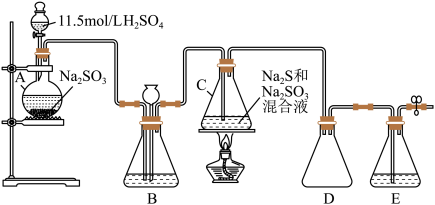
(2)仪器组装完成后,关闭所有活塞,向装置B中的长颈漏斗内注入液体至形成一段液柱,若装置中出现
(3)装置E中的溶液为
(4)装置B可用于观察
 的生成速率,其中的液体最好选择_______。
的生成速率,其中的液体最好选择_______。| A.水 | B.饱和食盐水 | C.饱和 溶液 溶液 | D.饱和 溶液 溶液 |
(5)
 固体长时间暴露在空气中会变质,若要检验某
固体长时间暴露在空气中会变质,若要检验某 样品是否变质,结合必要的离子方程式说明实验操作、现象和结论
样品是否变质,结合必要的离子方程式说明实验操作、现象和结论(6)实验前装置C溶液中含有
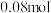
 和
和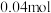
 ,反应结束后经一系列操作,得到纯净的
,反应结束后经一系列操作,得到纯净的 晶体19.11g,则
晶体19.11g,则 的产率为
的产率为 的式量为248,
的式量为248,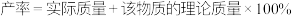 )
)
您最近一年使用:0次
名校
6 . 下列关于物质的除杂、鉴别、检验的方法中错误的是
A.除去 溶液中 溶液中 的方法是往溶液中缓缓通入氧气 的方法是往溶液中缓缓通入氧气 |
B. 与溴蒸气的鉴别可以用水、 与溴蒸气的鉴别可以用水、 溶液或 溶液或 ,但不能用湿润的碘化钾淀粉试纸 ,但不能用湿润的碘化钾淀粉试纸 |
C.检验 是否变质,可取少量样品溶解并滴加 是否变质,可取少量样品溶解并滴加 溶液,观察溶液是否褪色 溶液,观察溶液是否褪色 |
D.检验 溶液是否变质,可取少量样品于试管中并滴加KSCN,观察溶液是否变红 溶液是否变质,可取少量样品于试管中并滴加KSCN,观察溶液是否变红 |
您最近一年使用:0次
名校
解题方法
7 . 工业上以黄铁矿(主要成分 )为原料生产硫酸,并将产出的炉渣和尾气进行资源综合利用,减轻对环境的污染,其中一种流程如图所示:
)为原料生产硫酸,并将产出的炉渣和尾气进行资源综合利用,减轻对环境的污染,其中一种流程如图所示: 与
与 反应生成沉淀,与盐酸反应生成
反应生成沉淀,与盐酸反应生成 。
。
回答下列问题:
(1)煅烧黄铁矿进行粉碎处理的目的是___________ 。
(2)煅烧过程中主要发生的反应为___________ ,将该反应生成的 通入酸性高锰酸钾溶液中,可观察到酸性高锰酸钾溶液褪色,,发生该反应的离子方程式为
通入酸性高锰酸钾溶液中,可观察到酸性高锰酸钾溶液褪色,,发生该反应的离子方程式为___________ 。
(3)“吸收1”中试剂 是
是___________ 。
(4)“吸收2”后得到 溶液,加热后得
溶液,加热后得 和水,写出加热反应的化学方程式
和水,写出加热反应的化学方程式___________ 。
(5) 在保存过程中易变质生成
在保存过程中易变质生成 。欲检验
。欲检验 是否变质的具体实验操作方法为:
是否变质的具体实验操作方法为:___________ 。
(6) 纯度测定:取
纯度测定:取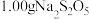 样品溶于水配成
样品溶于水配成 溶液,取
溶液,取 该溶液,向其滴加0.05mol/L碘水10mL,恰好反应完,反应的离子方程式为
该溶液,向其滴加0.05mol/L碘水10mL,恰好反应完,反应的离子方程式为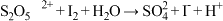 (未配平):样品中
(未配平):样品中 的质量分数为
的质量分数为___________ (已知其它杂质不反应)。
 )为原料生产硫酸,并将产出的炉渣和尾气进行资源综合利用,减轻对环境的污染,其中一种流程如图所示:
)为原料生产硫酸,并将产出的炉渣和尾气进行资源综合利用,减轻对环境的污染,其中一种流程如图所示: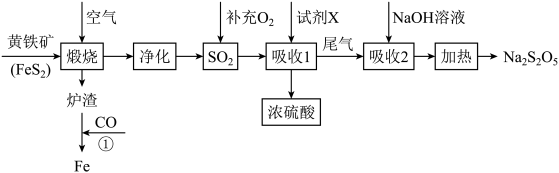
 与
与 反应生成沉淀,与盐酸反应生成
反应生成沉淀,与盐酸反应生成 。
。回答下列问题:
(1)煅烧黄铁矿进行粉碎处理的目的是
(2)煅烧过程中主要发生的反应为
 通入酸性高锰酸钾溶液中,可观察到酸性高锰酸钾溶液褪色,,发生该反应的离子方程式为
通入酸性高锰酸钾溶液中,可观察到酸性高锰酸钾溶液褪色,,发生该反应的离子方程式为(3)“吸收1”中试剂
 是
是(4)“吸收2”后得到
 溶液,加热后得
溶液,加热后得 和水,写出加热反应的化学方程式
和水,写出加热反应的化学方程式(5)
 在保存过程中易变质生成
在保存过程中易变质生成 。欲检验
。欲检验 是否变质的具体实验操作方法为:
是否变质的具体实验操作方法为:(6)
 纯度测定:取
纯度测定:取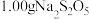 样品溶于水配成
样品溶于水配成 溶液,取
溶液,取 该溶液,向其滴加0.05mol/L碘水10mL,恰好反应完,反应的离子方程式为
该溶液,向其滴加0.05mol/L碘水10mL,恰好反应完,反应的离子方程式为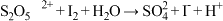 (未配平):样品中
(未配平):样品中 的质量分数为
的质量分数为
您最近一年使用:0次
2024-05-04更新
|
234次组卷
|
2卷引用:广东省惠州市第一中学2023-2024学年高一下学期4月月考化学试卷
解题方法
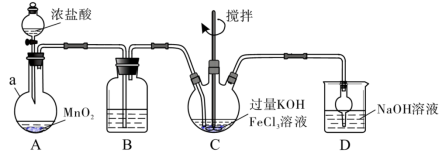
8 . 高铁酸盐是优良的多功能水处理剂。K2FeO4为紫色固体,可溶于水,微溶于浓KOH溶液,难溶于有机物;在0~5℃、强碱性溶液中比较稳定,在酸性、中性溶液中易分解放出O2.某实验小组制备高铁酸钾(K2FeO4)并测定产品纯度。回答下列问题:
Ⅰ.制备K2FeO4
装置如下图所示,夹持、加热等装置略。___________ ,装置B中除杂质所用试剂是___________ ,装置D的作用是___________ 。
(2)A中发生反应的离子方程式为___________ 。
(3)C中反应为放热反应,而反应温度须控制在0~5℃,反应中KOH必须过量的原因是___________ 。
(4)写出C中总反应的离子方程式:___________ 。C中混合物经重结晶、有机物洗涤纯化、真空干燥,得到高铁酸钾晶体。
Ⅱ.K2FeO4产品纯度的测定
准确称取1.00 g制得的晶体,配成250 mL溶液,准确量取25.00 mL K2FeO4溶液放入锥形瓶,加入足量CrCl3和NaOH溶液,振荡,再加入稀硫酸酸化后得Fe3+和Cr2O ,滴入几滴二苯胺磺酸钠作指示剂,用0.0500 mol/L(NH4)2Fe(SO4)2标准溶液滴定至终点(溶液显浅紫红色),平行测定三次,平均消耗(NH4)2Fe(SO4)2标准溶液28.00 mL。
,滴入几滴二苯胺磺酸钠作指示剂,用0.0500 mol/L(NH4)2Fe(SO4)2标准溶液滴定至终点(溶液显浅紫红色),平行测定三次,平均消耗(NH4)2Fe(SO4)2标准溶液28.00 mL。
(5)根据以上数据,样品中K2FeO4的质量分数为___________ 。若(NH4)2Fe(SO4)2标准溶液部分变质,会使测定结果___________ (填“偏高”“偏低”或“无影响”)。
Ⅰ.制备K2FeO4
装置如下图所示,夹持、加热等装置略。
(2)A中发生反应的离子方程式为
(3)C中反应为放热反应,而反应温度须控制在0~5℃,反应中KOH必须过量的原因是
(4)写出C中总反应的离子方程式:
Ⅱ.K2FeO4产品纯度的测定
准确称取1.00 g制得的晶体,配成250 mL溶液,准确量取25.00 mL K2FeO4溶液放入锥形瓶,加入足量CrCl3和NaOH溶液,振荡,再加入稀硫酸酸化后得Fe3+和Cr2O
 ,滴入几滴二苯胺磺酸钠作指示剂,用0.0500 mol/L(NH4)2Fe(SO4)2标准溶液滴定至终点(溶液显浅紫红色),平行测定三次,平均消耗(NH4)2Fe(SO4)2标准溶液28.00 mL。
,滴入几滴二苯胺磺酸钠作指示剂,用0.0500 mol/L(NH4)2Fe(SO4)2标准溶液滴定至终点(溶液显浅紫红色),平行测定三次,平均消耗(NH4)2Fe(SO4)2标准溶液28.00 mL。(5)根据以上数据,样品中K2FeO4的质量分数为
您最近一年使用:0次
解题方法
9 . 铝、铁、硅的单质及化合物在工业生产中具有广泛应用,工业上常用某矿石(主要成分有 、
、 、FeO、
、FeO、 等)来制备绿矾(
等)来制备绿矾( )和氧化铝,其工艺流程如图:
)和氧化铝,其工艺流程如图:
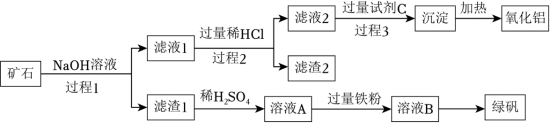
回答下列问题:
(1)过程1中能加快矿石与NaOH溶液反应速率的措施是___________ 。(答一条)
(2)滤渣1的主要成分是___________ ,举例说明滤渣2的用途___________ 。
(3)向溶液A中加入过量铁粉发生反应的离子方程式为:___________ 。
(4)写出由滤液1生成滤液2的离子方程式___________ 。
(5)用来配制试剂C的物质的电子式为:___________ 。
(6)绿矾晶体易被空气中的氧气氧化变质,宜密封保存放置。为探究制备的绿矾样品是否变质,具体的实验操作为___________ 。
 、
、 、FeO、
、FeO、 等)来制备绿矾(
等)来制备绿矾( )和氧化铝,其工艺流程如图:
)和氧化铝,其工艺流程如图:
回答下列问题:
(1)过程1中能加快矿石与NaOH溶液反应速率的措施是
(2)滤渣1的主要成分是
(3)向溶液A中加入过量铁粉发生反应的离子方程式为:
(4)写出由滤液1生成滤液2的离子方程式
(5)用来配制试剂C的物质的电子式为:
(6)绿矾晶体易被空气中的氧气氧化变质,宜密封保存放置。为探究制备的绿矾样品是否变质,具体的实验操作为
您最近一年使用:0次
名校
解题方法
10 . 三草酸合铁(Ⅲ)酸钾晶体 为翠绿色晶体,溶于水,难溶于乙醇,是一些有机反应的催化剂。实验室制备该晶体的实验步骤如下:
为翠绿色晶体,溶于水,难溶于乙醇,是一些有机反应的催化剂。实验室制备该晶体的实验步骤如下:
Ⅰ.制备
ⅰ.称取9.80g摩尔盐[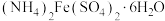 ,
,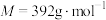 ]加入250mL水中,再加入10mL30%
]加入250mL水中,再加入10mL30% 溶液,搅拌,微热。
溶液,搅拌,微热。
ⅱ.继续加入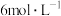 氨水至过量,加热,不断搅拌,煮沸后静置,倾去上层清液,抽滤得
氨水至过量,加热,不断搅拌,煮沸后静置,倾去上层清液,抽滤得 沉淀。
沉淀。
Ⅱ.制备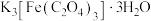
ⅲ.称取13.00gKOH和10.00g 加入盛有100mL水的烧杯中,加热使其完全溶解后,搅拌,将步骤ii制取的
加入盛有100mL水的烧杯中,加热使其完全溶解后,搅拌,将步骤ii制取的 加入此溶液中。加热,使
加入此溶液中。加热,使 溶解,溶液呈翠绿色。
溶解,溶液呈翠绿色。
ⅳ.过滤,将滤液浓缩。浓缩液转移至50mL烧杯中,后进行冷却结晶,过滤,用少量水和95%乙醇洗涤晶体,干燥,称量晶体质量为9.80g。
已知:二价铁在碱性介质中比酸性介质中更易氧化。请回答下列问题:
(1)步骤ⅰ中微热时,若温度过高,产生的影响是_____ 。
(2)摩尔盐相比硫酸亚铁不易变质,其原因是_____ 。
(3)步骤ⅱ中使用的抽滤装置如图所示,仪器a的作用是_____ 。
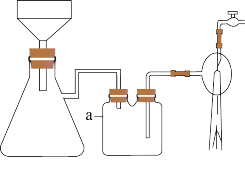
(4)步骤ⅲ中,反应的化学方程式为_____ 。
(5)测定产品中铁的含量。
①称量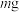 样品于锥形瓶中,溶解后用稀
样品于锥形瓶中,溶解后用稀 酸化,用
酸化,用 溶液滴定至终点,消耗
溶液滴定至终点,消耗 溶液
溶液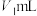 。滴定终点的现象是
。滴定终点的现象是_____ 。
②向上述溶液中加入过量锌粉,振荡至反应完全,过滤、洗涤,将滤液及洗涤液全部收集到锥形瓶中。加稀 酸化,用
酸化,用 溶液滴定至终点,消耗
溶液滴定至终点,消耗 溶液
溶液 。则产品中铁的质量分数的表达式为
。则产品中铁的质量分数的表达式为_____ 。
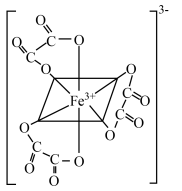
(6)经测定,配离子 具有如图所示的八面体结构,推测其中心原子
具有如图所示的八面体结构,推测其中心原子 的杂化方式为_____(填标号)。
的杂化方式为_____(填标号)。
 为翠绿色晶体,溶于水,难溶于乙醇,是一些有机反应的催化剂。实验室制备该晶体的实验步骤如下:
为翠绿色晶体,溶于水,难溶于乙醇,是一些有机反应的催化剂。实验室制备该晶体的实验步骤如下:Ⅰ.制备

ⅰ.称取9.80g摩尔盐[
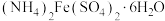 ,
,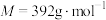 ]加入250mL水中,再加入10mL30%
]加入250mL水中,再加入10mL30% 溶液,搅拌,微热。
溶液,搅拌,微热。ⅱ.继续加入
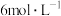 氨水至过量,加热,不断搅拌,煮沸后静置,倾去上层清液,抽滤得
氨水至过量,加热,不断搅拌,煮沸后静置,倾去上层清液,抽滤得 沉淀。
沉淀。Ⅱ.制备
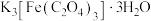
ⅲ.称取13.00gKOH和10.00g
 加入盛有100mL水的烧杯中,加热使其完全溶解后,搅拌,将步骤ii制取的
加入盛有100mL水的烧杯中,加热使其完全溶解后,搅拌,将步骤ii制取的 加入此溶液中。加热,使
加入此溶液中。加热,使 溶解,溶液呈翠绿色。
溶解,溶液呈翠绿色。ⅳ.过滤,将滤液浓缩。浓缩液转移至50mL烧杯中,后进行冷却结晶,过滤,用少量水和95%乙醇洗涤晶体,干燥,称量晶体质量为9.80g。
已知:二价铁在碱性介质中比酸性介质中更易氧化。请回答下列问题:
(1)步骤ⅰ中微热时,若温度过高,产生的影响是
(2)摩尔盐相比硫酸亚铁不易变质,其原因是
(3)步骤ⅱ中使用的抽滤装置如图所示,仪器a的作用是

(4)步骤ⅲ中,反应的化学方程式为
(5)测定产品中铁的含量。
①称量
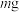 样品于锥形瓶中,溶解后用稀
样品于锥形瓶中,溶解后用稀 酸化,用
酸化,用 溶液滴定至终点,消耗
溶液滴定至终点,消耗 溶液
溶液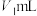 。滴定终点的现象是
。滴定终点的现象是②向上述溶液中加入过量锌粉,振荡至反应完全,过滤、洗涤,将滤液及洗涤液全部收集到锥形瓶中。加稀
 酸化,用
酸化,用 溶液滴定至终点,消耗
溶液滴定至终点,消耗 溶液
溶液 。则产品中铁的质量分数的表达式为
。则产品中铁的质量分数的表达式为(6)经测定,配离子
 具有如图所示的八面体结构,推测其中心原子
具有如图所示的八面体结构,推测其中心原子 的杂化方式为_____(填标号)。
的杂化方式为_____(填标号)。
A. | B. | C. | D. |
您最近一年使用:0次
2024-04-09更新
|
130次组卷
|
3卷引用:河北省沧州市泊头市八县联考2023-2024学年高三下学期3月月考化学试题



