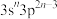名校
解题方法
1 . 某学习小组按如下实验流程进行碘的制取,甲、乙两种实验方案如下:
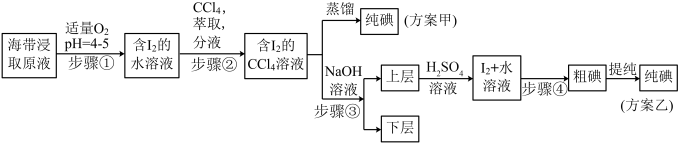
已知: ;酸性条件下,
;酸性条件下, 在水中的溶解度很小。
在水中的溶解度很小。
(1)步骤①中能代替 的最佳物质的电子式为
的最佳物质的电子式为________ 。
(2)步骤②中,萃取后分液漏斗内观察到的现象是________ 。
(3)下列有关步骤③的说法正确的是________(填序号)。
(4)方案乙中,上层液体中加入 溶液,反应的离子方程式为
溶液,反应的离子方程式为________ ,其中步骤④操作的名称是________ ;方案甲中采用蒸馏效果不佳,理由是________ 。

已知:
 ;酸性条件下,
;酸性条件下, 在水中的溶解度很小。
在水中的溶解度很小。(1)步骤①中能代替
 的最佳物质的电子式为
的最佳物质的电子式为(2)步骤②中,萃取后分液漏斗内观察到的现象是
(3)下列有关步骤③的说法正确的是________(填序号)。
| A.应控制NaOH溶液的浓度和体积 | B.将碘转化成离子进入水层 |
| C.主要目的是除去浸取原液中的有机杂质 | D.NaOH溶液可由乙醇代替 |
(4)方案乙中,上层液体中加入
 溶液,反应的离子方程式为
溶液,反应的离子方程式为
您最近一年使用:0次
名校
2 . 下列化学用语表达正确的是
A.HF的电子式: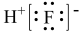 | B.HClO的结构式:H-Cl-O |
C.中子数为1的氢原子: | D. 原子的结构示意图: 原子的结构示意图: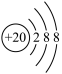 |
您最近一年使用:0次
3 . X、Y、Z、Q、T代表五种元素,相关信息如表所示:
请回答下列问题:
(1)X的元素符号为______ ,其基态原子的电子排布式为______ 。
(2)Y的元素名称为______ ,其基态原子的轨道表示式为______ 。
(3)Z的基态原子的价层电子的轨道表示式为______ ;
(4)Q其简单离子的结构示意图为______ 。
(5)T的基态原子的价层电子排布式为______ ;其单质在X的常见单质中燃烧的化学方程式为______ 。
元素 | 信息 |
X | 基态原子最外层电子数是其电子层数的3倍 |
Y | 基态原子的L层上有2个空轨道 |
Z | 基态原子的M层的p能级上有3个未成对电子 |
Q | 基态原子的价层电子排布式为 |
T | 正三价离子的3d能级为半充满状态 |
(1)X的元素符号为
(2)Y的元素名称为
(3)Z的基态原子的价层电子的轨道表示式为
(4)Q其简单离子的结构示意图为
(5)T的基态原子的价层电子排布式为
您最近一年使用:0次
名校
4 . 根据图中的反应路线及所给信息填空。

(1)A的结构简式是___________ ,名称是___________ 。
(2)①的反应类型是___________ 。
(3)反应③的化学方程式是___________ 。
(4)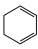 与Br2的CCl4溶液发生1,4-加成产物的结构简式是
与Br2的CCl4溶液发生1,4-加成产物的结构简式是___________ 。
(5)图为某药物中间体的结构示意图,试回答下列问题:
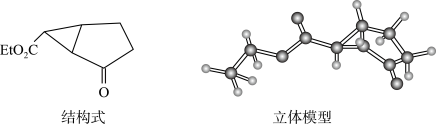
①观察结构式与立体模型,通过对比指出结构式中的“Et”表示___________ (用结构简式表示);该药物中间体分子的化学式为___________ 。
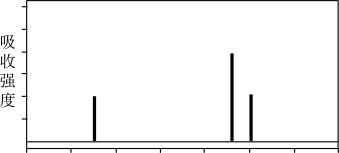
②现某种芳香族化合物与该药物中间体互为同分异构体,其模拟的核磁共振氢谱图如图所示,试写出该化合物的结构简式:___________ 。

(1)A的结构简式是
(2)①的反应类型是
(3)反应③的化学方程式是
(4)
 与Br2的CCl4溶液发生1,4-加成产物的结构简式是
与Br2的CCl4溶液发生1,4-加成产物的结构简式是(5)图为某药物中间体的结构示意图,试回答下列问题:

①观察结构式与立体模型,通过对比指出结构式中的“Et”表示
②现某种芳香族化合物与该药物中间体互为同分异构体,其模拟的核磁共振氢谱图如图所示,试写出该化合物的结构简式:

您最近一年使用:0次
5 . 下列表达方式正确的是
| A.29Cu 的价电子排布式:3d94s2 |
B.p-p σ键电子云轮廓图 |
C.基态碳原子的价电子的轨道表示式为 |
D.N2 的电子式: |
您最近一年使用:0次
解题方法
6 . 下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,用化学用语回答下列问题:
(1)由表中②、④两种元素的原子按1:2组成的常见化合物的电子式___________ 。
(2)②、③、④三种元素的气态氢化物的稳定性由强到弱的顺序是___________ (填物质化学式)。
(3)②、③、⑦、⑧四种元素的最高价氧化物对应水化物的酸性由强到弱的顺序是___________ (填物质化学式)。
(4)⑤的最高价氧化物对应水化物的化学式为___________ ,该物质的水溶液与元素⑥的单质反应的化学方程式为___________ 。
(5)化学反应 的能量变化如图所示。
的能量变化如图所示。

①该反应属于___________ (填“吸热”或“放热”)反应。
②一定量的 和
和 充分反应生成1mol
充分反应生成1mol 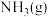 时,能量变化情况为
时,能量变化情况为___________ 。
③已知断开1mol N-H键、1mol 键分别需要吸收的能量为391kJ、946kJ。1mol
键分别需要吸收的能量为391kJ、946kJ。1mol  中的化学键断裂要吸收
中的化学键断裂要吸收___________ kJ能量。
| 族 周期 | ⅠA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
(2)②、③、④三种元素的气态氢化物的稳定性由强到弱的顺序是
(3)②、③、⑦、⑧四种元素的最高价氧化物对应水化物的酸性由强到弱的顺序是
(4)⑤的最高价氧化物对应水化物的化学式为
(5)化学反应
 的能量变化如图所示。
的能量变化如图所示。
①该反应属于
②一定量的
 和
和 充分反应生成1mol
充分反应生成1mol 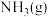 时,能量变化情况为
时,能量变化情况为③已知断开1mol N-H键、1mol
 键分别需要吸收的能量为391kJ、946kJ。1mol
键分别需要吸收的能量为391kJ、946kJ。1mol  中的化学键断裂要吸收
中的化学键断裂要吸收
您最近一年使用:0次
解题方法
7 . 利用“铁脱络-化学沉淀法”回收电镀废水中镍的流程如图。
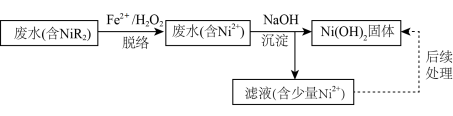
已知:①废水中镍主要以NiR2络合物形式存在,其在水溶液中存在平衡:NiR2(aq) Ni2+(aq)+2R-(aq,有机配体) K=1.6×10-14。
Ni2+(aq)+2R-(aq,有机配体) K=1.6×10-14。
②常温下,Ksp[Fe(OH)3]=1×10-39,Ksp[Ni(OH)2]=1.6×10-15。
③“脱络”(指NiR2转化成Ni2+过程中,反应历程如下:
i.Fe2++H2O2=Fe3++OH-+•OH
ii.R-+•OH=OH-+•R
iii.H2O2+2•OH=O2↑+2H2O
(1)•OH的电子式为________ ,其中氧元素的化合价为________ 价。
(2)①根据•OH与H2O2的反应历程,分析“脱络”时加入的Fe2+的作用机制:________ 。
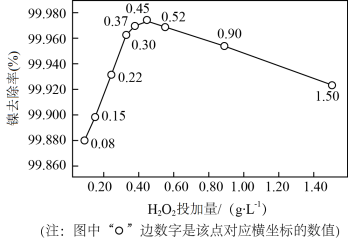
②实验测得H2O2加入量对溶液中镍回收率的影响如图所示.由图可知,当加入H2O2的量为________ g•L-1时,镍回收效果最好。
(3)常温下,若“脱络”后的废水中c(Ni2+)=0.01mol•L-1,“沉淀”时先加入NaOH至溶液的pH=________ ,使Fe3+恰好沉淀完全(Fe3+浓度为10-6mol•L-1,忽略溶液体积变化),此时________ (填“有”或“无”)Ni(OH)2沉淀生成。
(4)取100mL某电镀废水利用上述流程回收镍,得到2.325gNi(OH)2沉淀,经计算该步骤中Ni2+的回收率为99.97%;Ni(OH)2沉淀再经稀硫酸溶解、_______ 、过滤,得到NiSO4•7H2O固体的质量为6.744g。试计算100mL该电镀废水中镍转化成NiSO4•7H2O的总回收率:_______ (保留四位有效数字)。

已知:①废水中镍主要以NiR2络合物形式存在,其在水溶液中存在平衡:NiR2(aq)
 Ni2+(aq)+2R-(aq,有机配体) K=1.6×10-14。
Ni2+(aq)+2R-(aq,有机配体) K=1.6×10-14。②常温下,Ksp[Fe(OH)3]=1×10-39,Ksp[Ni(OH)2]=1.6×10-15。
③“脱络”(指NiR2转化成Ni2+过程中,反应历程如下:
i.Fe2++H2O2=Fe3++OH-+•OH
ii.R-+•OH=OH-+•R
iii.H2O2+2•OH=O2↑+2H2O
(1)•OH的电子式为
(2)①根据•OH与H2O2的反应历程,分析“脱络”时加入的Fe2+的作用机制:
②实验测得H2O2加入量对溶液中镍回收率的影响如图所示.由图可知,当加入H2O2的量为

(3)常温下,若“脱络”后的废水中c(Ni2+)=0.01mol•L-1,“沉淀”时先加入NaOH至溶液的pH=
(4)取100mL某电镀废水利用上述流程回收镍,得到2.325gNi(OH)2沉淀,经计算该步骤中Ni2+的回收率为99.97%;Ni(OH)2沉淀再经稀硫酸溶解、
您最近一年使用:0次
名校
解题方法
8 . 尿素[ ]是一种高效化肥,也是一种化工原料。反应
]是一种高效化肥,也是一种化工原料。反应 可用于尿素的制备。下列有关说法正确的是
可用于尿素的制备。下列有关说法正确的是
 ]是一种高效化肥,也是一种化工原料。反应
]是一种高效化肥,也是一种化工原料。反应 可用于尿素的制备。下列有关说法正确的是
可用于尿素的制备。下列有关说法正确的是| A.该反应是氧化还原反应 |
B. 分子的电子式: 分子的电子式: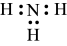 |
C. 分子的比例模型(空间填充模型): 分子的比例模型(空间填充模型): |
| D.尿素分子中含非极性共价键 |
您最近一年使用:0次
2023-06-10更新
|
137次组卷
|
2卷引用:广东省2022届高三下学期模拟押题(二)化学试题
解题方法
9 . 下列表示不正确的是
A. 的电子式: 的电子式: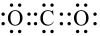 | B.丁烷的球棍模型 |
C.乙烯的结构简式 | D.原子核内有8个中子的碳原子 |
您最近一年使用:0次
解题方法
10 . 次磷酸钠( )是一种较理想的还原剂,主要用于化学镀、电镀、有机合成工业、食品加工和保鲜、工程塑料稳定剂等方面。一般制备方法是将白磷(
)是一种较理想的还原剂,主要用于化学镀、电镀、有机合成工业、食品加工和保鲜、工程塑料稳定剂等方面。一般制备方法是将白磷( )和过量烧碱溶液混合、加热,生成次磷酸钠和
)和过量烧碱溶液混合、加热,生成次磷酸钠和 ,
, 一种无色、有毒且能自燃的气体,有强还原性。实验装置如图所示:
一种无色、有毒且能自燃的气体,有强还原性。实验装置如图所示:

(1)仪器a的名称为_____ ,b装置的作用是_____ ,d装置的作用是_____ 。
(2)实验开始时,首先要打开K1,通入一段时间 ,其目的是
,其目的是_____ ,为尽可能避免 造成的空气污染,拆卸装置前还要进行的一项操作是
造成的空气污染,拆卸装置前还要进行的一项操作是_____ 。
(3)装置a中发生反应的离子方程式为_____ 。
(4)为了尽可能避免 造成的空气污染,d中用酸性
造成的空气污染,d中用酸性 溶液吸收尾气,已知
溶液吸收尾气,已知 被氧化成磷酸(
被氧化成磷酸( ),则d中发生反应的离子方程式为
),则d中发生反应的离子方程式为_____ 。
(5) 与足量氢氧化钠反应生成的盐是
与足量氢氧化钠反应生成的盐是 ,写出
,写出 在水中的电离方程式
在水中的电离方程式_____ 。
(6) 电子式
电子式_____ 。
 )是一种较理想的还原剂,主要用于化学镀、电镀、有机合成工业、食品加工和保鲜、工程塑料稳定剂等方面。一般制备方法是将白磷(
)是一种较理想的还原剂,主要用于化学镀、电镀、有机合成工业、食品加工和保鲜、工程塑料稳定剂等方面。一般制备方法是将白磷( )和过量烧碱溶液混合、加热,生成次磷酸钠和
)和过量烧碱溶液混合、加热,生成次磷酸钠和 ,
, 一种无色、有毒且能自燃的气体,有强还原性。实验装置如图所示:
一种无色、有毒且能自燃的气体,有强还原性。实验装置如图所示:
(1)仪器a的名称为
(2)实验开始时,首先要打开K1,通入一段时间
 ,其目的是
,其目的是 造成的空气污染,拆卸装置前还要进行的一项操作是
造成的空气污染,拆卸装置前还要进行的一项操作是(3)装置a中发生反应的离子方程式为
(4)为了尽可能避免
 造成的空气污染,d中用酸性
造成的空气污染,d中用酸性 溶液吸收尾气,已知
溶液吸收尾气,已知 被氧化成磷酸(
被氧化成磷酸( ),则d中发生反应的离子方程式为
),则d中发生反应的离子方程式为(5)
 与足量氢氧化钠反应生成的盐是
与足量氢氧化钠反应生成的盐是 ,写出
,写出 在水中的电离方程式
在水中的电离方程式(6)
 电子式
电子式
您最近一年使用:0次