2021高三·全国·专题练习
1 . 0.2 mol Cl2溶于等体积水中,转移电子数为0.2NA___
您最近一年使用:0次
2021高三·全国·专题练习
解题方法
2 . 50 mL 12 mol·L-1盐酸与足量MnO2共热, 转移的电子数为0.3NA___
您最近一年使用:0次
2021-03-18更新
|
839次组卷
|
6卷引用:小题03 阿伏加德罗常数NA(根据计算类型分类)——备战2021年高考化学经典小题考前必刷(全国通用)
(已下线)小题03 阿伏加德罗常数NA(根据计算类型分类)——备战2021年高考化学经典小题考前必刷(全国通用)(已下线)专题01 物质的量 气体摩尔体积(热点讲义)-2022届高考化学一轮复习热点题型归纳与变式训练(已下线)微专题01 “破解七陷阱”突破NA-备战2022年高考化学考点微专题(已下线)微专题02 以物质的量为中心的计算-备战2022年高考化学考点微专题(已下线)专题02 有关阿伏加德罗常数的计算-【微专题·大素养】备战2022年高考化学讲透提分要点(已下线)专题03 突破阿伏加德罗常数正误判断(选择题)-2023年高考化学毕业班二轮热点题型归纳与变式演练(全国通用)
3 . 物质的量是高中化学常用的物理量,请完成以下问题:
(1)在9.5g某二价金属的氯化物中含有 ,该金属元素的相对原子质量为
,该金属元素的相对原子质量为_______ 。
(2)在80g密度为 的硫酸铁溶液中,含有
的硫酸铁溶液中,含有 离子,则此溶液中
离子,则此溶液中 的物质的量浓度为
的物质的量浓度为_______ mol/L。
(3)实验室中需要0.2mol/L的CuSO4溶液480mL,现配制该溶液,应选用容量瓶的规格是_______ ml,用托盘天平称取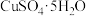 晶体的质量是
晶体的质量是_______ g。
(4)若ag某气体中含有的分子数为b,则c g该气体在标准状况下的体积是_______ (用 式子表示。)
式子表示。)
(5)我国古代四大发明之一的黑火药,是由硫黄粉,硝酸钾和木炭粉按一定比例混合而成的,爆炸时的反应为: (未配平),该反应的氧化剂是
(未配平),该反应的氧化剂是_______ ,当有2mol气体生成时,反应转移的电子数为_______ 。
(1)在9.5g某二价金属的氯化物中含有
 ,该金属元素的相对原子质量为
,该金属元素的相对原子质量为(2)在80g密度为
 的硫酸铁溶液中,含有
的硫酸铁溶液中,含有 离子,则此溶液中
离子,则此溶液中 的物质的量浓度为
的物质的量浓度为(3)实验室中需要0.2mol/L的CuSO4溶液480mL,现配制该溶液,应选用容量瓶的规格是
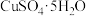 晶体的质量是
晶体的质量是(4)若ag某气体中含有的分子数为b,则c g该气体在标准状况下的体积是
 式子表示。)
式子表示。)(5)我国古代四大发明之一的黑火药,是由硫黄粉,硝酸钾和木炭粉按一定比例混合而成的,爆炸时的反应为:
 (未配平),该反应的氧化剂是
(未配平),该反应的氧化剂是
您最近一年使用:0次
解题方法
4 . 将Fe和Al按一定的质量比组成合金。
(1)取一定量的该合金,向其中加入足量NaOH溶液,生成气体nL(标准状况),则反应的离子方程式是___ ,该反应在转移电子数___________ NA,合金中Al的物质的量是___________ 。
(2)另取相同质量的该合金,向其中加入足量稀硫酸,固体全部溶解,生成气体m L(标准状况),则反应中转移电子的物质的量是____ mol,合金中Fe的质量是___________ 。
(1)取一定量的该合金,向其中加入足量NaOH溶液,生成气体nL(标准状况),则反应的离子方程式是
(2)另取相同质量的该合金,向其中加入足量稀硫酸,固体全部溶解,生成气体m L(标准状况),则反应中转移电子的物质的量是
您最近一年使用:0次
名校
解题方法
5 . H2O2作为一种绿色消毒剂,在公共卫生事业中发挥了重要的作用。回答问题:
(1)H2O2中氧元素的化合价为________ 价。
(2)H2O2的强氧化性使其对大多数致病菌和病毒具有消杀功能。用3%医用H2O2 对传染病房喷洒消毒时,地板上有气泡冒出,该气体是______ 。
(3)纯H2O2 可作为民用驱雹火箭推进剂。在火箭喷口铂网催化下,H2O2 剧烈分解:2H2O2 2H2O+O2↑,放出大量气体,驱动火箭升空。每消耗34gH2O2,理论上生成标准状况的O2
2H2O+O2↑,放出大量气体,驱动火箭升空。每消耗34gH2O2,理论上生成标准状况的O2_____ L,转移电子______ mol。
(4)漂白粉也具有杀菌、消毒的作用,漂白粉的有效成分是_________ 。
(1)H2O2中氧元素的化合价为
(2)H2O2的强氧化性使其对大多数致病菌和病毒具有消杀功能。用3%医用H2O2 对传染病房喷洒消毒时,地板上有气泡冒出,该气体是
(3)纯H2O2 可作为民用驱雹火箭推进剂。在火箭喷口铂网催化下,H2O2 剧烈分解:2H2O2
 2H2O+O2↑,放出大量气体,驱动火箭升空。每消耗34gH2O2,理论上生成标准状况的O2
2H2O+O2↑,放出大量气体,驱动火箭升空。每消耗34gH2O2,理论上生成标准状况的O2(4)漂白粉也具有杀菌、消毒的作用,漂白粉的有效成分是
您最近一年使用:0次
6 .  和浓盐酸在一定温度下反应会生成黄绿色的易爆气体二氧化氯,反应的化学方程式为
和浓盐酸在一定温度下反应会生成黄绿色的易爆气体二氧化氯,反应的化学方程式为 。设
。设 为阿伏加 德罗常数的值。
为阿伏加 德罗常数的值。
(1)浓盐酸在该反应中表现出来的性质为_________ 。
(2)将氯气通入某含氧酸盐的溶液中,能发生反应 ,则反应物
,则反应物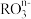 中R元素的化合价是
中R元素的化合价是_________ ;当反应消耗0.25mol氯气时,转移电子的数目为_______ 。
(3)根据世界环保联盟的要求, 将逐渐取代
将逐渐取代 成为自来水的消毒剂。工业上常用
成为自来水的消毒剂。工业上常用 溶液和
溶液和 溶液混合并加入
溶液混合并加入 酸化制得
酸化制得 ,且产物中有
,且产物中有 ,则在该反应中,
,则在该反应中, 和
和 的物质的量之比为
的物质的量之比为______ 。
 和浓盐酸在一定温度下反应会生成黄绿色的易爆气体二氧化氯,反应的化学方程式为
和浓盐酸在一定温度下反应会生成黄绿色的易爆气体二氧化氯,反应的化学方程式为 。设
。设 为阿伏加 德罗常数的值。
为阿伏加 德罗常数的值。(1)浓盐酸在该反应中表现出来的性质为
(2)将氯气通入某含氧酸盐的溶液中,能发生反应
 ,则反应物
,则反应物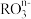 中R元素的化合价是
中R元素的化合价是(3)根据世界环保联盟的要求,
 将逐渐取代
将逐渐取代 成为自来水的消毒剂。工业上常用
成为自来水的消毒剂。工业上常用 溶液和
溶液和 溶液混合并加入
溶液混合并加入 酸化制得
酸化制得 ,且产物中有
,且产物中有 ,则在该反应中,
,则在该反应中, 和
和 的物质的量之比为
的物质的量之比为
您最近一年使用:0次
2020-09-14更新
|
572次组卷
|
3卷引用:鲁科版(2019)高一必修第一册高效手册——第2章 元素与物质世界
鲁科版(2019)高一必修第一册高效手册——第2章 元素与物质世界高一必修第一册(苏教2019版)高效手册 专题3 从海水中获得的化学物质(已下线)专题突破卷01 化学计量?-2024年高考化学一轮复习考点通关卷(新教材新高考)
名校
解题方法
7 . 将一定量的Al、Mg合金加入到足量的40mL某浓度的盐酸中,充分反应后得到标准状况下的氢气896mL;若将等质量的该混合物加入到足量的NaOH溶液中,充分反应后得到标准状况下的氢气672mL。
(1)当合金与盐酸反应时,转移电子总物质的量为_____ mol;
(2)合金中Mg的质量为_____ g;
(3)合金的平均摩尔质量为_____ ;
(4)若向与盐酸反应后的溶液中缓慢加入100mL 1mol/L 的NaOH溶液,沉淀质量恰好达到的最大值,则加入盐酸的浓度为_____ mol/L
(1)当合金与盐酸反应时,转移电子总物质的量为
(2)合金中Mg的质量为
(3)合金的平均摩尔质量为
(4)若向与盐酸反应后的溶液中缓慢加入100mL 1mol/L 的NaOH溶液,沉淀质量恰好达到的最大值,则加入盐酸的浓度为
您最近一年使用:0次
2020-05-19更新
|
146次组卷
|
2卷引用:四川省自贡市田家炳中学2019-2020学年高一下学期开学考试化学试题
8 . 完成下列填空:
(1)与标准状况下4.48LCO2中所含氧原子数目相同的水的质量是__ g;
(2)VLFe2(SO4)3溶液中含Fe3+mg,则溶液中SO42-的物质的量浓度为__ mol/L;
(3)氧化铜在高温下发生分解反应:4CuO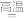 2Cu2O+O2↑,若反应过程中生成1molO2分子,则转移电子数为
2Cu2O+O2↑,若反应过程中生成1molO2分子,则转移电子数为__ 。(阿伏加 德罗常数为NA)。
(4)在Fe+4HNO3(稀)=Fe(NO3)3+NO↑+2H2O的反应中,HNO3表现了__ 性和__ 性,则56gFe参加反应时,被还原的HNO3为__ g。
(1)与标准状况下4.48LCO2中所含氧原子数目相同的水的质量是
(2)VLFe2(SO4)3溶液中含Fe3+mg,则溶液中SO42-的物质的量浓度为
(3)氧化铜在高温下发生分解反应:4CuO
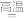 2Cu2O+O2↑,若反应过程中生成1molO2分子,则转移电子数为
2Cu2O+O2↑,若反应过程中生成1molO2分子,则转移电子数为(4)在Fe+4HNO3(稀)=Fe(NO3)3+NO↑+2H2O的反应中,HNO3表现了
您最近一年使用:0次
9 . 判断正误
1.2 g D216O中含有的质子数、中子数均为NA_______
2.过氧化钠与水反应时,生成0.1 mol氧气转移的电子数为0.2NA_______
3.1.0 mol CH4与Cl2在光照下反应生成的CH3Cl分子数为1.0NA_______
4.标准状况下,5.6 L NO和5.6 L O2组成的混合气体中所含原子数为NA_______
5.0.1 mol钠和O2在一定条件下反应完全生成Na2O和Na2O2混合物时,失去电子数为0.1NA_______
6.14 g乙烯和丙烯混合气体中的氢原子数为2NA_______
7.在1L 0.1mol·L﹣1碳酸钠溶液中,阴离子总数大于0.1NA_______
8.高温下,16.8 g Fe与足量水蒸气完全反应失去电子数为0.8 NA_______
9.标准状况下,氢氧燃料电池正极消耗22.4 L气体时,电路中通过的电子数目为4NA_______
10.常温常压下 ,1 L液态水中含有的H+数目为10-7NA_______
11.一定条件下Fe粉与足量的浓硫酸反应,转移电子数为3 NA_______
12.标准状况下,2.24 L CCl4含有的共价键数为0.4NA_______
13.标况下,22.4L己烷的分子个数为NA_______
14.含1 mol H2SO4的浓硫酸与足量Zn反应转移的电子总数为2NA_______
15.在1L 0.1mol·L﹣1氯化铵溶液中, 和NH3·H2O的个数之和为NA
和NH3·H2O的个数之和为NA _____
1.2 g D216O中含有的质子数、中子数均为NA
2.过氧化钠与水反应时,生成0.1 mol氧气转移的电子数为0.2NA
3.1.0 mol CH4与Cl2在光照下反应生成的CH3Cl分子数为1.0NA
4.标准状况下,5.6 L NO和5.6 L O2组成的混合气体中所含原子数为NA
5.0.1 mol钠和O2在一定条件下反应完全生成Na2O和Na2O2混合物时,失去电子数为0.1NA
6.14 g乙烯和丙烯混合气体中的氢原子数为2NA
7.在1L 0.1mol·L﹣1碳酸钠溶液中,阴离子总数大于0.1NA
8.高温下,16.8 g Fe与足量水蒸气完全反应失去电子数为0.8 NA
9.标准状况下,氢氧燃料电池正极消耗22.4 L气体时,电路中通过的电子数目为4NA
10.常温常压下 ,1 L液态水中含有的H+数目为10-7NA
11.一定条件下Fe粉与足量的浓硫酸反应,转移电子数为3 NA
12.标准状况下,2.24 L CCl4含有的共价键数为0.4NA
13.标况下,22.4L己烷的分子个数为NA
14.含1 mol H2SO4的浓硫酸与足量Zn反应转移的电子总数为2NA
15.在1L 0.1mol·L﹣1氯化铵溶液中,
 和NH3·H2O的个数之和为NA
和NH3·H2O的个数之和为NA
您最近一年使用:0次
10 . 某化学反应的反应物和产物如下,请按要求回答下列问题 :
:
(1)如果该化学方程式中S和 的系数分别是5和1,请配平化学方程式
的系数分别是5和1,请配平化学方程式 ,并用单线桥标出电子转移的方向和数目:
,并用单线桥标出电子转移的方向和数目:______ 。
(2)该反应中,发生氧化反应的物质是___ ,该反应中,发生还原反应的过程是____ 。
(3)反应中,1mol还原剂________  填“得到”或“失去”
填“得到”或“失去”
________ mol电子。
(4)若在标准状况下,反应产生336ml气体,则转移的电子数为________ 个。
(5)如果没有对该化学方程式中的某些化学计量数做限定,配平的化学计量数有许多组,原因是________________ 。
 :
: (1)如果该化学方程式中S和
 的系数分别是5和1,请配平化学方程式
的系数分别是5和1,请配平化学方程式 ,并用单线桥标出电子转移的方向和数目:
,并用单线桥标出电子转移的方向和数目:(2)该反应中,发生氧化反应的物质是
(3)反应中,1mol还原剂
 填“得到”或“失去”
填“得到”或“失去”
(4)若在标准状况下,反应产生336ml气体,则转移的电子数为
(5)如果没有对该化学方程式中的某些化学计量数做限定,配平的化学计量数有许多组,原因是
您最近一年使用:0次



