1 . (1)0.5 mol H2O的质量为____ ,含有______ 个原子。
(2)质量都是50 g的 HCl、CH4、N2三种气体中,原子数目最多的是气体是_______ ,在相同温度和相同压强条件下,密度最大的气体是__________ 。
(3)标准状况下11.2L,由CO和H2组成的混合气体的质量为7.2g,则混合气体的平均摩尔质量为_______ 。
(4)实验室需用浓硫酸配制100 mL 1 mol•L-1的稀硫酸。可供选用的仪器有:
①量筒;②烧杯;③胶头滴管,还必须需要的玻璃仪器有________________ (写仪器名称)。
(5)一定条件下,RO 和Cl2可发生如下反应:RO3n-+Cl2+H2O==RO42-+2Cl-+2H+ ,从而可知在RO
和Cl2可发生如下反应:RO3n-+Cl2+H2O==RO42-+2Cl-+2H+ ,从而可知在RO 中,元素R的化合价是
中,元素R的化合价是_____ ,当有标准状况下8.96L Cl2被消耗时,反应中共转移电子物质的量为____ mol。
(2)质量都是50 g的 HCl、CH4、N2三种气体中,原子数目最多的是气体是
(3)标准状况下11.2L,由CO和H2组成的混合气体的质量为7.2g,则混合气体的平均摩尔质量为
(4)实验室需用浓硫酸配制100 mL 1 mol•L-1的稀硫酸。可供选用的仪器有:
①量筒;②烧杯;③胶头滴管,还必须需要的玻璃仪器有
(5)一定条件下,RO
 和Cl2可发生如下反应:RO3n-+Cl2+H2O==RO42-+2Cl-+2H+ ,从而可知在RO
和Cl2可发生如下反应:RO3n-+Cl2+H2O==RO42-+2Cl-+2H+ ,从而可知在RO 中,元素R的化合价是
中,元素R的化合价是
您最近一年使用:0次
名校
2 . 火药是中国的“四大发明”之一,永远值得炎黄子孙骄傲,也永远会激励着我们去奋发图强。黑火药在发生爆炸时,发生如下的反应:2KNO3+3C+S===K2S+N2↑+3CO2↑。
(1)其中被还原的元素是________ ,被氧化的元素是_________ ,氧化剂是_________ ,还原剂是_________ ,氧化产物是_________ ,还原产物是__________ 。
(2)用双线桥 标出电子转移的方向和数目:2KNO3+ 3C+ S ═ K2S + N2↑+ 3CO2↑________ 。
(3)当0.1molCO2生成时,则转移的电子数 为___________ 个。
(1)其中被还原的元素是
(2)用
(3)当0.1molCO2生成时,则转移的
您最近一年使用:0次
2018-01-11更新
|
494次组卷
|
3卷引用:湖北省长阳中学2017-2018学年高一化学上学期期末考试题
名校
3 . 氮是生命物质的重要组成元素之一,以氮气为原料的合成氨工业可以实现大规模固氮,氨可用于生成氯化铵、硫酸铵等化学肥料。
(1)科学家已成功合成少量N4分子,N4和N2互为_____ ,NH3分子的空间构型为型______ 。
(2)叠氮化钠(NaN3)受撞击完全分解产生钠和氮气,故可应用于汽车安全气囊。若产生40.32L(标况下)氮气,至少需要叠氮酸钠_____ g,转移电子____ 个。
(3)检验铵态氮肥中铵根离子的实验方案是(补充写出步骤,现象):取样,溶于水_________________________________________________ 。
(4)等物质的量浓度的两溶液,pH大小为:氯化铵__________ 硫酸铵(选填>、=或< ,下同);铵根离子浓度相同的两溶液,两者的浓度大小关系为:氯化铵_____ 硫酸铵;
最新“人工固氮”的研究报道:常温常压、催化剂条件下, N2在催化剂表面与水发生反应:与水发生反应: 2N2(g)+6H2O(g) 4NH3(g)+3O2(g)-Q,(Q>0)
4NH3(g)+3O2(g)-Q,(Q>0)
(5)如果反应的平衡常数K值变小,该反应正反应速率_______ (选填增大、减小或不变,下同),逆反应速率_______ .
(6)若反应在恒容条件下进行,请用上述反应中的有关物理量来说明该反应已达到平衡状态_______ .
(7)下列能够提高氮气转化率的措施是:_____
A.适当升高温度 b.增加水的用量
C.使用高效催化剂 d.扩大容器体积
(1)科学家已成功合成少量N4分子,N4和N2互为
(2)叠氮化钠(NaN3)受撞击完全分解产生钠和氮气,故可应用于汽车安全气囊。若产生40.32L(标况下)氮气,至少需要叠氮酸钠
(3)检验铵态氮肥中铵根离子的实验方案是(补充写出步骤,现象):取样,溶于水
(4)等物质的量浓度的两溶液,pH大小为:氯化铵
最新“人工固氮”的研究报道:常温常压、催化剂条件下, N2在催化剂表面与水发生反应:与水发生反应: 2N2(g)+6H2O(g)
 4NH3(g)+3O2(g)-Q,(Q>0)
4NH3(g)+3O2(g)-Q,(Q>0)(5)如果反应的平衡常数K值变小,该反应正反应速率
(6)若反应在恒容条件下进行,请用上述反应中的有关物理量来说明该反应已达到平衡状态
(7)下列能够提高氮气转化率的措施是:
A.适当升高温度 b.增加水的用量
C.使用高效催化剂 d.扩大容器体积
您最近一年使用:0次
名校
4 . 在热的稀硫酸中溶解了7.6gFeSO4 固体,当加入50mL0.5mol·L-1KNO2溶液时,其中的Fe2+全部转化成Fe3+,KNO2也完全反应并放出NxOy气体。
(1)配平该反应的方程式__________________
FeSO4+ KNO2+ H2SO4 K2SO4+ Fe2(SO4)3+ □↑+ H2O
K2SO4+ Fe2(SO4)3+ □↑+ H2O
[化学计算数若为“1”,也必须写出,NxOy要写出具体物质并填在□中]。
(2)反应中氧化产物是___________ 。
(3) 标准状况下,当生成NxOy气体的体积为2.24L 时,转移的电子数目为_____________ 。
(1)配平该反应的方程式
FeSO4+ KNO2+ H2SO4
 K2SO4+ Fe2(SO4)3+ □↑+ H2O
K2SO4+ Fe2(SO4)3+ □↑+ H2O[化学计算数若为“1”,也必须写出,NxOy要写出具体物质并填在□中]。
(2)反应中氧化产物是
(3) 标准状况下,当生成NxOy气体的体积为2.24L 时,转移的电子数目为
您最近一年使用:0次
名校
5 . 在反应2KMnO4+16HCl===2KCl+2MnCl2+5Cl2↑+8H2O中,氧化剂是________ ,氧化产物是________ ,氧化产物与还原产物的物质的量之比为________ ,被氧化与未被氧化的HCl的质量之比为________ ,若有73 g HCl被氧化,电子转移的总数为________ (用NA表示阿伏加德罗),标准状况生成Cl2的体积为________ L。
您最近一年使用:0次
6 . 铁酸钠(Na2FeO4)是水处理过程使用的一种新型净水剂,它的氧化性比高锰酸钾更强,本身在反应中被还原为Fe3+离子。
(1)配平制取铁酸钠的化学方程式____________
Fe(NO3)3 + NaOH + Cl2 = Na2FeO4 + NaNO3 + NaCl+ H2O
反应中______ 元素被氧化,转移电子总数为_______ 。
(2)若制取8.3g铁酸钠需要标准状况下______ L Cl2。
(3)已知CuO具有氧化性,能够和氨气反应生成两种单质,请写出在加热条件下CuO和NH3反应的化学方程式____________________________________________ 。
(1)配平制取铁酸钠的化学方程式
Fe(NO3)3 + NaOH + Cl2 = Na2FeO4 + NaNO3 + NaCl+ H2O
反应中
(2)若制取8.3g铁酸钠需要标准状况下
(3)已知CuO具有氧化性,能够和氨气反应生成两种单质,请写出在加热条件下CuO和NH3反应的化学方程式
您最近一年使用:0次
名校
7 . 我国政府为了消除碘缺乏病,规定在食盐中必须加入适量的碘酸钾。检验食盐中是否加碘,可利用如下反应:
KIO3+ KI+ H2SO4═ K2SO4+ I2 + H2O
(1)配平该方程式,并且用双线桥法表示该方程式电子转移的方向与数目:____________________
(2)该反应中氧化剂和还原剂的物质的量之比为______________ ;
(3)如果反应中转移0.5mol电子,则生成I2的物质的量为____________ ;
KIO3+ KI+ H2SO4═ K2SO4+ I2 + H2O
(1)配平该方程式,并且用双线桥法表示该方程式电子转移的方向与数目:
(2)该反应中氧化剂和还原剂的物质的量之比为
(3)如果反应中转移0.5mol电子,则生成I2的物质的量为
您最近一年使用:0次
2017-11-19更新
|
623次组卷
|
7卷引用:江苏省宿迁市沭阳县2017-2018学年高一(上)期中化学试卷
8 . 物质的量是高中化学中常用的物理量,请完成以下有关其计算的内容。
(1)0.2 g H2含有___________________ 个H原子。
(2)标准状况下,含有相同氧原子数的CO与CO2的体积之比为__________ 。
(3)100 mL 某Al2(SO4)3溶液中,c(Al3+) = 2.0 mol/L,则其中c(SO42-) =_________ mol/L。
(4)工业上利用下列反应进行海水中溴元素的富集:Br2 + SO2 + 2H2O = H2SO4 + 2HBr 。若反应中生成了 0.2 mol HBr,则消耗SO2的体积(标准状况)是________________ L。
(1)0.2 g H2含有
(2)标准状况下,含有相同氧原子数的CO与CO2的体积之比为
(3)100 mL 某Al2(SO4)3溶液中,c(Al3+) = 2.0 mol/L,则其中c(SO42-) =
(4)工业上利用下列反应进行海水中溴元素的富集:Br2 + SO2 + 2H2O = H2SO4 + 2HBr 。若反应中生成了 0.2 mol HBr,则消耗SO2的体积(标准状况)是
您最近一年使用:0次
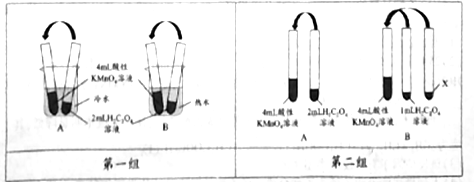
9 . 完成下列有关KMnO4溶液和H2C2O4溶液的实验:
【实验一】用0.01mol/L 酸性KmnO4溶液和0.2mol/L H2C2O4溶液分别进行了如图所示的三组实验,用于探究不同条件对化学反应速率的影响。回答下列问题:
(1)KMnO4溶液需用_____ 进行酸化,参加反应的物质n(KMnO4):n(H2C2O4)=_____ .
(2)第一组实验中褪色时间更长的是:_____ (填“A”或“B”)组实验。
(3)第二组实验中B组实验中X为:__________ 。
(4)第三组实验发现Mn2+能加快该反应的速率,催化剂Y的化学式为_________ 。
【实验二】测定某乙二酸晶体(H2C2O4·xH2O)中的x值,具体操作如下:
(5)滴定:称取2.52g 乙二酸晶体,配成100mL溶液,准确量取25.00mL乙二酸溶液于锥形瓶中,加少量酸酸化,将0.1mol/L KMnO4标准溶液装入_____ (填“酸式”或“碱式”)滴定管,进行滴定操作。在实验中发现,刚滴下少量KMnO4溶液时,需将锥形瓶摇动一段时间后,紫红色才慢慢褪去,再继续滴加时,紫红色就很快褪去了。出现上述现象的原因是_______ 。待到______ ,证明达到滴定终点。
(6)计算:再重复上述操作3次,记录数据如下表:
则x为__________ 。
(7)误差分析:下列操作会导致测量的乙二酸溶液浓度偏高的是_______ (填序号)
A.配制KMnO4标准溶液定容时,仰视观察刻度线
B.不小心将少量酸性KMnO4标准溶液滴到锥形瓶外
C.滴定前锥形瓶中有少量蒸馏水
D.滴定前滴定管尖嘴部分有气泡,滴定后气泡消失
E.观察读数时,滴定前仰视读数,滴定后俯视读数
【实验一】用0.01mol/L 酸性KmnO4溶液和0.2mol/L H2C2O4溶液分别进行了如图所示的三组实验,用于探究不同条件对化学反应速率的影响。回答下列问题:
(1)KMnO4溶液需用
(2)第一组实验中褪色时间更长的是:
(3)第二组实验中B组实验中X为:

(4)第三组实验发现Mn2+能加快该反应的速率,催化剂Y的化学式为
【实验二】测定某乙二酸晶体(H2C2O4·xH2O)中的x值,具体操作如下:
(5)滴定:称取2.52g 乙二酸晶体,配成100mL溶液,准确量取25.00mL乙二酸溶液于锥形瓶中,加少量酸酸化,将0.1mol/L KMnO4标准溶液装入
(6)计算:再重复上述操作3次,记录数据如下表:
实验次数 | 滴定前读数(mL) | 滴定后读数(mL) |
1 | 0.00 | 20.10 |
2 | 1.00 | 20.90 |
3 | 0.20 | 20.20 |
4 | 0.00 | 22.10 |
则x为
(7)误差分析:下列操作会导致测量的乙二酸溶液浓度偏高的是
A.配制KMnO4标准溶液定容时,仰视观察刻度线
B.不小心将少量酸性KMnO4标准溶液滴到锥形瓶外
C.滴定前锥形瓶中有少量蒸馏水
D.滴定前滴定管尖嘴部分有气泡,滴定后气泡消失
E.观察读数时,滴定前仰视读数,滴定后俯视读数
您最近一年使用:0次
10 . 填空:
(1)0. 5 mol NH3分子中所含氮原子数为__________ 个;
(2)1.2g RSO4中含0.01 mol R2+,则RSO4的摩尔质量是__________ ;
(3)0.1 mol·L-1的 Cu(NO3)2溶液中NO3-的物质的量浓度是__________ ;
(4)新制氯水在阳光照射下产生的无色气体是__________ ;
(5)配制100 mL 1 mol/L NaCl溶液,定容后,把容量瓶倒置摇匀后发现液面低于刻度线,补加水至刻度处,会引起所配溶液物质的量浓度__________ (选填“偏高、偏低、无影响”);
(6)实验室制备氯气时,收集氯气常采用__________ 法。
(1)0. 5 mol NH3分子中所含氮原子数为
(2)1.2g RSO4中含0.01 mol R2+,则RSO4的摩尔质量是
(3)0.1 mol·L-1的 Cu(NO3)2溶液中NO3-的物质的量浓度是
(4)新制氯水在阳光照射下产生的无色气体是
(5)配制100 mL 1 mol/L NaCl溶液,定容后,把容量瓶倒置摇匀后发现液面低于刻度线,补加水至刻度处,会引起所配溶液物质的量浓度
(6)实验室制备氯气时,收集氯气常采用
您最近一年使用:0次



