1 . 【查阅资料】乙二酸俗称草酸,草酸晶体(H2C2O4•2H2O)在100 ℃时开始升华,157 ℃时大量升华并开始分解;草酸蒸气在低温下迅速冷凝为固体;草酸钙不溶于水,草酸蒸气能使澄清石灰水变浑浊。
Ⅰ.乙二酸的不稳定性:根据草酸晶体的组成,猜想其受热分解产物为CO、CO2和H2O。
(1)请用下列装置组成一套探究并验证其产物的实验装置。请回答下列问题:
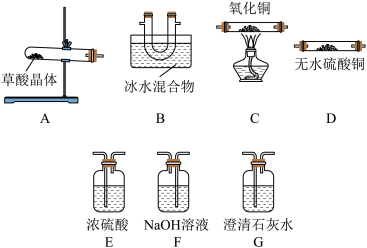
①装置的连接顺序为:A→D→B→G→______→______→C→G______ 。
②装置中冰水混合物的作用是______ 。
③整套装置存在不合理之处______ 。
Ⅱ.乙二酸的弱酸性:
(2)为验证草酸具有弱酸性设计了下列实验,其中能达到实验目的的是______ 。
A.将草酸晶体溶于含酚酞的NaOH溶液中,溶液褪色
B.测定0.1 mol•L-1草酸溶液的pH
C.将草酸溶液加入Na2CO3溶液中,有CO2放出
Ⅲ.乙二酸的还原性:
(3)该小组同学向用硫酸酸化的KMnO4溶液中滴入过量的草酸溶液,发现酸性KMnO4溶液褪色,从而判断草酸具有较强的还原性。该反应的离子方程式为:2MnO +H2C2O4+6H+=2Mn2++10CO2↑+8H2O。
+H2C2O4+6H+=2Mn2++10CO2↑+8H2O。
利用该性质测草酸浓度,取草酸(H2C2O4)溶液置于锥形瓶中,加入适量稀硫酸,用浓度为0.1 mol•L-1的高锰酸钾溶液滴定,表格中记录了实验数据:
①滴定时,KMnO4溶液应装在______ 式滴定管中,滴定终点时的现象是______ 。
②该草酸溶液的浓度为______ 。
③下列操作会引起测定结果偏高的是_____ 。
A.滴定管在盛装KMnO4溶液前未润洗
B.滴定过程中,锥形瓶振荡的太剧烈,以致部分液体溅出
C.滴定前读数正确,滴定终点时俯视读数
D.装待测液的锥形瓶用蒸馏水洗涤后,没用待测液润洗
Ⅰ.乙二酸的不稳定性:根据草酸晶体的组成,猜想其受热分解产物为CO、CO2和H2O。
(1)请用下列装置组成一套探究并验证其产物的实验装置。请回答下列问题:

①装置的连接顺序为:A→D→B→G→______→______→C→G
②装置中冰水混合物的作用是
③整套装置存在不合理之处
Ⅱ.乙二酸的弱酸性:
(2)为验证草酸具有弱酸性设计了下列实验,其中能达到实验目的的是
A.将草酸晶体溶于含酚酞的NaOH溶液中,溶液褪色
B.测定0.1 mol•L-1草酸溶液的pH
C.将草酸溶液加入Na2CO3溶液中,有CO2放出
Ⅲ.乙二酸的还原性:
(3)该小组同学向用硫酸酸化的KMnO4溶液中滴入过量的草酸溶液,发现酸性KMnO4溶液褪色,从而判断草酸具有较强的还原性。该反应的离子方程式为:2MnO
 +H2C2O4+6H+=2Mn2++10CO2↑+8H2O。
+H2C2O4+6H+=2Mn2++10CO2↑+8H2O。利用该性质测草酸浓度,取草酸(H2C2O4)溶液置于锥形瓶中,加入适量稀硫酸,用浓度为0.1 mol•L-1的高锰酸钾溶液滴定,表格中记录了实验数据:
| 滴定次数 | 待测液体积(mL) | 标准KMnO4溶液体积(mL) | |
| 滴定前读数 | 滴定后读数 | ||
| 第一次 | 25.00 | 0.50 | 20.40 |
| 第二次 | 25.00 | 3.00 | 23.00 |
| 第三次 | 25.00 | 1.00 | 22.50 |
| 第四次 | 25.00 | 4.00 | 24.10 |
②该草酸溶液的浓度为
③下列操作会引起测定结果偏高的是
A.滴定管在盛装KMnO4溶液前未润洗
B.滴定过程中,锥形瓶振荡的太剧烈,以致部分液体溅出
C.滴定前读数正确,滴定终点时俯视读数
D.装待测液的锥形瓶用蒸馏水洗涤后,没用待测液润洗
您最近半年使用:0次
2023-02-09更新
|
224次组卷
|
2卷引用:辽宁省营口市大石桥市第三高级中学等2校2022-2023学年高二上学期期末考试化学试题
名校
解题方法
2 . 实验发现,溶液的酸碱性会影响物质的氧化性或者还原性.在化学实验中,经常将一定浓度的KMnO4溶液与一定浓度的硫酸混合使用.某实验需要480mLlmol/L的H2SO4和100g质量分数为25.2%的KMnO4溶液。要配制这两种溶液,进行了下列实验。请回答有关问题:
(1)实验室有化学纯的浓硫酸,其试剂瓶标签上的部分内容如下图:
该硫酸的物质的量浓度为_______ ,该实验中,应该取该硫酸_______ mL。
(2)要配制所需的两种溶液,下列仪器中需要使用的是烧杯、托盘天平和_______ (请填写仪器名称,下同),还需要的玻璃仪器有_______ 。

(3)下列关于仪器的说法正确的是______ 。
A. 使用前要检查容量瓶是否漏液
B. 容量瓶上标有容积、温度和浓度
C. 容量瓶和量筒用蒸馏水洗净后,需要烘干后再使用
D. 量筒在量取浓硫酸后,需要洗涤,且要将洗涤液转入容量瓶中
E. 该实验中多次使用玻璃棒,但是作用不同
(4)在两种溶液的配制过程中,下列操作中能使所配溶液的浓度偏低的有______ (填代号)。
①用量筒量取浓硫酸时仰视
②未等稀释后的硫酸溶液冷却到室温就转移到容量瓶中
③转移前,容量瓶中含有少量蒸馏水
④定容时,加蒸馏水超过标线,又用胶头滴管吸出
⑤定容时,俯视刻度线
⑥称量KMnO4固体时托盘天平的左边放置砝码
⑦称取25.2gKMnO4,固体,溶解在74.8mL的水中配制KMnO4溶液
(1)实验室有化学纯的浓硫酸,其试剂瓶标签上的部分内容如下图:
| 【品名】硫酸 【化学式】H2SO4 【纯度】化学纯(CP) 【相对分子质量】98 【规格】500mL 【密度】  【质量分数】98% |
(2)要配制所需的两种溶液,下列仪器中需要使用的是烧杯、托盘天平和

(3)下列关于仪器的说法正确的是
A. 使用前要检查容量瓶是否漏液
B. 容量瓶上标有容积、温度和浓度
C. 容量瓶和量筒用蒸馏水洗净后,需要烘干后再使用
D. 量筒在量取浓硫酸后,需要洗涤,且要将洗涤液转入容量瓶中
E. 该实验中多次使用玻璃棒,但是作用不同
(4)在两种溶液的配制过程中,下列操作中能使所配溶液的浓度偏低的有
①用量筒量取浓硫酸时仰视
②未等稀释后的硫酸溶液冷却到室温就转移到容量瓶中
③转移前,容量瓶中含有少量蒸馏水
④定容时,加蒸馏水超过标线,又用胶头滴管吸出
⑤定容时,俯视刻度线
⑥称量KMnO4固体时托盘天平的左边放置砝码
⑦称取25.2gKMnO4,固体,溶解在74.8mL的水中配制KMnO4溶液
您最近半年使用:0次
2023-12-16更新
|
80次组卷
|
2卷引用:甘肃省天水市第一中学2023-2024学年高一上学期12月月考化学试题
3 . 资料:“84”消毒液中含氯微粒主要有ClO-、Cl-、HClO,相同浓度时,HClO的氧化性强于ClO-。通常情况下,应将“84”消毒液原液稀释后使用,一般不用于衣服等纺织品的洗涤消毒。
(1)常温,将氯气通入NaOH溶液中可制得“84”消毒液,该反应的化学方程式为_______ 。
(2)已知某“84”消毒液瓶体部分标签如图所示,请回答下列问题。
①该“84”消毒液的物质的量浓度为_______ mol/L。
②“84”消毒液使用时需要稀释,某小组用上述“84”消毒液配制500 mL 0.2mol/L的稀溶液,需要用量筒量取该“84”消毒液体积为_______ mL。
③配制过程中,下列操作会造成新配制的稀溶液浓度偏低的是_______ 。
A.容量瓶使用时未干燥 B.没有洗涤烧杯和玻璃棒
C.定容时俯视刻度线 D.定容后液面低于刻度线,再加蒸馏水至刻度线
(3)为研究“84”消毒液的性质与使用条件,进行下列实验:
向三支试管中分别加入2 mL“84”消毒液和5滴紫色石蕊。继续进行如下实验:
①实验1中NaClO溶液与空气中二氧化碳反应的离子方程式为_______ 。(已知酸性: )
)
②实验3中生成气体的离子方程式为_______ 。
③综合以上实验为提高单位时间内“84”消毒液的漂白效果,你的建议是_______ 。
(1)常温,将氯气通入NaOH溶液中可制得“84”消毒液,该反应的化学方程式为
(2)已知某“84”消毒液瓶体部分标签如图所示,请回答下列问题。
| “84”消毒液 有效成分:NaClO 规格:1000 mL 质量分数:25% 密度:1.192g/cm3 |
②“84”消毒液使用时需要稀释,某小组用上述“84”消毒液配制500 mL 0.2mol/L的稀溶液,需要用量筒量取该“84”消毒液体积为
③配制过程中,下列操作会造成新配制的稀溶液浓度偏低的是
A.容量瓶使用时未干燥 B.没有洗涤烧杯和玻璃棒
C.定容时俯视刻度线 D.定容后液面低于刻度线,再加蒸馏水至刻度线
(3)为研究“84”消毒液的性质与使用条件,进行下列实验:
向三支试管中分别加入2 mL“84”消毒液和5滴紫色石蕊。继续进行如下实验:
| 实验 | 操作 | 现象 |
| 实验1 | 加入2 mL蒸馏水 | 短时间内未褪色,一段时间后蓝色褪去 |
| 实验2 | 加入2 mL 0.0002 mol/L的H2SO4溶液 | 蓝色迅速褪去,无气体产生 |
| 实验3 | 加入2 mL 2 mol/L的H2SO4溶液 | 蓝色迅速褪去,并产生大量刺激性的气体 |
 )
)②实验3中生成气体的离子方程式为
③综合以上实验为提高单位时间内“84”消毒液的漂白效果,你的建议是
您最近半年使用:0次
名校
解题方法
4 . “新冠”疫情期间,人们广泛使用“84”消毒液(有效成分NaClO).回答下列问题:
(1)用氯气制备“84”消毒液的离子方程式为_______ 。图中是某“84”消毒液的标签,NaClO的物质的量浓度为_______ mol·L-1(保留1位小数)。

(2)资料显示“84”消毒液不能与洁厕灵(含HCl)混合使用,对此某小组开展如图所示的研究。两表面皿之间充满黄绿色气体。则“84”消毒液与洁厕灵反应的化学方程式为_______ ,NaOH的作用是_______ 。

(3)过氧化钠有强氧化性,也可用作杀菌剂、消毒剂、漂白剂和供氧剂等。若Na2O2作供氧剂与H2O完全反应时,若转移0.3 mol电子,则生成标准状况下的O2_______ L。
(1)用氯气制备“84”消毒液的离子方程式为

(2)资料显示“84”消毒液不能与洁厕灵(含HCl)混合使用,对此某小组开展如图所示的研究。两表面皿之间充满黄绿色气体。则“84”消毒液与洁厕灵反应的化学方程式为

(3)过氧化钠有强氧化性,也可用作杀菌剂、消毒剂、漂白剂和供氧剂等。若Na2O2作供氧剂与H2O完全反应时,若转移0.3 mol电子,则生成标准状况下的O2
您最近半年使用:0次
5 . 已知氧化性:Br2>Fe3+>I2,向含a mol FeI2的溶液中加入含b mol Br2的溴水,充分反应。下列说法正确的是
| A.离子的还原性强弱:I->Br->Fe2+ |
| B.当2a≥b时,发生的离子反应:2Fe2++Br2=2Fe3++2Br- |
| C.当5a=4b时,反应后的离子浓度之比:c(Fe2+):c(Fe3+):c(Br-)=2:1:5 |
| D.当3a≦2b时,发生的离子反应:2Fe2++4I-+3Br2=2Fe3++2I2+6Br- |
您最近半年使用:0次
名校
6 . A、B、C、W均为中学常见的纯净物,它们之间有如下转化关系(其他产物及反应条件已略去,反应可以在水溶液中进行)。
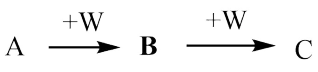
(1)若A为有刺激性气味的气体,其水溶液呈碱性;C为红棕色气体,与水反应生成一元强酸D,D具有强氧化性。
①实验室制取气体A的化学方程式_______ ;
②写出A→B的化学方程式为_______ ;
③将3.2g铜与60.0mL一定浓度D的溶液发生反应,铜完全溶解,产生B和C混合气体的体积为8.96L(标况)。待产生的气体全部释放后,向溶液加入100mL2.0mol/L的NaOH溶液,恰好使溶液中的Cu2+全部转化成沉淀,则原D溶液的物质的量浓度为_______ mol/L。
(2)若A、B、C的溶液均显碱性,焰色试验均呈黄色;C常作面包和糕点的发泡剂,受热分解可生成B。
①写出A溶液与C溶液反应的离子方程式_______ ;
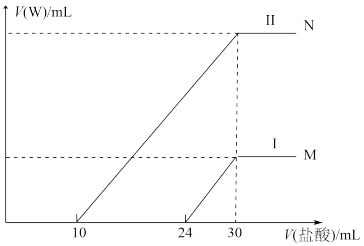
②向两份60mL同浓度的A溶液中通入不同体积的W气体,得到溶液M、N。向M、N溶液中逐滴加入浓度为0.25mol/L盐酸,如图所示Ⅰ和Ⅱ分别为加入V(盐酸)与产生V(W)的关系。则A溶液的物质的量浓度为_______ ,M、N两溶液中相同溶质的物质的量之比为_______ 。
(1)若A为有刺激性气味的气体,其水溶液呈碱性;C为红棕色气体,与水反应生成一元强酸D,D具有强氧化性。
①实验室制取气体A的化学方程式
②写出A→B的化学方程式为
③将3.2g铜与60.0mL一定浓度D的溶液发生反应,铜完全溶解,产生B和C混合气体的体积为8.96L(标况)。待产生的气体全部释放后,向溶液加入100mL2.0mol/L的NaOH溶液,恰好使溶液中的Cu2+全部转化成沉淀,则原D溶液的物质的量浓度为
(2)若A、B、C的溶液均显碱性,焰色试验均呈黄色;C常作面包和糕点的发泡剂,受热分解可生成B。
①写出A溶液与C溶液反应的离子方程式

②向两份60mL同浓度的A溶液中通入不同体积的W气体,得到溶液M、N。向M、N溶液中逐滴加入浓度为0.25mol/L盐酸,如图所示Ⅰ和Ⅱ分别为加入V(盐酸)与产生V(W)的关系。则A溶液的物质的量浓度为
您最近半年使用:0次
名校
解题方法
7 . (1)下列物质: CO2、P2O5、CaO、SO2中,有一种物质在某些化学性质或分类上与其他几种物质不同,这种物质是____________
(2)维生素C能帮助人体将食物中摄取的、不易吸收的Fe3+转变为易吸收的Fe2+,,这说明维生素C具有_________ 性(填氧化性或还原性)
(3)标准状况下,10.8g某气体的体积是8.96L,则此气体的物质的量是_________ ,相对分子质量为___________ 。
(4)体积相等的KCl、CaCl2、FeCl3三种溶液,与等体积、等物质的量浓度的AgNO3溶液均恰好完全反应,则KCl、CaCl2、FeCl3三种溶液中溶质的物质的量浓度之比为____
(5)在标准状况下,将224 L氯化氢气体溶于635 mL的水(水的密度为1.00 g/cm3)中,所得盐酸的密度为1.18 g/cm3。该溶液的物质的量浓度是____ (保留两位小数)。
(2)维生素C能帮助人体将食物中摄取的、不易吸收的Fe3+转变为易吸收的Fe2+,,这说明维生素C具有
(3)标准状况下,10.8g某气体的体积是8.96L,则此气体的物质的量是
(4)体积相等的KCl、CaCl2、FeCl3三种溶液,与等体积、等物质的量浓度的AgNO3溶液均恰好完全反应,则KCl、CaCl2、FeCl3三种溶液中溶质的物质的量浓度之比为
(5)在标准状况下,将224 L氯化氢气体溶于635 mL的水(水的密度为1.00 g/cm3)中,所得盐酸的密度为1.18 g/cm3。该溶液的物质的量浓度是
您最近半年使用:0次
2019-11-25更新
|
167次组卷
|
3卷引用:江西省宜春市宜丰县第二中学2019-2020学年高一上学期期中考试化学试题
江西省宜春市宜丰县第二中学2019-2020学年高一上学期期中考试化学试题(已下线)第2讲 物质的量浓度-2021年高考化学一轮复习名师精讲练江西省宁冈中学2020-2021学年高三上学期第一次段考化学试题
名校
8 . 硫的多种化合物在工业中有重要的应用。
(1)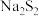 可以做制革工业中原皮的脱毛剂,写出
可以做制革工业中原皮的脱毛剂,写出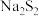 的电子式
的电子式___________ 。
(2)连二亚硫酸钠 又称保险粉,可作木浆造纸的漂白剂,其水溶液性质不稳定,有极强的还原性。
又称保险粉,可作木浆造纸的漂白剂,其水溶液性质不稳定,有极强的还原性。
① 中S元素的化合价为
中S元素的化合价为___________ 。
②将甲酸(HCOOH)和NaOH溶液混合,再通入 气体,会得到保险粉,此时甲酸被氧化为
气体,会得到保险粉,此时甲酸被氧化为 。该反应的化学方程式为
。该反应的化学方程式为___________ 。
(3)铬会造成环境污染,某酸性废水中含有 ,处理时用焦亚硫酸钠
,处理时用焦亚硫酸钠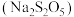 将
将 转化为毒性较低的
转化为毒性较低的 ,再调节pH至8,使铬元素沉降,分离出污泥后测得废水中
,再调节pH至8,使铬元素沉降,分离出污泥后测得废水中 浓度为
浓度为 ,达到排放标准。
,达到排放标准。
①写出 参加反应的离子方程式
参加反应的离子方程式___________ 。
②处理后的废水中 的物质的量浓度为
的物质的量浓度为___________ 。
(1)
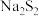 可以做制革工业中原皮的脱毛剂,写出
可以做制革工业中原皮的脱毛剂,写出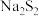 的电子式
的电子式(2)连二亚硫酸钠
 又称保险粉,可作木浆造纸的漂白剂,其水溶液性质不稳定,有极强的还原性。
又称保险粉,可作木浆造纸的漂白剂,其水溶液性质不稳定,有极强的还原性。①
 中S元素的化合价为
中S元素的化合价为②将甲酸(HCOOH)和NaOH溶液混合,再通入
 气体,会得到保险粉,此时甲酸被氧化为
气体,会得到保险粉,此时甲酸被氧化为 。该反应的化学方程式为
。该反应的化学方程式为(3)铬会造成环境污染,某酸性废水中含有
 ,处理时用焦亚硫酸钠
,处理时用焦亚硫酸钠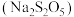 将
将 转化为毒性较低的
转化为毒性较低的 ,再调节pH至8,使铬元素沉降,分离出污泥后测得废水中
,再调节pH至8,使铬元素沉降,分离出污泥后测得废水中 浓度为
浓度为 ,达到排放标准。
,达到排放标准。①写出
 参加反应的离子方程式
参加反应的离子方程式②处理后的废水中
 的物质的量浓度为
的物质的量浓度为
您最近半年使用:0次
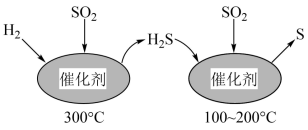
9 . 运用化学反应原理研究硫单质及其化合物的反应,对生产、生活、环境保护等领域有着重要的意义。
(1)工业上采用 催化还原
催化还原 ,不仅可以消除
,不仅可以消除 污染,还可得到单质S。反应分两步完成,如图所示,
污染,还可得到单质S。反应分两步完成,如图所示, 催化还原
催化还原 第一步反应的化学方程式为
第一步反应的化学方程式为___________ 。
(2)工业上常用 溶液对燃煤烟气进行脱硫、脱硝。
溶液对燃煤烟气进行脱硫、脱硝。
已知 溶液具有强氧化性,酸性条件下
溶液具有强氧化性,酸性条件下 发生歧化反应生成
发生歧化反应生成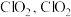 易溶于水,具有强氧化性,可氧化
易溶于水,具有强氧化性,可氧化 。
。
①实验室模拟脱硫过程:先加稀硫酸调节 吸收液的
吸收液的 为5,再向其中通入含
为5,再向其中通入含 的模拟烟气,测得脱硫效率(即
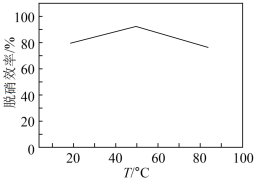
的模拟烟气,测得脱硫效率(即 的吸收率)随温度变化的曲线如图所示。结合已知信息分析,温度大于
的吸收率)随温度变化的曲线如图所示。结合已知信息分析,温度大于 时,随温度升高脱硫效率下降的原因是
时,随温度升高脱硫效率下降的原因是___________ 。
②煤燃烧排放的烟气含有 和
和 ,采用
,采用 溶液作为吸收剂可同时对烟气进行脱硫、脱硝。将含有
溶液作为吸收剂可同时对烟气进行脱硫、脱硝。将含有 和
和 的烟气通入盛有
的烟气通入盛有 溶液的反应器中,反应一段时间后,测得溶液中离子浓度的有关数据如表(其他离子忽略不计):
溶液的反应器中,反应一段时间后,测得溶液中离子浓度的有关数据如表(其他离子忽略不计):
表中y=_______ 。若该溶液为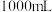 (吸收前后溶液体积不变),该过程转移的电子数为
(吸收前后溶液体积不变),该过程转移的电子数为______ mol。(写出计算过程)。
(1)工业上采用
 催化还原
催化还原 ,不仅可以消除
,不仅可以消除 污染,还可得到单质S。反应分两步完成,如图所示,
污染,还可得到单质S。反应分两步完成,如图所示, 催化还原
催化还原 第一步反应的化学方程式为
第一步反应的化学方程式为
(2)工业上常用
 溶液对燃煤烟气进行脱硫、脱硝。
溶液对燃煤烟气进行脱硫、脱硝。已知
 溶液具有强氧化性,酸性条件下
溶液具有强氧化性,酸性条件下 发生歧化反应生成
发生歧化反应生成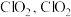 易溶于水,具有强氧化性,可氧化
易溶于水,具有强氧化性,可氧化 。
。①实验室模拟脱硫过程:先加稀硫酸调节
 吸收液的
吸收液的 为5,再向其中通入含
为5,再向其中通入含 的模拟烟气,测得脱硫效率(即
的模拟烟气,测得脱硫效率(即 的吸收率)随温度变化的曲线如图所示。结合已知信息分析,温度大于
的吸收率)随温度变化的曲线如图所示。结合已知信息分析,温度大于 时,随温度升高脱硫效率下降的原因是
时,随温度升高脱硫效率下降的原因是
②煤燃烧排放的烟气含有
 和
和 ,采用
,采用 溶液作为吸收剂可同时对烟气进行脱硫、脱硝。将含有
溶液作为吸收剂可同时对烟气进行脱硫、脱硝。将含有 和
和 的烟气通入盛有
的烟气通入盛有 溶液的反应器中,反应一段时间后,测得溶液中离子浓度的有关数据如表(其他离子忽略不计):
溶液的反应器中,反应一段时间后,测得溶液中离子浓度的有关数据如表(其他离子忽略不计):| 离子 |  |  |  |  |  |
浓度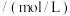 | 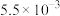 | 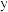 |  |  |  |
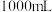 (吸收前后溶液体积不变),该过程转移的电子数为
(吸收前后溶液体积不变),该过程转移的电子数为
您最近半年使用:0次
10 . KMnO4溶液常用作氧化还原反应滴定的标准液,由于KMnO4的强氧化性,它的溶液很容易被空气中或水中某些少量还原性物质还原,生成难溶性物质MnO(OH)2,因此配制KMnO4标准溶液的操作是:(1)称取稍多于所需量的KMnO4固体溶于水,将溶液加热并保持微沸1h;(2)用微孔玻璃漏斗过滤除去难溶的MnO(OH)2;(3)过滤得到的KMnO4溶液贮存于棕色试剂瓶放在暗处;(4)利用氧化还原滴定方法,在70℃-80℃条件下用基准试剂(纯度高、式量较大、稳定性较好的物质)溶液标定其浓度。请回答下列问题:
(1)将溶液加热并保持微沸1h的目的是_____________ 。
(2)如何保证在70℃~80℃条件下进行滴定操作:____________ 。
(3)准确量取一定体积的KMnO4溶液用____ (填仪器名称)。
(4)在下列物质中,用于标定KMnO4溶液的基准试剂最好选用____ (填序号)。
(5)若准确称取Wg你选的基准试剂溶于水配成500 mL水溶液,取25.00 mL置于锥形瓶中,用高锰酸钾溶液滴定至终点,消耗高锰酸钾溶液VmL。问:
①滴定终点标志是_______________ ;
②所配制KMnO4标准溶液的物质的量浓度为________ mol/ L;
(6)若用放置两周的KMnO4标准溶液去滴定水样中Fe2+含量,测得的浓度值将____ (填“偏高”或“偏低”)。
(1)将溶液加热并保持微沸1h的目的是
(2)如何保证在70℃~80℃条件下进行滴定操作:
(3)准确量取一定体积的KMnO4溶液用
(4)在下列物质中,用于标定KMnO4溶液的基准试剂最好选用
| A.H2C2O4·2H2O | B.FeSO4 | C.浓盐酸 | D.Na2SO3 |
①滴定终点标志是
②所配制KMnO4标准溶液的物质的量浓度为
(6)若用放置两周的KMnO4标准溶液去滴定水样中Fe2+含量,测得的浓度值将
您最近半年使用:0次



