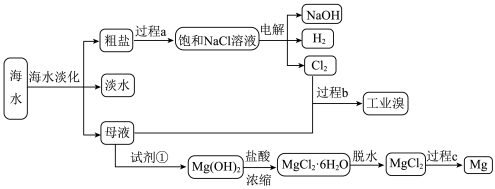
1 . 海水的综合利用主要包括海水直接利用,海水淡化和海水中化学元素的利用等方面。其中,海水中化学元素的利用是指从海水中提取钠、镁、氯、溴等元素。______ 操作。
2.粗盐中存在 、
、 、
、 等可溶性杂质离子,要除去这些离子加入沉淀剂的顺序正确的是______。(不定项)
等可溶性杂质离子,要除去这些离子加入沉淀剂的顺序正确的是______。(不定项)
①过量的 溶液②过量的
溶液②过量的 溶液③过量的NaOH溶液
溶液③过量的NaOH溶液
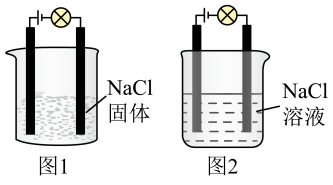
3.某同学利用食盐进行化学实验,按照图1连接好线路发现灯泡不亮,按照图2连接好线路发现灯泡亮,由此得出的结论正确的是______。
4.电解熔融的无水氯化镁所得的镁蒸气在特定的环境中冷却后即为固体镁。下列物质中可以用作镁蒸气的冷却剂的是______。
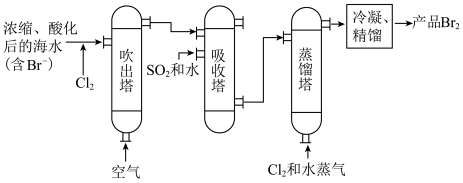
5.过程b用于海水提溴。主要工业生产流程如下图所示。 ,利用了
,利用了 的
的______ ,吸收塔中吸收 ,利用了
,利用了 的
的______ 。
A.氧化性 B.还原性 C.挥发性 D.易溶于水
6.从海水中提取的粗盐精制后,通过电解饱和食盐水得到一系列化工产品。
①请写出电解饱和食盐水的化学方程式______ 。
②检验阳极产物时可选用______ 。
③实验测得产生的 体积(标准状况下)为5.60mL,若电解后溶液的体积为50.00mL,则溶液中NaOH的物质的量浓度为
体积(标准状况下)为5.60mL,若电解后溶液的体积为50.00mL,则溶液中NaOH的物质的量浓度为______  。
。
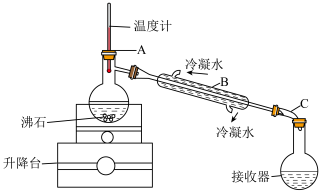
7.实验室可以利用蒸馏的方法进行海水淡化,可选用如图装置完成。______ 、______ 。
2.粗盐中存在
 、
、 、
、 等可溶性杂质离子,要除去这些离子加入沉淀剂的顺序正确的是______。(不定项)
等可溶性杂质离子,要除去这些离子加入沉淀剂的顺序正确的是______。(不定项)①过量的
 溶液②过量的
溶液②过量的 溶液③过量的NaOH溶液
溶液③过量的NaOH溶液| A.①②③ | B.①③② | C.②①③ | D.③②① |
| A.NaCl固体不导电,不电解质 |
| B.电解质本身不一定能导电 |
C.图2中水是电解质,电离产生大量的 和 和 |
| D.图2中NaCl在电流作用下电离出了大量自由移动的离子 |
| A.Ar | B. | C. | D. |
 ,利用了
,利用了 的
的 ,利用了
,利用了 的
的A.氧化性 B.还原性 C.挥发性 D.易溶于水
6.从海水中提取的粗盐精制后,通过电解饱和食盐水得到一系列化工产品。
①请写出电解饱和食盐水的化学方程式
②检验阳极产物时可选用
③实验测得产生的
 体积(标准状况下)为5.60mL,若电解后溶液的体积为50.00mL,则溶液中NaOH的物质的量浓度为
体积(标准状况下)为5.60mL,若电解后溶液的体积为50.00mL,则溶液中NaOH的物质的量浓度为 。
。7.实验室可以利用蒸馏的方法进行海水淡化,可选用如图装置完成。
您最近一年使用:0次
名校
解题方法
2 . Ⅰ.烟气脱硝是指通过一系列化学反应将烟气中的 、
、 等氮的氧化物转化为无污染的含氮物质的过程。
等氮的氧化物转化为无污染的含氮物质的过程。
(1)已知 为角形分子。下列关于
为角形分子。下列关于 、
、 说法正确的是___________。
说法正确的是___________。
(2)比较 与
与 的电负性大小,并说明理由
的电负性大小,并说明理由___________ 。
Ⅱ.臭氧—氨水法是一种高效的工业脱硝技术,主要流程图如下所示: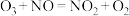 ;
;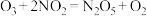
(3)静电除尘的原理是含尘气体经高压静电场使尘粒带电荷后,尘粒向带相反电荷的电极定向移动,从而达到除尘目的。静电除尘类似于胶体的___________ 。
(4)X溶液中含有一种铵盐,它由氨水与 反应生成,写出反应的离子方程式
反应生成,写出反应的离子方程式___________ 。
(5)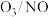 摩尔比对
摩尔比对 脱除率以及
脱除率以及 转化率的影响如下图所示。分析最佳摩尔比并说明理由
转化率的影响如下图所示。分析最佳摩尔比并说明理由___________ 。 ,已知该电池反应为:
,已知该电池反应为: 。
。___________ (选填“流出”或“流入”)电子。B电极的电极反应式___________ 。
Ⅳ.利用催化剂 对
对 催化转化的反应过程与能量变化如下图所示。
催化转化的反应过程与能量变化如下图所示。
(8)写出总反应的热化学方程式___________ 。并判断在上述实验条件时该反应是否会自发地进行___________ 。
 、
、 等氮的氧化物转化为无污染的含氮物质的过程。
等氮的氧化物转化为无污染的含氮物质的过程。(1)已知
 为角形分子。下列关于
为角形分子。下列关于 、
、 说法正确的是___________。
说法正确的是___________。| A.均属于酸性氧化物 | B.均属于离子化合物 |
| C.均属于极性分子 | D.均属于电解质 |
(2)比较
 与
与 的电负性大小,并说明理由
的电负性大小,并说明理由Ⅱ.臭氧—氨水法是一种高效的工业脱硝技术,主要流程图如下所示:

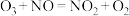 ;
;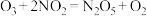
(3)静电除尘的原理是含尘气体经高压静电场使尘粒带电荷后,尘粒向带相反电荷的电极定向移动,从而达到除尘目的。静电除尘类似于胶体的
(4)X溶液中含有一种铵盐,它由氨水与
 反应生成,写出反应的离子方程式
反应生成,写出反应的离子方程式(5)
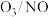 摩尔比对
摩尔比对 脱除率以及
脱除率以及 转化率的影响如下图所示。分析最佳摩尔比并说明理由
转化率的影响如下图所示。分析最佳摩尔比并说明理由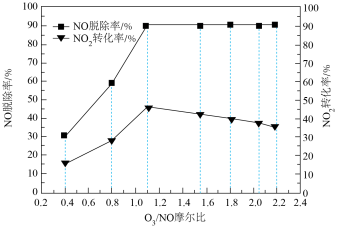
 ,已知该电池反应为:
,已知该电池反应为: 。
。
Ⅳ.利用催化剂
 对
对 催化转化的反应过程与能量变化如下图所示。
催化转化的反应过程与能量变化如下图所示。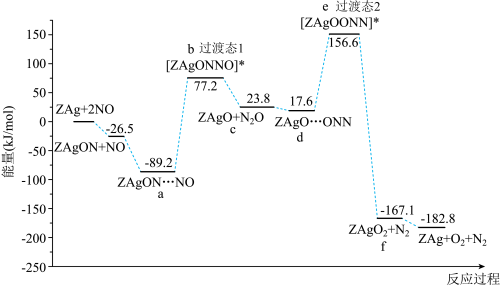
A.高温下有利于 的转化 的转化 | B.由a释放 的反应速率最慢 的反应速率最慢 |
| C.a到b、d到e,都会形成非极性键 | D.过渡态2比过渡态1稳定 |
(8)写出总反应的热化学方程式
您最近一年使用:0次
名校
3 . 海水中化学元素的利用是指从海水中提取钠、镁、氯、溴等元素。

(1)海水晒盐使用的盐田法,相当于化学中的___________ 操作。
(2)关于海水的综合利用,以下说法正确的是___________ 。
A.从海水中提溴、镁元素,都包含氧化还原反应
B.利用潮汐发电是将电能转化为动能
C.海域辽阔,所以可以将废水排入海洋
(3)某同学利用食盐进行化学实验,按照图1连接好线路发现灯泡不亮,按照图2连接好线路发现灯泡亮,由此得出的结论正确的是___________ 。
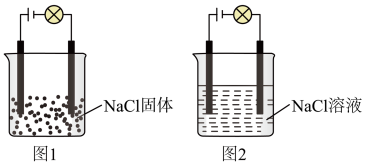
A. 固体不导电,不是电解质
固体不导电,不是电解质
B.电解质本身不一定能导电
C.图2中水是电解质,电离产生大量的
(4)过程 用于海水提溴。主要工业生产流程如下图所示。
用于海水提溴。主要工业生产流程如下图所示。

①向苦卤中通入 ,利用了
,利用了 的
的___________ ,
②吹出塔中通入热空气吹出 ,利用了
,利用了 的
的___________ 。
A.氧化性 B.还原性
C.挥发性,沸点比水低 D.易溶于水
(5)从海水中提取的粗盐精制后,通过电解饱和食盐水得到一系列化工产品。
①请写出电解饱和食盐水的化学方程式___________ 。
②检验阳极产物的方法为___________ 。
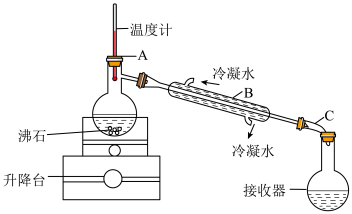
(6)实验室可以利用蒸馏的方法进行海水淡化,可选用如图装置完成。该装置中有一处明显的错误是___________ 。

(1)海水晒盐使用的盐田法,相当于化学中的
(2)关于海水的综合利用,以下说法正确的是
A.从海水中提溴、镁元素,都包含氧化还原反应
B.利用潮汐发电是将电能转化为动能
C.海域辽阔,所以可以将废水排入海洋
(3)某同学利用食盐进行化学实验,按照图1连接好线路发现灯泡不亮,按照图2连接好线路发现灯泡亮,由此得出的结论正确的是

A.
 固体不导电,不是电解质
固体不导电,不是电解质B.电解质本身不一定能导电
C.图2中水是电解质,电离产生大量的

(4)过程
 用于海水提溴。主要工业生产流程如下图所示。
用于海水提溴。主要工业生产流程如下图所示。
①向苦卤中通入
 ,利用了
,利用了 的
的②吹出塔中通入热空气吹出
 ,利用了
,利用了 的
的A.氧化性 B.还原性
C.挥发性,沸点比水低 D.易溶于水
(5)从海水中提取的粗盐精制后,通过电解饱和食盐水得到一系列化工产品。
①请写出电解饱和食盐水的化学方程式
②检验阳极产物的方法为
(6)实验室可以利用蒸馏的方法进行海水淡化,可选用如图装置完成。该装置中有一处明显的错误是

您最近一年使用:0次
名校
4 . 溶液的导电性是研究电解质及离子反应的重要手段。如图是一种微型导电性测定器。该仪器可测物质的导电性。

实验一:利用该仪器确定某些化合物是电解质或非电解质。
步骤1:配溶液:
①用氯化钠配制50mL 1.000mol/L的氯化钠溶液。
②用4.000mol/L的甲酸溶液配制50mL 1.000mol/L的甲酸溶液。
(1)配制上述两种溶液都需要的仪器有___________ 。
(2)配制以上溶液,需氯化钠___________ g,需4.000mol/L的甲酸溶液___________ mL。
(3)若配制的甲酸溶液浓度偏低,可能的原因是___________。
步骤2:测导电性:实验结果如下表。
(4)实验⑤不能确定蔗糖是电解质,请说明理由。___________ 。
(5)由以上实验可知,甲酸属于___________ 。
A.强电解质 B.弱电解质 C.不能确定
(6)由以上实验可知,影响溶液导电性强弱的因素有___________ 、___________ 。(任写两点)
实验二:某兴趣小组同学还想通过测定溶液导电性变化来探究电解质之间的反应。经多次实验,他们得到了一些“溶液导电性随加入电解质溶液体积变化”不同的图像。

(7)向醋酸中滴加等浓度的氨水至过量,此过程中溶液导电性变化符合图像C,解释开始阶段溶液导电性会上升的理由:___________ 。
(8)关于以上四张图对应的反应,下列说法正确的是___________。

实验一:利用该仪器确定某些化合物是电解质或非电解质。
步骤1:配溶液:
①用氯化钠配制50mL 1.000mol/L的氯化钠溶液。
②用4.000mol/L的甲酸溶液配制50mL 1.000mol/L的甲酸溶液。
(1)配制上述两种溶液都需要的仪器有
(2)配制以上溶液,需氯化钠
(3)若配制的甲酸溶液浓度偏低,可能的原因是___________。
| A.溶解用的容器不干燥 | B.定容时俯视刻度线 |
| C.摇匀后液面低于刻度线 | D.未洗涤操作 |
步骤2:测导电性:实验结果如下表。
| 编号 | 溶液 | 亮灯情况 | 结论 |
| ① | 1.000mol/L氯化钠 | 6个灯全亮 | 氯化钠是电解质 |
| ② | 纯甲酸 | 6个灯全不亮 | ? |
| ③ | 4.000mol/L甲酸 | 2个灯亮 | |
| ④ | 1.000mol/L甲酸 | 1个灯亮、1个灯有微弱的光 | |
| ⑤ | 1.000mol/L蔗糖 | 1个灯有微弱的光 | 不能确定 |
(4)实验⑤不能确定蔗糖是电解质,请说明理由。
(5)由以上实验可知,甲酸属于
A.强电解质 B.弱电解质 C.不能确定
(6)由以上实验可知,影响溶液导电性强弱的因素有
实验二:某兴趣小组同学还想通过测定溶液导电性变化来探究电解质之间的反应。经多次实验,他们得到了一些“溶液导电性随加入电解质溶液体积变化”不同的图像。

(7)向醋酸中滴加等浓度的氨水至过量,此过程中溶液导电性变化符合图像C,解释开始阶段溶液导电性会上升的理由:
(8)关于以上四张图对应的反应,下列说法正确的是___________。
| A.图A——向碳酸溶液中逐滴滴加相同浓度的Ba(OH)2至过量 |
| B.图B——向氢氧化钡溶液中逐滴滴加相同浓度的硫酸至过量 |
| C.图C——向氨水中逐滴滴加相同浓度的盐酸至过量 |
| D.图D——向醋酸溶液中逐滴滴加相同浓度的KOH至过量 |
您最近一年使用:0次
5 . 数字化实验是化学研究的重要手段。某兴趣小组同学通过电导率传感器测定溶液导电性变化来探究电解质之间的反应,得到了溶液导电性随加入电解质溶液体积变化的图像,如下图所示:

(1)向氢氧化钡溶液中逐滴滴加相同浓度的硫酸至过量,此过程中溶液导电性变化应符合图像_______ (填编号);如果将硫酸换成_______ (填化学式)溶液,也能得到类似的图像。
(2)向醋酸中滴加等浓度的氨水至过量,此过程中溶液导电性变化符合图像C,解释开始阶段溶液导电性为何会上升_______ ;如果将氨水换成等浓度的氢氧化钠溶液,则溶液导电性变化应符合图像为_______ 。

(1)向氢氧化钡溶液中逐滴滴加相同浓度的硫酸至过量,此过程中溶液导电性变化应符合图像
(2)向醋酸中滴加等浓度的氨水至过量,此过程中溶液导电性变化符合图像C,解释开始阶段溶液导电性为何会上升
您最近一年使用:0次
名校
6 . 有个成语叫“物以类聚”,本意就是物质的分类。对物质进行分类,我们不仅能够根据类别通性预测物质的性质,还能探索各类物质的共性和特性。氯是一种活泼的非金属元素,无论在生产、生活,还是在科学实验中,我们会接触到许多含氯的物质。
(1)化学家根据需要将众多物质进行分类,现有下列几种物质①冰水混合物 ②新制氯水 ③ ④盐酸 ⑤硫酸 ⑥熔融
④盐酸 ⑤硫酸 ⑥熔融 ⑦漂白粉 ⑧乙醇 以上物质属于纯净物的是
⑦漂白粉 ⑧乙醇 以上物质属于纯净物的是___________ (填序号,下同);能导电的是___________ ;属于非电解质的是___________ ;属于强电解质的是___________ ;上述物质中弱电解质的电离方程式:___________ 。
(2)某同学认真分析了氯水的反应: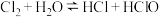 ,他的下列看法错误的是________
,他的下列看法错误的是________
(3)适合用如图装置进行分离的是___________

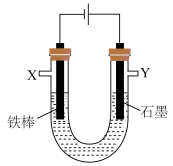
(4)某化学兴趣小组进行有关电解食盐水的探究实验,电解装置如图所示:
①实验约需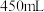 饱和食盐水,配制
饱和食盐水,配制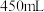 饱和食盐水所需的定量仪器有
饱和食盐水所需的定量仪器有___________ 和___________ 。
②配制过程中,下列操作使得配制结果偏小的是___________ 。
A.容量瓶在使用前未干燥,里面有少量蒸馏水
B.未去皮称重
C.未洗涤玻璃棒、烧杯
D.定容摇匀后发现液面低于容量瓶的刻度线,但未做任何处理
③电解饱和食盐水的离子方程式为:___________ 。
(5)工业上制氯化氢是将氯气在氢气中燃烧,火焰呈___________ 色。实验室可用喷泉实验验证氯化氢气体的溶解性,如图烧瓶内已装入实验室刚制备的氯化氢气体,可以引发喷泉的操作是___________ ,该实验的原理是___________ 。等完成实验后发现圆底烧瓶内液体占烧瓶体积的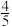 ,请说明液体未充满烧瓶的原因
,请说明液体未充满烧瓶的原因___________ 。若此时为标准状况,请计算瓶内溶液的浓度___________ 。

(6)工业上用氯气和___________ (填名称)来制造漂白粉,其成分是___________ 。
(1)化学家根据需要将众多物质进行分类,现有下列几种物质①冰水混合物 ②新制氯水 ③
 ④盐酸 ⑤硫酸 ⑥熔融
④盐酸 ⑤硫酸 ⑥熔融 ⑦漂白粉 ⑧乙醇 以上物质属于纯净物的是
⑦漂白粉 ⑧乙醇 以上物质属于纯净物的是(2)某同学认真分析了氯水的反应:
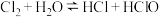 ,他的下列看法错误的是________
,他的下列看法错误的是________| A.该反应属于氧化还原反应 | B.新制氯水不易保存是因为次氯酸易分解 |
C.氯水有漂白性,因为氯水中含 | D.氯水中存在氯化氢分子 |
(3)适合用如图装置进行分离的是___________

| A.分离苯和氯化钠溶液 | B.除去氯化钠晶体中混有的氯化铵晶体 |
C.分离 中的 中的 | D.分离碳酸钡和氯化钡溶液 |
(4)某化学兴趣小组进行有关电解食盐水的探究实验,电解装置如图所示:

①实验约需
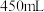 饱和食盐水,配制
饱和食盐水,配制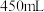 饱和食盐水所需的定量仪器有
饱和食盐水所需的定量仪器有②配制过程中,下列操作使得配制结果偏小的是
A.容量瓶在使用前未干燥,里面有少量蒸馏水
B.未去皮称重
C.未洗涤玻璃棒、烧杯
D.定容摇匀后发现液面低于容量瓶的刻度线,但未做任何处理
③电解饱和食盐水的离子方程式为:
(5)工业上制氯化氢是将氯气在氢气中燃烧,火焰呈
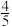 ,请说明液体未充满烧瓶的原因
,请说明液体未充满烧瓶的原因
(6)工业上用氯气和
您最近一年使用:0次
名校
7 . U、V、W、X、Y、Z是六种常见的前18号元素,且原子序数依次增大。已知U的一种核素的质量数为14,中子数为7;V的单核离子与 具有相同的质子、电子数目;W的电子层数与最外层电子数相等;X的最高正化合价和负化合价代数和为0;Y的最外层电子数是电子层数的2倍;Z的氢化物溶于水后形成的溶液是一种常见的强酸。请按要求回答下列问题:
具有相同的质子、电子数目;W的电子层数与最外层电子数相等;X的最高正化合价和负化合价代数和为0;Y的最外层电子数是电子层数的2倍;Z的氢化物溶于水后形成的溶液是一种常见的强酸。请按要求回答下列问题:
(1)W的正离子结构示意图:__________ ;X、Y、Z的原子半径由大到小依次为__________ ;X、Y的氧化物中共同存在的化学键类型是__________ 。
(2)化合物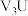 中正离子的电子式:
中正离子的电子式:__________ (填离子电子式); 的
的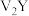 的电离方程式
的电离方程式__________ 。
 具有相同的质子、电子数目;W的电子层数与最外层电子数相等;X的最高正化合价和负化合价代数和为0;Y的最外层电子数是电子层数的2倍;Z的氢化物溶于水后形成的溶液是一种常见的强酸。请按要求回答下列问题:
具有相同的质子、电子数目;W的电子层数与最外层电子数相等;X的最高正化合价和负化合价代数和为0;Y的最外层电子数是电子层数的2倍;Z的氢化物溶于水后形成的溶液是一种常见的强酸。请按要求回答下列问题:(1)W的正离子结构示意图:
(2)化合物
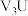 中正离子的电子式:
中正离子的电子式: 的
的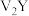 的电离方程式
的电离方程式
您最近一年使用:0次
名校
解题方法
8 . 在 溶液中加入氨水直至过量,可以形成配合物
溶液中加入氨水直至过量,可以形成配合物 。
。
(1) 的电离方程式为
的电离方程式为___________ 。
(2) 中,中心离子是
中,中心离子是___________ ,配体是___________ ,配位数为___________ 。
(3) 结构中,若用两个
结构中,若用两个 分子代替两个
分子代替两个 分子,可以得到两种不同结构的配合物离子,由此推测
分子,可以得到两种不同结构的配合物离子,由此推测 的空间构型为
的空间构型为___________ 形。
(4) 组成元素中电负性最大的元素是___________。
组成元素中电负性最大的元素是___________。
(5) 与
与 结合形成配合物离子后,其H-N-H的键角会
结合形成配合物离子后,其H-N-H的键角会___________ 。(填“变大”、“变小”或“不变”)
 溶液中加入氨水直至过量,可以形成配合物
溶液中加入氨水直至过量,可以形成配合物 。
。(1)
 的电离方程式为
的电离方程式为(2)
 中,中心离子是
中,中心离子是(3)
 结构中,若用两个
结构中,若用两个 分子代替两个
分子代替两个 分子,可以得到两种不同结构的配合物离子,由此推测
分子,可以得到两种不同结构的配合物离子,由此推测 的空间构型为
的空间构型为(4)
 组成元素中电负性最大的元素是___________。
组成元素中电负性最大的元素是___________。| A.H | B.N | C.S | D.O |
 与
与 结合形成配合物离子后,其H-N-H的键角会
结合形成配合物离子后,其H-N-H的键角会
您最近一年使用:0次
名校
9 . 25℃时,草酸 H2C2O4的 Ka1=5.6×10⁻2, Ka2=1.5×10⁻4,草酸钙 CaC2O4的 Ksp=4.0×10⁻8。回答以下问题:
(1)用标准浓度的草酸滴定未知浓度的 KMnO4溶液,可标定 KMnO4溶液的浓度。判断到达滴定终点的现象为___________ 。
(2)H2C2O4在水中的电离方程式___________ ;
(3)25℃时, NaHC2O4 溶液的 pH___________ 7 ( 选填“ > ”“ <” 或“ = ”), 通过计算说明原因:___________ 。
(4)25℃时,H2CO3的 Ka1=4.4×10⁻7, Ka2=4.7×10⁻11,写出少量草酸和过量碳酸钠溶液反应的离子方程式___________ 。
(5)25℃时,将 1 mL 某浓度的 H2C2O4溶液加水稀释,其溶液 pH 与稀释后溶液体积的关系如图所示。

① 图中能代表 H2C2O4溶液稀释情况的是___________ (选填“A: 曲线 I”或“B: 曲线 II”);
② 稀释过程中,下列量始终增大的是___________ 。
A、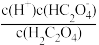 B、
B、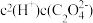 C、
C、 D、
D、
(6)25℃时,向 20 mL 0.1 mol·L-1的 NaHC2O4溶液中缓慢滴加 pH=13 的 NaOH 溶液,混合溶液的温度 T 与滴加 NaOH 溶液体积的关系如下图所示。
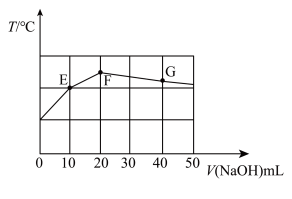
① 图中 E, F, G 三点中,水的电离程度最大的是___________ 点。
② 下列关系式中正确的是___________ 。
A.E 点存在 2c(Na+)=3c(H2C2O4)+3c(HC2O )+3c(C2O
)+3c(C2O )
)
B.F 点存在 c(H+)=c(OH-)+c(HC2O )+c(H2C2O4)
)+c(H2C2O4)
C.G 点存在 c(Na+)>c(OH-)>c(HC2O )>c(C2O
)>c(C2O )
)
(7)草酸钙结石是草酸和高钙食物在人体内形成的一种结石,计算下列反应的平衡常数: H2C2O4(aq)+Ca2+(aq)⇌CaC2O4(s)+2H+(aq),K=___________ 。(算出具体数值)
(1)用标准浓度的草酸滴定未知浓度的 KMnO4溶液,可标定 KMnO4溶液的浓度。判断到达滴定终点的现象为
(2)H2C2O4在水中的电离方程式
(3)25℃时, NaHC2O4 溶液的 pH
(4)25℃时,H2CO3的 Ka1=4.4×10⁻7, Ka2=4.7×10⁻11,写出少量草酸和过量碳酸钠溶液反应的离子方程式
(5)25℃时,将 1 mL 某浓度的 H2C2O4溶液加水稀释,其溶液 pH 与稀释后溶液体积的关系如图所示。

① 图中能代表 H2C2O4溶液稀释情况的是
② 稀释过程中,下列量始终增大的是
A、
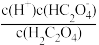 B、
B、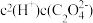 C、
C、 D、
D、
(6)25℃时,向 20 mL 0.1 mol·L-1的 NaHC2O4溶液中缓慢滴加 pH=13 的 NaOH 溶液,混合溶液的温度 T 与滴加 NaOH 溶液体积的关系如下图所示。

① 图中 E, F, G 三点中,水的电离程度最大的是
② 下列关系式中正确的是
A.E 点存在 2c(Na+)=3c(H2C2O4)+3c(HC2O
 )+3c(C2O
)+3c(C2O )
)B.F 点存在 c(H+)=c(OH-)+c(HC2O
 )+c(H2C2O4)
)+c(H2C2O4)C.G 点存在 c(Na+)>c(OH-)>c(HC2O
 )>c(C2O
)>c(C2O )
)(7)草酸钙结石是草酸和高钙食物在人体内形成的一种结石,计算下列反应的平衡常数: H2C2O4(aq)+Ca2+(aq)⇌CaC2O4(s)+2H+(aq),K=
您最近一年使用:0次
10 . 我国海洋资源十分丰富。随着科学技术的不断发展,可以通过淡化海水获取淡水、从海水中提取食盐、镁等重要的化学物质。镁是重要的国防金属,世界上60%的镁是从海水中提取的,下图是海水提镁的流程图:
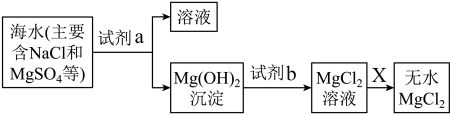
(1)试剂a可以为___________ (填“CaO”或“CaCO3”),该物质属于___________ 。
A.强电解质 B.非电解质 C.弱电解质 D.离子化合物
(2)上述流程中,由氯化镁溶液得到无水氯化镁的过程是将氯化镁溶液蒸发浓缩、冷却结晶,得到MgCl2·6H2O,后将该晶体在X气流中加热得到无水MgCl2,则X物质可能为___________。
(3)写出氢氧化镁和试剂b反应的离子方程式___________ 。
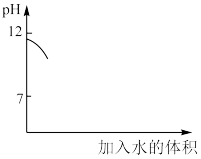
(4)常温下,取氢氧化镁悬浊液,加一定量的水进行稀释(稀释后仍为悬浊液),在下图中补全稀释过程中pH值随加入水的体积的变化示意图。___________
(5)在氢氧化镁悬浊液中加入CuSO4,现象为___________ ,写出该过程中的化学反应原理___________ 。(已知 、
、 )。
)。

(1)试剂a可以为
A.强电解质 B.非电解质 C.弱电解质 D.离子化合物
(2)上述流程中,由氯化镁溶液得到无水氯化镁的过程是将氯化镁溶液蒸发浓缩、冷却结晶,得到MgCl2·6H2O,后将该晶体在X气流中加热得到无水MgCl2,则X物质可能为___________。
| A.Cl2 | B.N2 | C.HCl | D.CO2 |
(4)常温下,取氢氧化镁悬浊液,加一定量的水进行稀释(稀释后仍为悬浊液),在下图中补全稀释过程中pH值随加入水的体积的变化示意图。

(5)在氢氧化镁悬浊液中加入CuSO4,现象为
 、
、 )。
)。
您最近一年使用:0次



