名校
解题方法
1 . 研究发现:塑料经过特殊改造后能够像金属一样具有导电性能。以聚乙炔为例,要使其能导电,必须用I2和Na等作掺杂处理,它们的掺杂过程可用通式表示如下:
①[CH]n+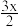 I2→[CH]
I2→[CH]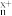 +x
+x ,
,
②[CH]n+xNa→[CH]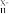 +xNa+
+xNa+
其中,用I2掺杂后的聚乙炔结构式如下图:
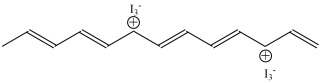
下列说法正确的是
①[CH]n+
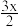 I2→[CH]
I2→[CH]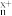 +x
+x ,
,②[CH]n+xNa→[CH]
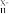 +xNa+
+xNa+其中,用I2掺杂后的聚乙炔结构式如下图:

下列说法正确的是
| A.掺杂前的聚乙炔结构中,单双键交替存在 |
| B.掺杂后的聚乙炔结构中,单双键交替形式与掺杂前一致 |
| C.在掺杂反应①②中,转移电子数都为xe- |
| D.掺杂反应①中,聚乙炔被还原;掺杂反应②中,聚乙炔被氧化 |
您最近一年使用:0次
2021-08-13更新
|
293次组卷
|
2卷引用:上海市2009年高中学生化学竞赛初赛试题
2 . Ⅰ.中学化学中几种常见物质的转化关系如图(部分产物未列出)。A是一种金属单质,D是一种非金属固体单质。

请回答下列问题:
(1)E既有氧化性又有还原性,写出E表现出氧化性的化学反应方程式:___________
(2)写出反应E+H2O2→F的化学方程式:___________
(3)若反应F+D→E转移的电子数为3.01×1023,则消耗D的质量为___________ g。
Ⅱ.氮气是一种常见的气体,其在一定条件下可以转化为氮氧化物NO、NO2等。
(4)NO、NO2均为有毒气体,可以把NO、NO2一起通入氢氧化钠溶液中进行尾气处理,得到一种常见的食品添加剂。写出该过程发生的离子方程式:___________
(5)把ag的Mg、Cu固体混合物加到足量的硝酸溶液中得到蓝色溶液和气体。所产生的气体与bL(标准状况)的O2一起通入水中得到只含硝酸的水溶液。往蓝色溶液中滴加氢氧化钠溶液至恰好完全沉淀,所得沉淀的质量为___________ g。(用a、b的代数式表示)
(6)金属Mg可以在NO2燃烧,产物可能为MgO、Mg3N2和N2.现有13.2g的Mg粉,在足量的NO2中充分燃烧,得到21.0g的固体和1120mL(标准状况)的气体。写出燃烧过程发生的化学方程式:___________

请回答下列问题:
(1)E既有氧化性又有还原性,写出E表现出氧化性的化学反应方程式:
(2)写出反应E+H2O2→F的化学方程式:
(3)若反应F+D→E转移的电子数为3.01×1023,则消耗D的质量为
Ⅱ.氮气是一种常见的气体,其在一定条件下可以转化为氮氧化物NO、NO2等。
(4)NO、NO2均为有毒气体,可以把NO、NO2一起通入氢氧化钠溶液中进行尾气处理,得到一种常见的食品添加剂。写出该过程发生的离子方程式:
(5)把ag的Mg、Cu固体混合物加到足量的硝酸溶液中得到蓝色溶液和气体。所产生的气体与bL(标准状况)的O2一起通入水中得到只含硝酸的水溶液。往蓝色溶液中滴加氢氧化钠溶液至恰好完全沉淀,所得沉淀的质量为
(6)金属Mg可以在NO2燃烧,产物可能为MgO、Mg3N2和N2.现有13.2g的Mg粉,在足量的NO2中充分燃烧,得到21.0g的固体和1120mL(标准状况)的气体。写出燃烧过程发生的化学方程式:
您最近一年使用:0次
解题方法
3 . 在碱性溶液中Na2Sx与NaClO反应,生成两种可溶盐溶液。在该混合液中加入BaCl2或AgNO3溶液都会生成不溶于稀酸的白色沉淀。经测试:1molNa2Sx与消耗6molNaOH恰好完全反应。x的值为._______ ;Na2Sx与NaClO反应的离子方程式是_______ 。
您最近一年使用:0次
4 . 已知二元化合物A可以用次氯酸钠和过量的氨气制得,6.4gA完全燃烧得到4.48L的氮气(已折算成标准状况)。A可以与新制Cu(OH)2反应生成砖红色沉淀,同时生成密度为1.25g·L-1的无色无味的气体(已折算成标准状况)。请回答下列问题:
(1) A的化学式为___________ 。
(2)写出次氯酸钠与过量氨气反应生成A的化学方程式___________ 。
A的制备过程中氨气需要过量的理由是___________ 。
(3)写出A与新制Cu(OH)2反应的化学方程式___________ 。
(4)已知在一定条件下,A可与等物质的量H2O2恰好完全反应得到化合物B, B所含元素与A相同,其摩尔质量小于A,实验表明,B可能存在两种异构体。
①B的电子式为___________ 。
②写出B的两种可能异构体的结构式___________ 、___________ 。
(1) A的化学式为
(2)写出次氯酸钠与过量氨气反应生成A的化学方程式
A的制备过程中氨气需要过量的理由是
(3)写出A与新制Cu(OH)2反应的化学方程式
(4)已知在一定条件下,A可与等物质的量H2O2恰好完全反应得到化合物B, B所含元素与A相同,其摩尔质量小于A,实验表明,B可能存在两种异构体。
①B的电子式为
②写出B的两种可能异构体的结构式
您最近一年使用:0次
名校
解题方法
5 . 回答下列问题:
I.双氧水和84消毒液是生活中常用的两种消毒剂。
(1)某同学设计如下实验研究H2O2的性质,能证明H2O2有还原性的实验是___________ (填序号),可作为证据的实验现象是___________ (填字母序号)。
(2)某届奥运会期间,由于工作人员将84消毒液与双氧水两种消毒剂混用,导致游泳池藻类快速生长,池水变绿。一种原因可能是NaClO与H2O2反应产生O2促进藻类快速生长。该反应说明氧化性:NaClO___________ H2O2(填“>”或“<”);当有0.1molO2生成时,转移电子的物质的量为___________ mol。
II.全球一半左右的碘是以智利硝石提取硝酸钠后的母液为原料,加入亚硫酸氢钠制取,相关反应如下,配平此化学方程式。___________
(3)_____NaIO3+______NaHSO3——_____NaHSO4+_______Na2SO4+_____I2+_____H2O
III.锑(Sb)被广泛用于生产各种阻燃剂、合金、陶瓷、半导体元件、医药用品等。以辉锑矿为原料制备金属锑的一种工艺流程如下。已知:辉锑矿的主要成分为Sb2S3,还含As2S5、PbS、CuO和SiO2等;浸出液主要含盐酸和SbCl3,还含SbCl5、CuCl2、AlCl3和PbCl2等。
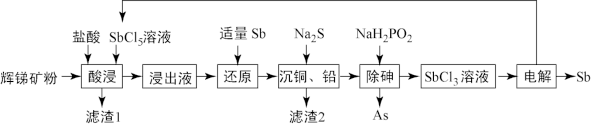
(4)“酸浸”过程中SbCl5和Sb2S3反应有S生成,该反应的还原产物是___________ (填化学式)。
(5)写出“还原”反应的化学方程式___________ 。
I.双氧水和84消毒液是生活中常用的两种消毒剂。
(1)某同学设计如下实验研究H2O2的性质,能证明H2O2有还原性的实验是
| 序号 | 实验 | 实验现象 |
| 1 | 向5%H2O2溶液中滴加酸性KMnO4溶液 | a.溶液紫色褪去; b.有大量气泡产生 |
| 2 | 向5%H2O2溶液中滴加淀粉碘化钾溶液 | c.溶液变蓝 |
(2)某届奥运会期间,由于工作人员将84消毒液与双氧水两种消毒剂混用,导致游泳池藻类快速生长,池水变绿。一种原因可能是NaClO与H2O2反应产生O2促进藻类快速生长。该反应说明氧化性:NaClO
II.全球一半左右的碘是以智利硝石提取硝酸钠后的母液为原料,加入亚硫酸氢钠制取,相关反应如下,配平此化学方程式。
(3)_____NaIO3+______NaHSO3——_____NaHSO4+_______Na2SO4+_____I2+_____H2O
III.锑(Sb)被广泛用于生产各种阻燃剂、合金、陶瓷、半导体元件、医药用品等。以辉锑矿为原料制备金属锑的一种工艺流程如下。已知:辉锑矿的主要成分为Sb2S3,还含As2S5、PbS、CuO和SiO2等;浸出液主要含盐酸和SbCl3,还含SbCl5、CuCl2、AlCl3和PbCl2等。

(4)“酸浸”过程中SbCl5和Sb2S3反应有S生成,该反应的还原产物是
(5)写出“还原”反应的化学方程式
您最近一年使用:0次
2021-07-28更新
|
1112次组卷
|
3卷引用:吉林省长春希望高中2020-2021学年高二下学期期末考试化学试题
6 . 科学家对络合氢化物的储氢特性进行了系列研究。
(1) LiA1H4在不同温度下分解放氢反应为:
当温度为160 ℃ - 180 ℃时,反应1: 3LiAIH6= Li3AlH6+2A1+3H2
当温度为180 ℃ -220 ℃时,反应2: Li3AlH6=3LiH+A1+3/2H2
上述两步反应总的放氢量是_______ (放氢量即为氢元素的质量占总质量的百分含量)。
(2)已知Mg(A1H4)2在400 ℃ 下分解,理论上放氢量为9.34%现取4.316gMg(AlH4)2在该温度下分解生成1.798g单质Al和一种金属互化物。写出该反应的化学方程式_______ 。
(1) LiA1H4在不同温度下分解放氢反应为:
当温度为160 ℃ - 180 ℃时,反应1: 3LiAIH6= Li3AlH6+2A1+3H2
当温度为180 ℃ -220 ℃时,反应2: Li3AlH6=3LiH+A1+3/2H2
上述两步反应总的放氢量是
(2)已知Mg(A1H4)2在400 ℃ 下分解,理论上放氢量为9.34%现取4.316gMg(AlH4)2在该温度下分解生成1.798g单质Al和一种金属互化物。写出该反应的化学方程式
您最近一年使用:0次
7 . Ⅰ.如图所示,一密闭容器被无摩擦可滑动的两隔板a和b分成甲、乙两室。标准状况下,在乙室中充入0.6 mol HCl,甲室中充入NH3、H2的混合气体,静止时活塞位置如下图。已知甲、乙两室中气体的质量之差为10.9 g。

(1)甲室中NH3、H2的物质的量之比为___________ ,质量之比为___________ 。
(2)甲室中气体的物质的量为___________ mol。
(3)甲室中气体的质量为___________ g。
(4)将隔板a去掉,发生下列反应:HCl(g)+NH3(g)=NH4Cl(s),当HCl与NH3完全反应后,活塞b将位于刻度“___________ ”处(填数字)。
Ⅱ.(1)向mg镁和铝的混合物中加入适量的稀硫酸,恰好完全反应生成标准状况下的气体bL。向反应后的溶液中加入c mol/L氢氧化钾溶液V mL,使金属离子刚好沉淀完全,得到的沉淀质量为n g。再将得到的沉淀灼烧至质量不再改变为止,得到固体p g。则下列关系不正确的是___________ 。
A. p=m+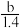 B.p=m+
B.p=m+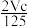 C.n=m+
C.n=m+ D. n=m+
D. n=m+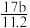
(2)一定体积的KMnO4溶液恰好能氧化一定质量的KHC2O4·H2C2O4·2H2O。若用0.1000mol·L-1的NaOH溶液中和相同质量的KHC2O4·H2C2O4·2H2O,所需NaOH溶液的体积恰好为KMnO4溶液的3倍,则KMnO4溶液的浓度(mol·L-1)为___________ 。提示:①H2C2O4是二元弱酸 ②10KHC2O4·H2C2O4+8KMnO4+17H2SO4=8MnSO4+9K2SO4+40CO2↑+32H2O

(1)甲室中NH3、H2的物质的量之比为
(2)甲室中气体的物质的量为
(3)甲室中气体的质量为
(4)将隔板a去掉,发生下列反应:HCl(g)+NH3(g)=NH4Cl(s),当HCl与NH3完全反应后,活塞b将位于刻度“
Ⅱ.(1)向mg镁和铝的混合物中加入适量的稀硫酸,恰好完全反应生成标准状况下的气体bL。向反应后的溶液中加入c mol/L氢氧化钾溶液V mL,使金属离子刚好沉淀完全,得到的沉淀质量为n g。再将得到的沉淀灼烧至质量不再改变为止,得到固体p g。则下列关系不正确的是
A. p=m+
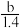 B.p=m+
B.p=m+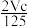 C.n=m+
C.n=m+ D. n=m+
D. n=m+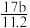
(2)一定体积的KMnO4溶液恰好能氧化一定质量的KHC2O4·H2C2O4·2H2O。若用0.1000mol·L-1的NaOH溶液中和相同质量的KHC2O4·H2C2O4·2H2O,所需NaOH溶液的体积恰好为KMnO4溶液的3倍,则KMnO4溶液的浓度(mol·L-1)为
您最近一年使用:0次
8 . 根据英国地质调查局的报告,我国是世界上锑产量最大的国家,产量占全球的84%。锑在自然界中主要存在于辉锑矿(Sb2S3)中,湖南省冷水江市的锡矿山是世界最大锑矿,估计储量为210万吨。
(1)写出锑原子的核外电子排布,并以此判断其最常见的三个化合价:_______ 。
(2)在一些安全火柴的火柴头中使用了三硫化二锑。写出其燃烧时的化学反应方程式:_______ 。
(3)锑有两种常见氟化物。取其高价态的氟化物,在它的HF溶液中慢慢加入H2O2,得锑含量为44.97%的白色离子化合物A,其阴离子呈八面体结构。A的结构简式为_______ ,A不稳定,易缓慢分解为B和某种气体,写出生成B的化学方程式:_______ 。
(1)写出锑原子的核外电子排布,并以此判断其最常见的三个化合价:
(2)在一些安全火柴的火柴头中使用了三硫化二锑。写出其燃烧时的化学反应方程式:
(3)锑有两种常见氟化物。取其高价态的氟化物,在它的HF溶液中慢慢加入H2O2,得锑含量为44.97%的白色离子化合物A,其阴离子呈八面体结构。A的结构简式为
您最近一年使用:0次
解题方法
9 . 硫脲[CS(NH2)2]在药物制备、金属矿物浮选等有很广泛的应用,可利用Ca(HS)2与CaCN2合成得到。查阅资料:①CS(NH2)2易溶于水;②CS(NH2)2在150℃时生成NHSCN;③CS(NH2)2易被强氧化剂氧化。请回答下列问题:
(1)制备Ca(HS)2溶液

①装置A中发生反应的离子方程式为_______ ;
②装置B中盛装的试剂是_______ ;
③装置C中长直导管的作用是_______ ,当C中出现_______ 现象时,可停止反应。
(2)制备硫脲[CS(NH2)2]。将得到的Ca(HS)2溶液与CaCN2溶液混合,加热至80℃,反应一段时间即可生成硫脲,同时生成一种强碱_______ ,合适的加热方式是_______ 。
(3)硫脲的定量测定。用酸性高锰酸钾溶液滴定硫脲,生成N2, 等,则氧化剂与还原剂的物质的量之比为
等,则氧化剂与还原剂的物质的量之比为_______ ;将硫脲粗产品0.4g,配成500mL溶液,取50mL,用0.1mol/L酸性高锰酸钾溶液滴定,消耗酸性高锰酸钾14.00mL,粗产品中硫脲的含量为_______ (杂质不参加反应)。
(1)制备Ca(HS)2溶液

①装置A中发生反应的离子方程式为
②装置B中盛装的试剂是
③装置C中长直导管的作用是
(2)制备硫脲[CS(NH2)2]。将得到的Ca(HS)2溶液与CaCN2溶液混合,加热至80℃,反应一段时间即可生成硫脲,同时生成一种强碱
(3)硫脲的定量测定。用酸性高锰酸钾溶液滴定硫脲,生成N2,
 等,则氧化剂与还原剂的物质的量之比为
等,则氧化剂与还原剂的物质的量之比为
您最近一年使用:0次
解题方法
10 . Mn2+离子是KMnO4溶液氧化H2C2O4的催化剂。有人提出该反应的历程为:
Mn(VII)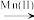 Mn(VI)
Mn(VI)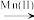 Mn(IV)
Mn(IV)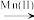 Mn(III)
Mn(III)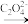 Mn(C2O4)
Mn(C2O4)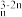 →Mn2++CO2
→Mn2++CO2
请设计2个实验方案来验证这个历程是可信的(无须给出实验装置,无须指出选用的具体试剂,只需给出设计思想)_______ 。
Mn(VII)
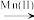 Mn(VI)
Mn(VI)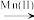 Mn(IV)
Mn(IV)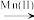 Mn(III)
Mn(III)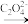 Mn(C2O4)
Mn(C2O4)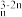 →Mn2++CO2
→Mn2++CO2请设计2个实验方案来验证这个历程是可信的(无须给出实验装置,无须指出选用的具体试剂,只需给出设计思想)
您最近一年使用:0次



