1 . 向200mL稀 与稀
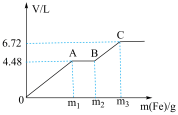
与稀 的混合溶液中逐渐加入铁粉,假设加入铁粉的质量与产生气体的体积(标准状况下)之间的关系如图所示,且曲线中每一段只对应一个反应。下列说法错误的是
的混合溶液中逐渐加入铁粉,假设加入铁粉的质量与产生气体的体积(标准状况下)之间的关系如图所示,且曲线中每一段只对应一个反应。下列说法错误的是
 与稀
与稀 的混合溶液中逐渐加入铁粉,假设加入铁粉的质量与产生气体的体积(标准状况下)之间的关系如图所示,且曲线中每一段只对应一个反应。下列说法错误的是
的混合溶液中逐渐加入铁粉,假设加入铁粉的质量与产生气体的体积(标准状况下)之间的关系如图所示,且曲线中每一段只对应一个反应。下列说法错误的是
A.混合溶液中 的物质的量浓度为1 mol/L 的物质的量浓度为1 mol/L |
| B.若向铜粉中加入100mL上述混合溶液,最多能溶解19.2g铜 |
C.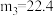 |
D.每一阶段反应转移电子数目之比为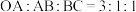 |
您最近一年使用:0次
解题方法
2 . 某小组探究铜与浓硝酸的反应。
【实验】
(1)铜与浓硝酸反应的化学方程式是_______ ,氢氧化钠溶液的作用是_______ 。
小组同学继续探究溶液呈鲜草绿色的原因。
甲同学提出猜想:因为气体溶解后,溶液颜色和气体颜色叠加形成鲜草绿色,设计实1-1及1-2进行验证。
实验1-1:取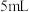 反应后混合液于一支试管内,按一定的气体流速将
反应后混合液于一支试管内,按一定的气体流速将 和
和 混合气体通入,有大量红棕色气体逸出,约
混合气体通入,有大量红棕色气体逸出,约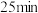 后溶液转为蓝色。
后溶液转为蓝色。
实验1-2:取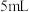 反应后混合液于另一支试管内,按与实验1-1中相同的气体流速将空气通入,有大量红棕色气体逸出,约
反应后混合液于另一支试管内,按与实验1-1中相同的气体流速将空气通入,有大量红棕色气体逸出,约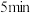 后溶液转为蓝色
后溶液转为蓝色
(2)乙同学根据以上2个实验的现象证明甲同学的猜想不成立,依据的现象是_______ 。
【查阅资料】
i.铜与浓硝酸反应,开始生成的 溶于水生成
溶于水生成 ,
, 与Cu2+反应生成绿色的化合物;
与Cu2+反应生成绿色的化合物;
ii.一定条件下,Cu2+既可以表现氧化性,又可以表现还原性;
iii.尿素 具有温和的抗氧化性;
具有温和的抗氧化性;
iv.金属和浓硝酸反应过程中有 生成,可大大加快金属与浓硝酸反应的速率。
生成,可大大加快金属与浓硝酸反应的速率。
其原理为:
第一步: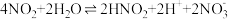
第二步: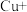 …
…
第三步:
【设计实验】
分别向四支试管内依次加入下列试剂后,同时插入铜丝并记录实验现象。
(3)补全iv中原理的第二步反应:_______ 。
(4)实验2-3中没有绿色出现的原因是_______ 。
(5)因为发生化学反应:_______ 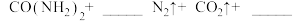 ,因此实验2-4中反应速率较慢。
,因此实验2-4中反应速率较慢。
(6)解释实验1-1和1-2的现象差异原因_______ 。
【实验】
| 实验装置(夹特仪器略) | 实验现象 |
 | 铜片溶解,最初反应较慢,随后加快,有大量红棕色气体放出,反应后试管中溶液呈现鲜草绿色 |
小组同学继续探究溶液呈鲜草绿色的原因。
甲同学提出猜想:因为气体溶解后,溶液颜色和气体颜色叠加形成鲜草绿色,设计实1-1及1-2进行验证。
实验1-1:取
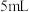 反应后混合液于一支试管内,按一定的气体流速将
反应后混合液于一支试管内,按一定的气体流速将 和
和 混合气体通入,有大量红棕色气体逸出,约
混合气体通入,有大量红棕色气体逸出,约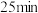 后溶液转为蓝色。
后溶液转为蓝色。实验1-2:取
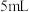 反应后混合液于另一支试管内,按与实验1-1中相同的气体流速将空气通入,有大量红棕色气体逸出,约
反应后混合液于另一支试管内,按与实验1-1中相同的气体流速将空气通入,有大量红棕色气体逸出,约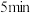 后溶液转为蓝色
后溶液转为蓝色(2)乙同学根据以上2个实验的现象证明甲同学的猜想不成立,依据的现象是
【查阅资料】
i.铜与浓硝酸反应,开始生成的
 溶于水生成
溶于水生成 ,
, 与Cu2+反应生成绿色的化合物;
与Cu2+反应生成绿色的化合物;ii.一定条件下,Cu2+既可以表现氧化性,又可以表现还原性;
iii.尿素
 具有温和的抗氧化性;
具有温和的抗氧化性;iv.金属和浓硝酸反应过程中有
 生成,可大大加快金属与浓硝酸反应的速率。
生成,可大大加快金属与浓硝酸反应的速率。其原理为:
第一步:
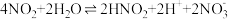
第二步:
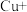 …
…第三步:

【设计实验】
分别向四支试管内依次加入下列试剂后,同时插入铜丝并记录实验现象。
| 编号 | 浓硝酸 | 蒸馏水/滴 | 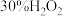 /滴 /滴 |  尿素溶液/滴 尿素溶液/滴 | 现象 |
| 2-1 | 1 | 0 | 0 | 0 | 快速反应,异常剧烈,溶液为鲜草绿色 |
| 2-2 | 1 | 3 | 0 | 0 | 快速反应,异常剧烈,溶液为鲜草绿色 |
| 2-3 | 1 | 0 | 3 | 0 | 反应较慢,溶液为蓝色,没有绿色出现 |
| 2-4 | 1 | 0 | 0 | 3 | 反应较慢,溶液为蓝色,没有绿色出现 |
(4)实验2-3中没有绿色出现的原因是
(5)因为发生化学反应:
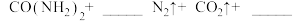 ,因此实验2-4中反应速率较慢。
,因此实验2-4中反应速率较慢。(6)解释实验1-1和1-2的现象差异原因
您最近一年使用:0次
解题方法
3 . 将一定量铁粉和铜粉混合均匀后分为四等份,分别加入同浓度的稀硝酸,充分反应,在标准状况下生成 的体积和剩余金属的质量如表所示(设
的体积和剩余金属的质量如表所示(设 的还原产物只有
的还原产物只有 ):
):
下列说法错误的是
 的体积和剩余金属的质量如表所示(设
的体积和剩余金属的质量如表所示(设 的还原产物只有
的还原产物只有 ):
):| 实验序号 | Ⅰ | Ⅱ | Ⅲ | Ⅳ |
稀硝酸的体积/ | 50 | 100 | 150 | 175 |
| 剩余金属的质量/g | 9.0 | 4.8 | 0 | 0 |
 的体积(标准状况)/ 的体积(标准状况)/ | 1120 | 2240 | 3360 | V |
A.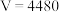 |
B.每等份混合物的质量为 |
C.稀硝酸的物质的量的浓度为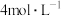 |
D.实验Ⅰ中发生反应的化学方程式为 |
您最近一年使用:0次
2023-04-27更新
|
772次组卷
|
2卷引用:河北省邢台市2022-2023学年高一下学期期中考试化学试题
名校
解题方法
4 . 探究硫及其化合物的性质,下列方案设计、现象和结论中有不正确的是
实验方案 | 现象 | 结论 | |
A | 在过硫化钠(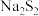 )中加入稀盐酸 )中加入稀盐酸 | 产生淡黄色沉淀和臭鸡蛋气味的气体。 | 发生歧化反应: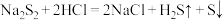 |
B | 已知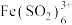 呈红棕色,将 呈红棕色,将 气体通入 气体通入 溶液中 溶液中 | 溶液先变为红棕色,过一段时间又变成浅绿色。 |  与 与 络合反应速率比氧化还原反应速率快,但氧化还原反应的平衡常数更大。 络合反应速率比氧化还原反应速率快,但氧化还原反应的平衡常数更大。 |
C | 燃着的镁条插入盛有 的集气瓶中。冷却后,往集气瓶中加入适量稀盐酸,静置,取少量上层清液于试管中,滴加少量 的集气瓶中。冷却后,往集气瓶中加入适量稀盐酸,静置,取少量上层清液于试管中,滴加少量 溶液。 溶液。 | 剧烈燃烧,集气瓶口有淡黄色固体附着,集气瓶底有白色固体生成。试管中没有产生黑色沉淀 | 镁能在 中燃烧: 中燃烧: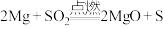 |
D | 探究电石与水的反应 | 将电石与饱和食盐水反应产生的气体通入酸性高锰酸钾溶液,观察现象 | 若酸性高锰酸钾溶液褪色,说明电石与水反应生成了乙炔 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-04-22更新
|
1947次组卷
|
6卷引用:浙江省天域全国名校协作体2022-2023学年高三下学期4月阶段性联考化学试题
浙江省天域全国名校协作体2022-2023学年高三下学期4月阶段性联考化学试题重庆市万州第二高级中学2023-2024学年高三上学期7月月考化学试题(已下线)考点48 实验方案设计与评价(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)湖南省长沙市第一中学2023-2024学年高三上学期月考卷(三)化学试题江西省抚州市乐安县第二中学2023-2024学年高三上学期11月期中化学试题2024年山东省潍坊市高三下学期高考模拟训练调研试题(二)
名校
解题方法
5 . 将1.52 g铜镁合金完全溶解于50 mL密度为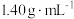 、质量分数为63%的浓硝酸中,得到
、质量分数为63%的浓硝酸中,得到 和
和 的混合气体0.05 mol,向反应后的溶液中加入
的混合气体0.05 mol,向反应后的溶液中加入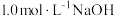 溶液,当金属离子全部沉淀时,得到2.54 g沉淀。下列说法不正确的是
溶液,当金属离子全部沉淀时,得到2.54 g沉淀。下列说法不正确的是
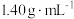 、质量分数为63%的浓硝酸中,得到
、质量分数为63%的浓硝酸中,得到 和
和 的混合气体0.05 mol,向反应后的溶液中加入
的混合气体0.05 mol,向反应后的溶液中加入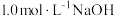 溶液,当金属离子全部沉淀时,得到2.54 g沉淀。下列说法不正确的是
溶液,当金属离子全部沉淀时,得到2.54 g沉淀。下列说法不正确的是| A.该合金中铜与镁的物质的量之比是2:1 |
B.该浓硝酸中 的物质的量浓度是 的物质的量浓度是 |
C. 和 和 的混合气体中, 的混合气体中, 的体积分数是20% 的体积分数是20% |
| D.得到2.54 g沉淀时,加入NaOH溶液的体积是660 mL |
您最近一年使用:0次
23-24高一上·浙江·期末
6 . 将一定量的铁和铜组成的混合物加入稀硝酸中,金属完全溶解(假设反应中还原产物只有NO)。向反应后的溶液中加入3mol·L-1NaOH溶液至沉淀完全,测得生成沉淀的质量比原合金的质量增加5.1g。下列叙述不正确的是
| A.当生成的沉淀量达到最大时,消耗NaOH溶液的体积V≥100mL |
| B.当金属全部溶解时收集到NO气体的体积折算成标准状况为2.24L |
| C.参加反应的金属的总质量3.6g<m<9.6g |
| D.当金属全部溶解时,参加反应的硝酸的物质的量一定是0.3mol |
您最近一年使用:0次
名校
解题方法
7 . 化学让生活更美好,各类水处理剂能让水质得到提升达到饮用水的标准。生活中较常见的水处理剂有:氯气、次氯酸钠、漂白粉(主要成分为次氯酸钙)、二氧化氯、明矾、硫酸铁、高铁酸钠等等。
(1)氯气常用于自来水的消毒,请写出舍勒研究软锰矿时发现氯气的化学方程式:___________ 。
(2)氯气能用于制备易于保存、使用方便的漂白液,但若温度过高会发生副反应生成NaCl、NaClO3。请写出在加热时,当NaOH与Cl2反应生成的n(NaClO):n(NaClO3)=5:1时,NaOH与Cl2反应的化学方程式:___________ 。
(3)下列有关水资源及水质净化的说法,不正确的是___________(填序号)。
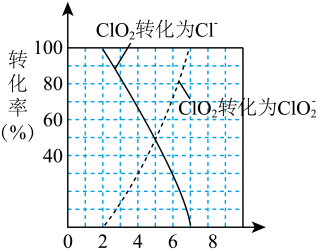
(4)近年来有科学家提出,氯气消毒时,会与水中的有机物发生反应,生成的有机氯化物可能对人体有害。因此,人们已开始研究并试用新的自来水消毒剂,如二氧化氯(ClO2)、臭氧等。ClO2被世界卫生组织(WHO)列为A级高效、安全灭菌消毒剂,将逐渐取代Cl2成为自来水的消毒剂。ClO2气体具有强氧化性,其还原产物ClO 、Cl﹣的转化率与pH关系如图所示。ClO2对污水中S2﹣、CN﹣等也有明显的去除效果,请写出pH≤2时,ClO2与S2﹣反应的离子方程式:
、Cl﹣的转化率与pH关系如图所示。ClO2对污水中S2﹣、CN﹣等也有明显的去除效果,请写出pH≤2时,ClO2与S2﹣反应的离子方程式:___________ 。某工厂污水中含CN﹣amg/L,现用ClO2将CN﹣氧化,生成了两种无毒无害的气体,处理50m3这种污水,至少需要ClO2___________ mol。
(5)高铁酸钠(Na2FeO4)在水中既能消毒杀菌,其产物Fe(OH)3胶体又能净水除去悬浮杂质,是一种理想的水处理剂。如果以单位质量的氧化剂所得到的电子数来表示消毒效率,那么,Cl2、ClO2(pH≤2时)、Na2FeO4三种消毒杀菌剂的消毒效率由大到小的顺序是___________ 。
(1)氯气常用于自来水的消毒,请写出舍勒研究软锰矿时发现氯气的化学方程式:
(2)氯气能用于制备易于保存、使用方便的漂白液,但若温度过高会发生副反应生成NaCl、NaClO3。请写出在加热时,当NaOH与Cl2反应生成的n(NaClO):n(NaClO3)=5:1时,NaOH与Cl2反应的化学方程式:
(3)下列有关水资源及水质净化的说法,不正确的是___________(填序号)。
| A.将自来水煮沸烧开后再饮用更健康、因为能除去残留的Cl2及溶于其中的Cl﹣ |
| B.自来水用于洗涤后得到的含磷污水是很好的肥料,可灌溉庄稼,能直接排放到自然界水体中 |
| C.煤、石油的燃烧和汽车排放的尾气都会引起大气污染,且会出现酸雨等环境问题 |
| D.纳米铁粉可以高效地去除被污染水体中的Pb2+、Cu2+、Cd2+、Hg2+等重金属离子,其本质是纳米铁粉对重金属离子有较强的物理吸附 |
 、Cl﹣的转化率与pH关系如图所示。ClO2对污水中S2﹣、CN﹣等也有明显的去除效果,请写出pH≤2时,ClO2与S2﹣反应的离子方程式:
、Cl﹣的转化率与pH关系如图所示。ClO2对污水中S2﹣、CN﹣等也有明显的去除效果,请写出pH≤2时,ClO2与S2﹣反应的离子方程式:(5)高铁酸钠(Na2FeO4)在水中既能消毒杀菌,其产物Fe(OH)3胶体又能净水除去悬浮杂质,是一种理想的水处理剂。如果以单位质量的氧化剂所得到的电子数来表示消毒效率,那么,Cl2、ClO2(pH≤2时)、Na2FeO4三种消毒杀菌剂的消毒效率由大到小的顺序是

您最近一年使用:0次
8 . 下列实验能得出相关结论的是
| 实验操作 | 实验结论 | |
| A | 向NaHA溶液中滴加紫色石蕊溶液,溶液变为蓝色 | Kw>Ka1(H2A)·Ka2(H2A) |
| B | 常温下将铝片投入浓硝酸中,无明显现象 | 铝与浓硝酸不反应 |
| C | 向10mL0.1mol·L-1FeCl3溶液中加入5mL0.1mol·L-1KSCN溶液,溶液显红色,再滴加少量1mol·L-1KSCN溶液,红色加深 | Fe3+和SCN-的反应是可逆反应 |
| D | 向FeCl2溶液中滴加少量的酸性KMnO4溶液,KMnO4溶液褪色 | 氧化性: >Cl2 >Cl2 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
解题方法
9 . 将一定量的氯气通入 的氢氧化钾浓溶液中,加热少许时间后,恰好完全反应,测得溶液中含氯元素的离子有:
的氢氧化钾浓溶液中,加热少许时间后,恰好完全反应,测得溶液中含氯元素的离子有: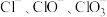 。下列说法
。下列说法不正确 的是
 的氢氧化钾浓溶液中,加热少许时间后,恰好完全反应,测得溶液中含氯元素的离子有:
的氢氧化钾浓溶液中,加热少许时间后,恰好完全反应,测得溶液中含氯元素的离子有: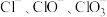 。下列说法
。下列说法A.一共消耗了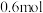 氯气 氯气 |
B.当溶液中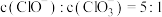 时,反应的离子方程式为: 时,反应的离子方程式为: |
C.若反应中转移的电子为 ,则 ,则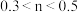 |
D.反应生成的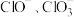 有一定的氧化性 有一定的氧化性 |
您最近一年使用:0次
2023-02-16更新
|
1015次组卷
|
2卷引用:广东省大湾区2022-2023学年高一上学期期末联考化学试题
解题方法
10 . 中国自古有“信口雌黄”、“雄黄入药”之说。雌黄 和雄黄
和雄黄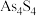 都是自然界中常见的砷化物,早期都曾用作绘画颜料,因都有抗病毒疗效也用来入药。
都是自然界中常见的砷化物,早期都曾用作绘画颜料,因都有抗病毒疗效也用来入药。
(1)砷元素有 、
、 两种常见价态。一定条件下,雌黄和雄黄的转化关系如图所示。
两种常见价态。一定条件下,雌黄和雄黄的转化关系如图所示。
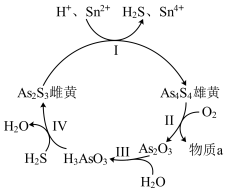
①I中氧化剂是________________________ (填化学式)。
②Ⅱ中若 反应,转移
反应,转移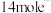 ,写出Ⅱ的化学方程式:
,写出Ⅱ的化学方程式:____________ 。
(2)Ⅲ中产物亚砷酸 可以用于治疗白血病,其在溶液中存在多种微粒形态,各种微粒物质的量分数与溶液的
可以用于治疗白血病,其在溶液中存在多种微粒形态,各种微粒物质的量分数与溶液的 关系如图所示。
关系如图所示。
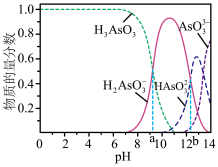
①人体血液的 在7.35~7.45之间,用药后人体中含砷元素的主要微粒是
在7.35~7.45之间,用药后人体中含砷元素的主要微粒是____________ (填化学式)。
②将 溶液滴入
溶液滴入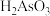 溶液,在溶液pH由8变至10的过程中,发生反应的离子方程式是
溶液,在溶液pH由8变至10的过程中,发生反应的离子方程式是____________ 。
(3)P与 属于同主族元素,亚磷酸二氢钾
属于同主族元素,亚磷酸二氢钾 是一种杀菌消毒剂。已知:常温下,
是一种杀菌消毒剂。已知:常温下, 的电离常数
的电离常数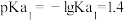 ;
;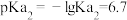 ;
; 。以
。以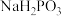 和
和 为原料制备
为原料制备 和
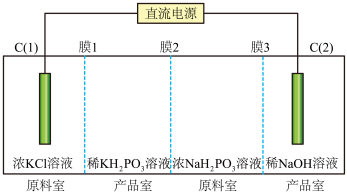
和 的装置如图。
的装置如图。
①已知 与足量的
与足量的 溶液反应生成
溶液反应生成 ,由此推知
,由此推知 是
是____________ (填“正”或“酸式”)盐。
②常温下 溶液
溶液
____________ 7(填“>”、“<”或“=”)。
③膜2为____________ (填“阴”或“阳”)离子交换膜, 电极上发生的电极反应式为:
电极上发生的电极反应式为:____ 。
 和雄黄
和雄黄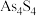 都是自然界中常见的砷化物,早期都曾用作绘画颜料,因都有抗病毒疗效也用来入药。
都是自然界中常见的砷化物,早期都曾用作绘画颜料,因都有抗病毒疗效也用来入药。(1)砷元素有
 、
、 两种常见价态。一定条件下,雌黄和雄黄的转化关系如图所示。
两种常见价态。一定条件下,雌黄和雄黄的转化关系如图所示。
①I中氧化剂是
②Ⅱ中若
 反应,转移
反应,转移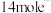 ,写出Ⅱ的化学方程式:
,写出Ⅱ的化学方程式:(2)Ⅲ中产物亚砷酸
 可以用于治疗白血病,其在溶液中存在多种微粒形态,各种微粒物质的量分数与溶液的
可以用于治疗白血病,其在溶液中存在多种微粒形态,各种微粒物质的量分数与溶液的 关系如图所示。
关系如图所示。
①人体血液的
 在7.35~7.45之间,用药后人体中含砷元素的主要微粒是
在7.35~7.45之间,用药后人体中含砷元素的主要微粒是②将
 溶液滴入
溶液滴入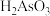 溶液,在溶液pH由8变至10的过程中,发生反应的离子方程式是
溶液,在溶液pH由8变至10的过程中,发生反应的离子方程式是(3)P与
 属于同主族元素,亚磷酸二氢钾
属于同主族元素,亚磷酸二氢钾 是一种杀菌消毒剂。已知:常温下,
是一种杀菌消毒剂。已知:常温下, 的电离常数
的电离常数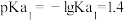 ;
;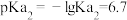 ;
; 。以
。以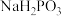 和
和 为原料制备
为原料制备 和
和 的装置如图。
的装置如图。
①已知
 与足量的
与足量的 溶液反应生成
溶液反应生成 ,由此推知
,由此推知 是
是②常温下
 溶液
溶液
③膜2为
 电极上发生的电极反应式为:
电极上发生的电极反应式为:
您最近一年使用:0次



