名校
解题方法
1 . 向FeI2、FeBr2的混合溶液中通入适量的氯气,溶液中某些离子的物质的量变化如下图所示。下列有关说法中正确的是
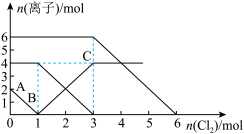

| A.离子的还原性顺序为:Fe2+>Br->I- |
| B.原混合溶液中FeBr2的物质的量为4mol |
| C.原溶液中:n(Fe2+)∶n(I-)∶n(Br-)=2∶1∶3 |
| D.当通入2 mol Cl2时,溶液中发生的离子反应可表示为:2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl- |
您最近一年使用:0次
2016-12-09更新
|
1854次组卷
|
7卷引用:2016届河南省西华县第一高级中学高三上学期10月联考化学试卷
名校
解题方法
2 . 已知X为FeO和CuO的混合物,取两份等质量的X样品进行下列实验:设第3步所得固体D 的质量为32g,溶液E中只含有一种金属离子,气体F在标准状况下体积为5.6 L,则X中FeO与CuO的物质的 量之比为
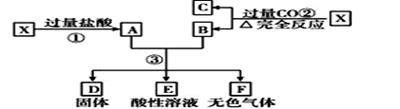

| A.4:1 | B.1:2 | C.2:1 | D.1:1 |
您最近一年使用:0次
解题方法
3 . 铬铁矿的主要成分可表示为FeO·Cr2O3,还含有SiO2、Al2O3、Fe2O3等杂质。以铬铁矿为原料制备重铬酸钾(K2Cr2O7)、重铬酸钠(Na2Cr2O7)的过程如下图所示。
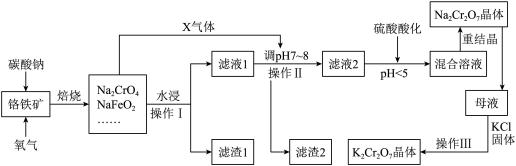
已知:①NaFeO2遇水强烈水解:NaFeO2 + 2H2O=NaOH + Fe(OH)3↓;
②Cr2O72-+ H2O 2CrO42- + 2H+。
2CrO42- + 2H+。
请回答:
(1)“焙烧”后的固体产物成分除Na2CrO4、NaFeO2外,还有__________ (填化学式)
等。写出“焙烧”过程中所发生的氧化还原反应的化学方程式_____________________ 。
(2)“焙烧”过程中,所产生X气体的电子式为_________________________ 。
(3)“水浸”步骤中,为了提高浸出率,可采取的措施有(请写出两条):_____ ;_____ 。
(4)滤渣1的主要成分是_______________ 。若要进一步分离滤渣2 中的可酸溶成分,请写出酸溶时发生反应的离子方程式_________________________________________ 。
(5)含Na2Cr2O7的“混合溶液”经过蒸发并冷却至30~40℃得到的Na2Cr2O7晶体还要进行重结晶,其目的是进一步减少晶体中杂质__________ (填化学式)的含量。
(6)操作Ⅲ由多步组成,向含Na2Cr2O7的母液中加入KCl固体,最终获得K2Cr2O7晶体的操作依次是____________ 、__________ 、过滤、75%乙醇水溶液洗涤、干燥。

已知:①NaFeO2遇水强烈水解:NaFeO2 + 2H2O=NaOH + Fe(OH)3↓;
②Cr2O72-+ H2O
 2CrO42- + 2H+。
2CrO42- + 2H+。请回答:
(1)“焙烧”后的固体产物成分除Na2CrO4、NaFeO2外,还有
等。写出“焙烧”过程中所发生的氧化还原反应的化学方程式
(2)“焙烧”过程中,所产生X气体的电子式为
(3)“水浸”步骤中,为了提高浸出率,可采取的措施有(请写出两条):
(4)滤渣1的主要成分是
(5)含Na2Cr2O7的“混合溶液”经过蒸发并冷却至30~40℃得到的Na2Cr2O7晶体还要进行重结晶,其目的是进一步减少晶体中杂质
(6)操作Ⅲ由多步组成,向含Na2Cr2O7的母液中加入KCl固体,最终获得K2Cr2O7晶体的操作依次是
您最近一年使用:0次
名校
解题方法
4 . 将一定质量的铁、氧化铁、氧化铜的混合物粉末放入100 mL4.40 mol/L盐酸中,充分反应后产生896 mL H2(标准状况),残留固体1.28 g。过滤,滤液中无Cu2+。将滤液加水稀释到200 mL,测得其中c(H+)为0.400 mol/L。则原混合物中单质铁的质量是
| A.2.4g | B.3.36g | C.5.60g | D.10.08g |
您最近一年使用:0次
2016-12-09更新
|
2789次组卷
|
7卷引用:2014-2015四川省遂宁市射洪中学高一下学期第一次月考化学试卷
2014-2015四川省遂宁市射洪中学高一下学期第一次月考化学试卷2016届吉林省长春市第十一高中高三上学期期中测试化学试卷2016届湖南长沙市长郡中学三上学期第四次月考化学试卷江苏省启东中学2016-2017学年高一(创新班)下学期期中考试化学试题江苏省连云港市锦屏高级中学2016-2017学年高二上学期期中考试化学试题辽宁省实验中学2021-2022学年高一上学期12月月考化学试题(已下线)3.1.2 铁盐和亚铁盐-2022-2023学年高一化学上学期课后培优分级练(人教版2019必修第一册)
解题方法
5 . 氯化亚铜(CuCl)常用作有机合成工业中的催化剂,是一种白色粉末;微溶于水、不溶于乙醇及稀硫酸;在空气中迅速被氧化成绿色;见光则分解,变成褐色;下图是工业上以制作印刷电路的废液(含Fe3+、Cu2+、Fe2+、Cl-)生产CuCl的流程如下:
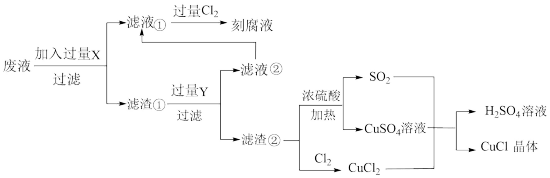
(1)工业生产硫酸的第一步反应如下,请配平该化学方程式并用单线桥法标注电子转移的方向和数目:____________________
______FeS2+______ O2 ______SO2+______Fe2O3
O2 ______SO2+______Fe2O3
(2)写出生产过程中X____________________ ,Y____________________ (填化学式)。
(3)产生CuCl的化学方程式____________________ 。
(4)氯化亚铜的定量分析:
①称取样品0.25g 置于预先放入10mL过量的FeCl3溶液250mL的锥形瓶中,不断摇动;
②待样品溶解后,加水50mL,邻菲罗啉指示剂2滴;
③立即用0.10 mol•L-1硫酸铈Ce(SO4)2标准溶液滴至绿色出现为终点。如此再重复二次测得数据如下:
(已知:CuCl + FeCl3 =CuCl2 + FeCl2 Fe2+ + Ce4+ = Fe3+ + Ce3+ )
④数据处理:计算得CuCl的纯度为____________________ 。(平行实验结果相差不能超过0.3%)

(1)工业生产硫酸的第一步反应如下,请配平该化学方程式并用单线桥法标注电子转移的方向和数目:
______FeS2+______
 O2 ______SO2+______Fe2O3
O2 ______SO2+______Fe2O3(2)写出生产过程中X
(3)产生CuCl的化学方程式
(4)氯化亚铜的定量分析:
①称取样品0.25g 置于预先放入10mL过量的FeCl3溶液250mL的锥形瓶中,不断摇动;
②待样品溶解后,加水50mL,邻菲罗啉指示剂2滴;
③立即用0.10 mol•L-1硫酸铈Ce(SO4)2标准溶液滴至绿色出现为终点。如此再重复二次测得数据如下:
(已知:CuCl + FeCl3 =CuCl2 + FeCl2 Fe2+ + Ce4+ = Fe3+ + Ce3+ )
| 1 | 2 | 3 | |
| 0.25克样品消耗硫酸铈标准溶液的体积(mL) | 23.85 | 24.35 | 23.95 |
④数据处理:计算得CuCl的纯度为
您最近一年使用:0次
6 . 某常见二价过渡金属的盐A可发生如图所示的变化,其中B为黑色固体氧化物;C、G为气体氧化物;E为固体单质且不与稀H2SO4反应;D为气体单质;E与F反应时,除生成A外随F的浓度不同产物可以是C也可以是G。
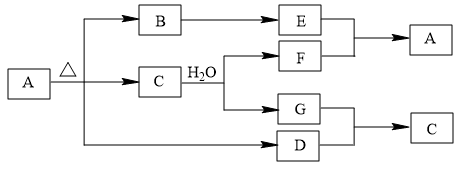
请完成下列问题:
(1)A的化学式_________ ,D的化学式_________________ 。
(2)B转化为E时,有多种方法,请写出其中一个反应的化学方程式_______________ 。
(3)C与H2O反应的化学方程式为______________________________ 。
(4)写出E与足量F的浓溶液反应的实验现象:___________________________ 。
(5)A分解时生成C和D的物质的量之比为__________ 。

请完成下列问题:
(1)A的化学式
(2)B转化为E时,有多种方法,请写出其中一个反应的化学方程式
(3)C与H2O反应的化学方程式为
(4)写出E与足量F的浓溶液反应的实验现象:
(5)A分解时生成C和D的物质的量之比为
您最近一年使用:0次
7 . 某校兴趣小组对SO2与新制Cu(OH)2悬浊液的反应进行探究,实验如下:
(1)制取新制Cu(OH)2悬浊液的离子方程式为_________ 。
(2)甲同学重新用实验II的方法制备新制Cu(OH)2悬浊液,过滤,用蒸馏水洗涤干净。向洗净后的Cu(OH)2中加入5 mL蒸馏水,再持续通入SO2气体,现象与实验I相同,此步实验证明:_________ 。检验Cu(OH)2洗涤干净的方法是_________ 。
(3)同学们对白色沉淀的成分继续进行探究。查阅资料如下:CuCl为白色固体,难溶于水,能溶于浓盐酸。它与氨水反应生成Cu(NH3)2+,在空气中会立即被氧化成含有蓝色Cu(NH3)42+溶液。
①甲同学向洗涤得到的白色沉淀中加入氨水,得到蓝色溶液,此过程中反应的离子方程式为:CuCl + 2NH3·H2O = Cu(NH3) +Cl- + 2H2O 、
+Cl- + 2H2O 、 _________ 。
②乙同学用另一种方法证明了该白色沉淀为CuCl,实验方案如下:

填写下表空格:
③写出实验II中由Cu(OH)2生成白色沉淀的离子方程式:_________ 。
(4)丙同学通过实验证明:实验Ⅰ中观察到的砖红色沉淀是Cu2O。完成合理的实验方案:取少量Cu2O固体于试管中,__________ ,则说明砖红色沉淀是Cu2O。
| 装置 | 序号 | 试管中的药品 | 现象 |
持续通入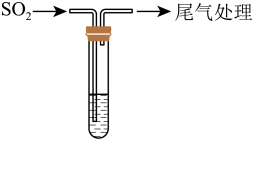 | 实验Ⅰ | 1.5 mL 1 mol·L-1 CuSO4溶液和3.5 mL 1 mol·L-1 NaOH溶液混合 | 开始时有砖红色沉淀出现,一段时间后,砖红色沉淀消失,静置,试管底部有少量紫红色固体,溶液呈绿色 |
实验Ⅱ | 1.5 mL 1 mol·L-1 CuCl2溶液和3.5 mL 1 mol·L-1 NaOH溶液混合 | 开始时有黄色沉淀出现,一段时间后,黄色沉淀消失,静置,生成大量白色沉淀,溶液呈绿色 |
(2)甲同学重新用实验II的方法制备新制Cu(OH)2悬浊液,过滤,用蒸馏水洗涤干净。向洗净后的Cu(OH)2中加入5 mL蒸馏水,再持续通入SO2气体,现象与实验I相同,此步实验证明:
(3)同学们对白色沉淀的成分继续进行探究。查阅资料如下:CuCl为白色固体,难溶于水,能溶于浓盐酸。它与氨水反应生成Cu(NH3)2+,在空气中会立即被氧化成含有蓝色Cu(NH3)42+溶液。
①甲同学向洗涤得到的白色沉淀中加入氨水,得到蓝色溶液,此过程中反应的离子方程式为:CuCl + 2NH3·H2O = Cu(NH3)
 +Cl- + 2H2O 、
+Cl- + 2H2O 、 ②乙同学用另一种方法证明了该白色沉淀为CuCl,实验方案如下:

填写下表空格:
| 试剂1 | 试剂2 | 蒸馏水 | |
| 现象1 | 现象2 |
(4)丙同学通过实验证明:实验Ⅰ中观察到的砖红色沉淀是Cu2O。完成合理的实验方案:取少量Cu2O固体于试管中,
您最近一年使用:0次
名校
解题方法
8 . 高纯碳酸锰在电子工业中有重要的应用,湿法浸出软锰矿(主要成分为MnO2,含少量Fe、Al、Mg等杂质元素)制备高纯碳酸锰的实验过程如下:
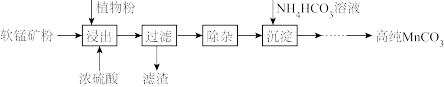
(1)浸出:浸出时温度控制在90℃~95℃之间,并且要连续搅拌3小时的目的是____ ,植物粉的作用是____ 。
(2)除杂:①向浸出液中加入一定量的碳酸锰矿,调节浸出液的pH为3.5~5.5;
②再加入一定量的软锰矿和双氧水,过滤;
③…
操作①中使用碳酸锰调pH的优势是____ ;操作②中加入双氧水不仅能将Fe2+氧化为Fe3+,而且能提高软锰矿的浸出率。写出双氧水提高软锰矿浸出率的离子方程式____ 。
(3)制备:在30 ℃~35 ℃下, 将碳酸氢铵溶液滴加到硫酸锰净化液中,控制反应液的最终pH在6.5~7.0,得到MnCO3沉淀。温度控制35 ℃以下的原因是____ ;该反应的化学方程式为____ ;生成的MnCO3沉淀需经充分洗涤,检验洗涤是否完全的方法是____ 。
(4)计算:室温下,Ksp(MnCO3)=1.8×10-11,Ksp(MgCO3)=2.6×10-5,已知离子浓度小于1.0×10-5mol·L-1时,表示该离子沉淀完全。若净化液中的c(Mg2+)=10-2mol/L,试计算说明Mg2+的存在是否会影响MnCO3的纯度。_____________________________________

(1)浸出:浸出时温度控制在90℃~95℃之间,并且要连续搅拌3小时的目的是
(2)除杂:①向浸出液中加入一定量的碳酸锰矿,调节浸出液的pH为3.5~5.5;
②再加入一定量的软锰矿和双氧水,过滤;
③…
操作①中使用碳酸锰调pH的优势是
(3)制备:在30 ℃~35 ℃下, 将碳酸氢铵溶液滴加到硫酸锰净化液中,控制反应液的最终pH在6.5~7.0,得到MnCO3沉淀。温度控制35 ℃以下的原因是
(4)计算:室温下,Ksp(MnCO3)=1.8×10-11,Ksp(MgCO3)=2.6×10-5,已知离子浓度小于1.0×10-5mol·L-1时,表示该离子沉淀完全。若净化液中的c(Mg2+)=10-2mol/L,试计算说明Mg2+的存在是否会影响MnCO3的纯度。
您最近一年使用:0次
2016-12-09更新
|
721次组卷
|
2卷引用:2015届江苏省扬州市高三上学期期末考试化学试卷
9 . CrO3主要用于电镀工业,做自行车、仪表等日用五金电镀铬的原料。CrO3具有强氧化性,热稳定性较差,加热时逐步分解,其固体残留率随温度的变化如图所示。
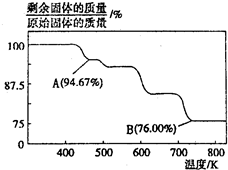
请回答下列问题:
(1)B点时剩余固体的化学式是____________ 。
(2)加热至A点时反应的化学方程式为______________________________ 。
(3)CrO3具有两性,写出CrO3溶解予KOH溶液的反应化学方程式____________________ 。
(4)三氧化铬还用于交警的酒精测试仪,以检查司机是否酒后驾车。若反应后红色的CrO3变为绿色的Cr2(SO4)3,酒精被完全氧化为CO2,则其离子方程式为_______________ 。
(5)由于CrO3和K2Cr2O7均易溶于水,所以电镀废水的排放是造成铬污染的主要原因。某工厂采用电解法处理含铬废水,耐酸电解槽用铁板作阴、阳极,槽中盛放含铬废水,原理示意图如图:
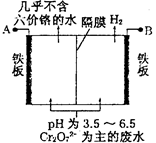
①A为电源___________ 极,阳极区溶液中发生的氧化还原反应为________________________ 。
②已知电解后阳极区溶液中c(Fe3+)为2.0×10-13 mol·L-1,则c(Cr3+)为__________ mol·L-1。{已知Ksp[Fe(OH)3]=4.0×10-38,Ksp[Cr(OH)3]=6.0×10-31}

请回答下列问题:
(1)B点时剩余固体的化学式是
(2)加热至A点时反应的化学方程式为
(3)CrO3具有两性,写出CrO3溶解予KOH溶液的反应化学方程式
(4)三氧化铬还用于交警的酒精测试仪,以检查司机是否酒后驾车。若反应后红色的CrO3变为绿色的Cr2(SO4)3,酒精被完全氧化为CO2,则其离子方程式为
(5)由于CrO3和K2Cr2O7均易溶于水,所以电镀废水的排放是造成铬污染的主要原因。某工厂采用电解法处理含铬废水,耐酸电解槽用铁板作阴、阳极,槽中盛放含铬废水,原理示意图如图:

①A为电源
②已知电解后阳极区溶液中c(Fe3+)为2.0×10-13 mol·L-1,则c(Cr3+)为
您最近一年使用:0次
10 . 111
Ⅰ.已知向含有淀粉的10mL 0.2mol/L KIO3酸性溶液滴加0.3mol/LNaHSO3溶液的过程中,溶液的颜色先变蓝色,然后褪色,发生的离子反应如下:
①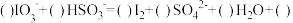 ;
;
②I2+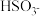 +H2O=2I-+SO
+H2O=2I-+SO +3H+
+3H+
回答下列问题:
(1)写出①反应的离子反应方程式____________________ .
(2)根据①②反应写出还原性粒子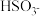 ,I2,I-由强到弱的顺序
,I2,I-由强到弱的顺序____________ .
(3)溶液刚好褪色时,则消耗的NaHSO3溶液的体积为__________________ .
(4)预测已知向含有淀粉的NaHSO3溶液滴加KIO3溶液的现象_________________ .
Ⅱ.在密闭容器中,将碳酸氢钠和过氧化钠的混合粉未加热至250℃,使其充分反应最后测得残余固体中两种化合物的组成分别为amol和bmol,且a>b,试回答下列问题
(5)反应后中固体的成分及其物质的量是:_______________
(6)原混合物中碳酸氢钠和过氧化钠的物质的量分别为:_______________
(7)反应后容器气态物质成分及其物质的量是:_______________
Ⅰ.已知向含有淀粉的10mL 0.2mol/L KIO3酸性溶液滴加0.3mol/LNaHSO3溶液的过程中,溶液的颜色先变蓝色,然后褪色,发生的离子反应如下:
①
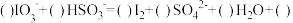 ;
;②I2+
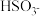 +H2O=2I-+SO
+H2O=2I-+SO +3H+
+3H+回答下列问题:
(1)写出①反应的离子反应方程式
(2)根据①②反应写出还原性粒子
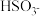 ,I2,I-由强到弱的顺序
,I2,I-由强到弱的顺序(3)溶液刚好褪色时,则消耗的NaHSO3溶液的体积为
(4)预测已知向含有淀粉的NaHSO3溶液滴加KIO3溶液的现象
Ⅱ.在密闭容器中,将碳酸氢钠和过氧化钠的混合粉未加热至250℃,使其充分反应最后测得残余固体中两种化合物的组成分别为amol和bmol,且a>b,试回答下列问题
(5)反应后中固体的成分及其物质的量是:
(6)原混合物中碳酸氢钠和过氧化钠的物质的量分别为:
(7)反应后容器气态物质成分及其物质的量是:
您最近一年使用:0次



